Ferrioxalate de potassium
Le ferrioxalate de potassium, ou tris(oxalato)ferrate(III) de potassium[4], est un composé chimique de formule K3[Fe(C2O4)3], qu'on trouve souvent sous forme de trihydrate K3[Fe(C2O4)3]·3H2O. Ces deux substances sont des solides cristallisés de couleur vert citron[4]. Il s'agit d'un sel d'anions ferrioxalate [Fe(C2O4)3]3− et de cations de potassium K+. L'anion est lui-même un complexe formé de trois ions oxalate [C2O4]− bidentés chélatant un atome de fer à l'état d'oxydation +3. Les cations de potassium agissent comme contre-ions. En solution, le sel se dissocie en libérant l'anion ferrioxalate, qui donne une couleur verte fluorescente. Ce dernier est relativement stable dans l'obscurité mais se décompose à la lumière ou en présence d'un rayonnement électromagnétique de haute énergie. Cette propriété photosensible est utilisée pour l'actinométrie chimique, la mesure du flux lumineux et la préparation de blueprints.
| Ferrioxalate de potassium | |
| |
| Structure du ferrioxalate de potassium | |
| Identification | |
|---|---|
| Synonymes |
tris(oxalato)ferrate(III) de potassium |
| No CAS | (anhydre) (trihydrate) |
| No ECHA | 100.035.398 |
| No CE | 238-954-7 |
| PubChem | 9932777 |
| SMILES | |
| InChI | |
| Apparence | solide hygroscopique vert cristallisé[1] |
| Propriétés chimiques | |
| Formule | C6FeK3O12 |
| Masse molaire[2] | 437,197 ± 0,011 g/mol C 16,48 %, Fe 12,77 %, K 26,83 %, O 43,91 %, |
| Propriétés physiques | |
| T° fusion | 230 °C, le trihydrate perdant son eau de cristallisation à 113 °C[3] |
| Masse volumique | 2,133 g/cm3[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Le ferrioxalate de potassium peut être obtenu par réaction entre le sulfate de fer(III) Fe2(SO4)3, l'oxalate de baryum BaC2O4 et l'oxalate de potassium K2C2O4[5] :
Cette méthode consiste à remplacer en solution les ions sulfate SO42− par des ions oxalate C2O42− tandis que le sulfate de baryum BaSO4 est éliminé par filtration, ce qui permet de cristalliser le ferrioxalate de potassium.
Structure
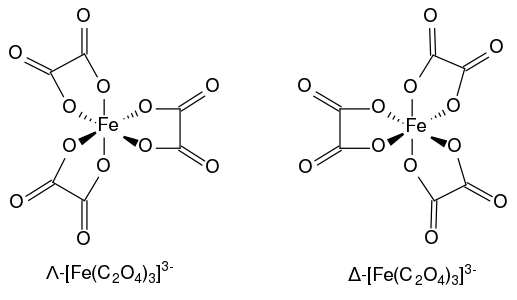
La structure du ferrioxalate anhydre et celle de son trihydrate ont été largement étudiées[6]. Le complexe anionique doit sa solidité aux liaisons covalentes de coordination entre les atomes d'oxygène des ligands oxalate qui partagent un doublet non liant avec les orbitales p et d de l'atome de fer central : ce dernier a trois électrons dans ses orbitales d, ce qui permet d'accueillir 13 électrons, dont douze provenant des trois ligands. L'atome de fer a une géométrie octaédrique distordue. Le complexe présente une symétrie moléculaire D3 avec chacune des six liaisons Fe–O longues d'environ 200 pm, ce qui indique que l'atome Fe(III) est à l'état haut spin dans la mesure où un complexe bas spin présenterait une distorsion par effet Jahn-Teller.
Le complexe ferrioxalate [Fe(C2O4)3]3− présente une chiralité hélicoïdale en raison des deux géométries non superposables qu'il peut adopter. Conformément à la convention IUPAC, le diastéréoisomère ayant un pas de vis orienté à gauche est noté Λ tandis que celui ayant un pas de vis orienté à droite est noté Δ[7].
Réactions
L'anion ferrioxalate est sensible à la lumière et aux rayonnements électromagnétiques de haute énergie, y compris les rayons X et les rayons γ. L'absorption d'un photon provoque la décomposition d'un ion oxalate en dioxyde de carbone CO2 et la réduction de l'atome de fer(III) en fer(II)[8].
Le trihydrate perd ses trois molécules d'eau de cristallisation à 113 °C[3]. À 296 °C, le sel anhydre se décompose en dioxyde de carbone, oxalate de potassium et complexe bis(oxalato)ferrate(II) de potassium[3] :
Applications
La découverte de la photolyse efficace de l'anion ferrioxalate a été un événement marquant pour la photochimie et l'actinométrie. Le sel de potassium s'est révélé être plus d'un millier de fois plus sensible que l'oxalate d'uranyle UO2C2O4 qui était historiquement employé dans cette application[8] - [9].
La synthèse et la décomposition thermique du ferrioxalate de potassium est un exercice couramment réalisé dans l'enseignement secondaire car il illustre la chimie des complexes de métaux de transition, la photochimie observable à l'œil nu et l'analyse thermogravimétrique[10].
Avant l'utilisation d'imprimantes laser et d'imprimantes à jet d'encre, les dessins techniques de grande taille étaient couramment reproduits par la méthode du cyanotype (« blueprints »), c'est-à-dire un processus processus photographique produisant un négatif blanc sur fond bleu. Le procédé repose sur la photolyse d'un complexe de fer(III) converti en fer(II) insoluble dans les zones du papier exposées à la lumière. Le complexe utilisé pour les cyanotypes était généralement le citrate d'ammonium ferrique (NH4)5[Fe(C6H4O7)2], mais le ferrioxalate de potassium a également été employé[11].
Notes et références
- « Fiche du composé Potassium trioxalatoferrate(III) trihydrate », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J. Ladriere, « Mössbauer study on the thermal decomposition of potassium tris (oxalato) ferrate(III) trihydrate and bis (oxalato) ferrate(II) dihydrate », Hyperfine Interactions, vol. 70, , p. 1095–1098 (DOI 10.1007/BF02397520, lire en ligne)
- (en) A. Saritha, B. Raju, M. Ramachary, P. Raghavaiah et K. A. Hussain, « Synthesis, crystal structure and characterization of chiral, three-dimensional anhydrous potassium tris(oxalato)ferrate(III) », Physica B: Condensed Matter, vol. 407, no 21, , p. 4208-4213 (DOI 10.1016/j.physb.2012.07.005, lire en ligne)
- (en) John C. Bailar Jr., Eldon M. Jones, H. S. Booth et M. Grennert, « Trioxalato Salts (Trioxalatoaluminiate, -ferriate, -chromiate, and -cobaltiate) », Inorganic Syntheses, vol. 1, (DOI 10.1002/9780470132326.ch13, lire en ligne)
- (en) Peter C. Junk, « Supramolecular interactions in the X-ray crystal structure of potassium tris(oxalato)ferrate(III) trihydrate », Journal of Coordination Chemistry, vol. 58, no 4, , p. 355-361 (DOI 10.1080/00958970512331334250, S2CID 216142329, lire en ligne)
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, 2e éd., Butterworth-Heinemann, 1997. (ISBN 978-0-08-037941-8)
- (en) C. G. Hatchard et C. A. Parker, « A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer », Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences, vol. 235, no 1203, , p. 518-536 (DOI 10.1098/rspa.1956.0102, Bibcode 1956RSPSA.235..518H, S2CID 98652159, lire en ligne)
- (en) Ivan P. Pozdnyakov, Oksana V. Kel, Victor F. Plyusnin, Vjacheslav P. Grivin et Nikolai M. Bazhin, « New Insight into Photochemistry of Ferrioxalate », The Journal of Physical Chemistry A, vol. 112, no 36, , p. 8316-8322 (PMID 18707071, DOI 10.1021/jp8040583, Bibcode 2008JPCA..112.8316P, lire en ligne)
- (en) John Olmsted, « Preparation and analysis of potassium tris(oxalato)ferrate(III)trihydrate: A general chemistry experiment », Journal of Chemical Education, vol. 61, no 12, , p. 1098 (DOI 10.1021/ed061p1098, lire en ligne)
- (en) Pablo Alejandro Fiorito et André Sarto Polo, « A New Approach toward Cyanotype Photography Using Tris-(oxalato)ferrate(III): An Integrated Experiment », Journal of Chemical Education, vol. 92, no 10, , p. 1721-1724 (DOI 10.1021/ed500809n, lire en ligne)