Liaison covalente de coordination
Une liaison covalente de coordination (anciennement connue sous le nom de liaison dative, maintenant obsolète[1]) est une description de la liaison covalente entre deux atomes pour lesquels les deux électrons partagés dans la liaison proviennent du même atome. La distinction par rapport à une liaison covalente ordinaire est artificielle, mais la terminologie est fréquente dans les manuels, et tout particulièrement ceux traitant des composés de coordination. Une fois les liaisons formées par ce biais, sa force et sa description n'est pas différente des autres liaisons polaires.
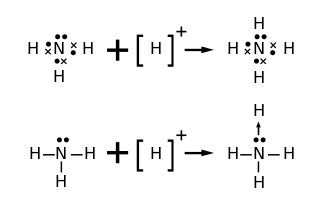
Les liaisons covalentes de coordination sont évoquées lorsqu'une base de Lewis (donneur d'électrons) fournit une paire d'électrons à un acide de Lewis (accepteur d'électrons) afin de donner un adduit. Le processus de formation d'une liaison dative est appelé coordination. Le donneur d'électrons acquiert une charge positive, l'accepteur d'électrons acquérant dans le même temps une charge formelle négative.
Exemples
De manière classique, tout composé contenant une paire d'électrons non appariés peut former une liaison de coordination. La liaison dans divers composés chimiques peut être décrite comme une liaison covalente de coordination.
- Le monoxyde de carbone (CO) peut être considéré comme présentant une liaison de coordination et deux liaisons covalentes « normales » entre les atomes de carbone et d'oxygène. Cette description très inhabituelle illustre la flexibilité de ce type de description. Ainsi dans le CO, le carbone est l'accepteur d'électron et l'oxygène le donneur d'électron.
- L'ion ammonium (NH4+) peut être perçu comme comprenant quatre liaisons covalentes de coordination entre les protons (ions H+) et le trianion azote N3−.
- Le chlorure de béryllium (BeCl2) est décrit comme déficitaire en électrons dans le sens où les espèces triatomiques (qui existent en phase gazeuse) entourent les centres Be avec quatre électrons de valence. Lorsqu'ils sont traités par du chlore en excès, les ions Be2+ se lient avec quatre ions chlorure pour former l'anion tétrachlorobéryllate, BeCl42−, dans lequel tous les ions respectent la règle de l'octet pour les électrons.
D'autre part, les liaisons de coordination sont très courantes dans les molécules du vivant ayant une partie métallique : dans les chélats, dans les doigts de zinc (dans des molécules interagissant avec l'ADN comme le récepteur de l'ecdysone) ainsi que dans tous les composés tétrapyrroliques ou à base de pyrrole tels que l'hémoglobine, la myoglobine ou le phytochrome dont les liaisons de coordination sont fondamentales pour la réalisation de leurs fonctions biologiques.
Composés de coordination
La notion de liaison de coordination est couramment utilisée pour décrire les complexes de coordination, et particulièrement ceux impliquant des ions métalliques. Dans de tels complexes, plusieurs bases de Lewis donnent leurs paires d'électrons « libres » à un autre cation métallique dépourvu, qui agit comme un acide de Lewis et accepte donc les électrons. Des liaisons de coordination se forment et le composé résultant est appelé « complexe de coordination », et les donneurs d'électrons sont appelés « ligands ». Une description plus utile de la liaison dans les composés de coordination est fournie par la théorie du champ de ligands, qui traite des orbitales moléculaires pour la description des liaisons dans de tels composés polyatomiques.
De nombreux composés chimiques peuvent servir de ligands, comme ceux contenant des ions oxygène, soufre, azote et halogènes. Le ligand le plus commun est l'eau (H2O, ligand aqua), qui forme des complexes de coordination avec des ions métalliques (comme l'ion hexaaquacuivre(II), [Cu(H2O)6]2+). L'ammoniac (NH3) (ligand amine, dans ce contexte) est aussi un ligand commun, comme certains anions, spécialement les ions fluorure (F−), chlorure (Cl−), cyanure (CN−), ainsi que des molécules neutres telles le monoxyde de carbone (CO) et les phosphines (PR3).
Références
- (en) « dative bond », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Coordinate covalent bond » (voir la liste des auteurs).