Sulfate de fer(III)
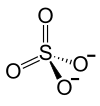
Le sulfate de fer(III) (sulfate ferrique) est le sel de fer(III) de l'acide sulfurique. Sa formule chimique est Fe2(SO4)3.
| Sulfate de fer(III) | |
  |
|
| Identification | |
|---|---|
| No CAS | (hydrate) |
| No ECHA | 100.030.054 |
| No RTECS | NO8505000 |
| PubChem | 24826 |
| ChEBI | 53438 |
| SMILES | |
| InChI | |
| Apparence | poudre incolore, inodore, hygroscopique et sensible à la lumière[1] |
| Propriétés chimiques | |
| Formule | Fe2(SO4)3 |
| Masse molaire[2] | 399,878 ± 0,023 g/mol Fe 27,93 %, O 48,01 %, S 24,06 %, |
| Propriétés physiques | |
| T° fusion | 480 °C (décomposition en oxydes de soufre et de fer)[1] 175 °C (élimination de l'eau du nonahydrates)[1] |
| Solubilité | eau : difficile pour la forme anhydre, 4 400 g·l-1 pour le nonahydrate[1] |
| Masse volumique | 3,10 g·cm-3[3] 2,1 g·cm-3 (nonahydrate)[3] |
| Précautions | |
| SGH[1] | |
  |
|
| Écotoxicologie | |
| DL50 | 500 mg/kg (rat, oral)[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrences naturelles
Les sulfates de fer se trouvent dans plusieurs minéraux rares et sans importance commerciale. La mikasaïte, un sulfate mixte de fer et d'aluminium de formule chimique (Fe3+, Al3+)2(SO4)3[5] est le nom de la forme minéralogique du sulfate de fer(III). Cette forme anhydre est très rare et est associée à des feux de charbon. Les hydrates sont plus communs, la coquimbite (nonahydrate) étant probablement le plus courant d'entre eux. La paracoquimbite est l'autre nonahydrate naturel, rarement rencontré. La kornélite (heptahydrate) et la quenstedtite (décahydrate) sont peu fréquents. La lausénite (hexa- ou pentahydrate) est une espèce douteuse. Tous les hydrates naturels mentionnés sont instables et liés à la météorisation (oxydation aérobique) de minéraux primaires contenant du fer (principalement la pyrite et la marcassite).
Notes et références
- Entrée « Iron(III) sulfate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 5/01/2017 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- David R. Lide, CRC Handbook of Chemistry and Physics, 90e éd. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, p. 4-69.
- Fiche MSDS chez MartinBaker.
- Mikasaite

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} \mathrm {\ {\Biggl [}} }](https://img.franco.wiki/i/bafeab07e1d5bb8bb77e0767e55563945c55cd72.svg)
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}} }](https://img.franco.wiki/i/cd32744e9f4314d390f5ee107a8bd812d0cc2da0.svg)