Ferrioxalate
L'anion ferrioxalate, ou tris(oxalato)ferrate(III), est un complexe de formule chimique [Fe(C2O4)3]3−. Il est formé d'anions oxalate C2O42− chélatant un cation de fer Fe3+ à l'état d'oxydation +3. Il donne une couleur vert citron à ses sels et est fluorescent en solution. Il est sensible à la lumière et aux rayonnements électromagnétiques de haute énergie, qui induisent sa décomposition en dioxyde de carbone et la réduction du fer(III) en fer(II), propriété utilisée en actinométrie.
| Anion ferrioxalate | |
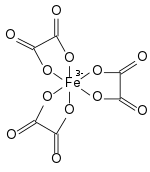
| |
| Structure de l'anion ferrioxalate | |
| Identification | |
|---|---|
| Nom UICPA | tris(oxalato)ferrate(III) |
| No CAS | |
| PubChem | 167279 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6O12Fe− |
| Masse molaire[1] | 319,902 ± 0,01 g/mol C 22,53 %, Fe 17,46 %, O 60,02 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Le sel de ferrioxalate le plus couramment étudié est le ferrioxalate de potassium K3[Fe(C2O4)3], mais les sels de sodium Na+, d'ammonium NH4+ et de lithium Li+ ont également fait l'objet de recherches.
Structure
Le complexe anionique doit sa solidité aux liaisons covalentes de coordination entre les atomes d'oxygène des ligands oxalate qui partagent un doublet non liant avec les orbitales p et d de l'atome de fer central : ce dernier a trois électrons dans ses orbitales d, ce qui permet d'accueillir 13 électrons, dont douze provenant des trois ligands. L'atome de fer a une géométrie octaédrique distordue. Le complexe présente une symétrie moléculaire D3 avec chacune des six liaisons Fe–O longues d'environ 200 pm, ce qui indique que l'atome Fe(III) est à l'état haut spin dans la mesure où un complexe bas spin présenterait une distorsion par effet Jahn-Teller. Les sels d'ammonium et les mélanges de sels de sodium et de potassium sont isomorphes, de même que les complexes apparentés de cations d'aluminium Al3+, de chrome Cr3+ et de vanadium V3+.
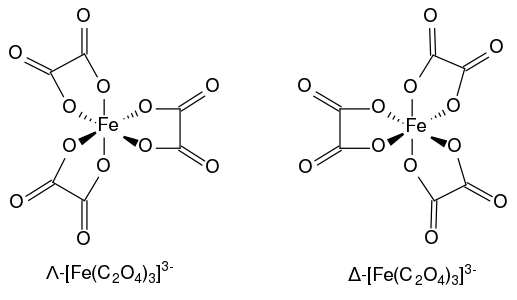
Le complexe ferrioxalate [Fe(C2O4)3]3− présente une chiralité hélicoïdale en raison des deux géométries non superposables qu'il peut adopter. Conformément à la convention IUPAC, le diastéréoisomère ayant un pas de vis orienté à gauche est noté Λ tandis que celui ayant un pas de vis orienté à droite est noté Δ[2].
Photolyse
En l'absence de lumière et d'autres radiations, l'anion ferrioxalate est plutôt stable. Les sels de potassium et de sodium ainsi que leurs solutions peuvent être chauffées à près de 100 °C pendant plusieurs heures sans décomposition notable.
En solution, il est sujet à photolyse : l'absorption de photons conduit à la réduction du complexe en [Fe(C2O4)2]2− avec oxydation des anions oxalate en CO2[3] :
Cette réaction est exploitée en photométrie et actinométrie dans des applications permettant de mesurer l'intensité de flux lumineux et de rayonnements électromagnétiques de haute énergie. Le ferrioxalate de potassium est environ un millier de fois plus sensible que l'oxalate d'uranyle UO2C2O4 qui était historiquement employé dans ce type d'application[3] - [4].
L'anion est insensible aux neutrons, mais le ferrioxalate de lithium Li3[Fe(C2O4)3] peut être employé pour les mesurer. Un noyau de lithium 6 6
3Li peut absorber un neutron 1
0n puis émettre une particule alpha 4
2He et un noyau de tritium 3
1T de haute énergie qui décomposent probablement le ferrioxalate[5].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, 2e éd., Butterworth-Heinemann, 1997. (ISBN 978-0-08-037941-8)
- (en) C. G. Hatchard et C. A. Parker, « A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer », Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences, vol. 235, no 1203, , p. 518-536 (DOI 10.1098/rspa.1956.0102, Bibcode 1956RSPSA.235..518H, S2CID 98652159, lire en ligne)
- (en) Ivan P. Pozdnyakov, Oksana V. Kel, Victor F. Plyusnin, Vjacheslav P. Grivin et Nikolai M. Bazhin, « New Insight into Photochemistry of Ferrioxalate », The Journal of Physical Chemistry A, vol. 112, no 36, , p. 8316-8322 (PMID 18707071, DOI 10.1021/jp8040583, Bibcode 2008JPCA..112.8316P, lire en ligne)
-
(en) Akashi Junko, Uchida Yoshio, Kojima Tomoko, Katada Motomi et Sano Hirotoshi, « Mössbauer Spectroscopic Studies of the Effects of the 6Li(n, α)T Reaction in Lithium Tris(oxalato)ferrate(III) », Bulletin of the Chemical Society of Japan, vol. 57, no 4, , p. 1076-1078 (DOI 10.1246/bcsj.57.1076, lire en ligne
 )
)