Didemnum vexillum
Didemnum vexillum, communément appelé le Didemne étendard, est l'une des espèces de tuniciers coloniaux marins, classée dans la famille des didemnidés. Les colonies de ce tunicier présentent une croissance en tapis, parfois d'une taille exceptionnelle, pouvant alors recouvrir la totalité des substrats qu’il rencontre.

C'est l'une des dernières espèces de didemnes scientifiquement décrites (en 2002). Elle montre depuis la toute fin du XXe siècle des capacités importantes d'invasivité, le plus souvent dans des milieux pollués et/ou anthropisés (par exemple dans l'estuaire de l'Escaut ou dans la lagune de Venise (sur toutes les parties immergées des quais, pieux, pontons, phénomène jusqu'alors jamais observé en Méditerranée[2])
Autres dénominations
Les anglophones le dénomment parfois « Ascidie en cuir à gants » pour sa texture et couleur qui évoquent chez certains spécimens un cuir humide, ou ascidie-tapis (carpet sea squirt), ou « vomi de mer » (« marine vomit »[3]).
En Alaska, on lui a donné un diminutif : "D. vexer" qui provient de son nom scientifique[4].
Description

Cette colonie a été photographiée à 4 m de profondeur au large de la plage de la ville américaine de Sandwich (Massachusetts) le par l'USGS
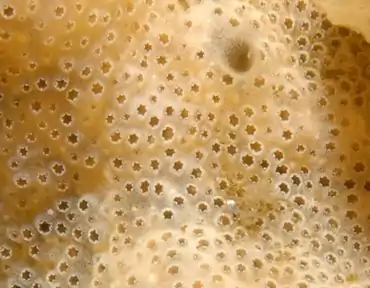
L'identification certaine de D. vexillum est délicate, car ce tunicier ressemble beaucoup à d’autres didemnidés (dont autochtones d'autres régions) et parce que la taille et l’aspect des colonies varient beaucoup selon les contextes (ex : couleur généralement brun crème, mais pouvant être orange, rose, jaune, beige ou de couleur jaune-crème)[4]. Sa surface est légèrement veinée et plus ou moins constellée de petits pores. Sa texture est lisse, évoquant une gélatine et coriace plus que visqueuse[4].
Plusieurs caractères morphologiques lui sont propres, décrits par Kott en 2002[5] et Lambert en 2009[6] avec une description détaillées et illustrée de l’espèce. On observe notamment :
- un motif externe réticulé, assez caractéristique de la surface de ses colonies[2] ;
- des spicules (visibles au microscope) variables en taille et en forme (une caractéristique de l’espèce). Elles sont surtout présentes sous la surface de la tunique et en faible quantité par rapport à celles des éponges[2]. Ces spicules ont habituellement une forme d'étoiles à neuf à onze branches piquantes[7]. Les spicules sont constitués de cristaux de calcium. Comme chez les éponges ces spicules sont probablement aussi un moyen de défense contre la prédation (chez l’éponge elles sont constituées de silices). Comme chez l'éponge, ces spicules ont une taille et forme propre à chaque espèce, et sont donc utilisés comme critère de détermination des espèces[4] ;
- des larves couvées (sous la surface de la matrice) jusqu’à leur maturité[2] ;
- 6 ampoules latérales de chaque côté du zoïde ; un seul testicule par zooïde, rond et recouvert par un conduit spermatique spiralé (avec généralement 8 spires, parfois 9 [2]) ;
- Quand on presse un tunicier, il est généralement plus « glissant » (en surface) et moins spongieux et plus élastique qu’une éponge[4].
Les colonies
Cette ascidie forme des colonies pouvant devenir géantes (milliards d’individus). Elles sont souvent fortement accrochées à leur substrat, y compris cordes, lignes, fils qu’il est difficile de totalement nettoyer. Les colonies prennent des aspects très différents selon l’importance du courant et le type de substrat (roche, coque de bateau, cordes, etc.)[4]. Après un certain temps, les colonies (alors dites « matures ») produisent des lobes (éventuellement pendants et parfois vrillant) avec des formes évoquant souvent de doigts ou les rubans de cire fondue coulant le long d’une bougie[4].. Sur les substrats plus horizontaux et là où le courant est plus fort, la colonie a généralement une forme d'épais biofilm plus ou moins ondulé, orné de lobes courts[4].
Écologie, biologie
Didemnum vexillum est une « espèce ingénieur »[8] formant un tapis colonial constitué d’une grande quantité de minuscules individus (+/- 1 mm) dits « zooïdes », fondus dans une « tunique » (ou « matrice ») commune.
Alimentation : ce sont des filtreurs qui consomment de la matière organique en suspension (Microphagie suspensivore). Ils se nourrissent notamment de bactéries et microplancton (animal ou végétal), ainsi que de fins détritus. Chaque zoïde filtre l’eau, laquelle est ensuite évacuée via des canaux partagés par des groupes de zoïdes, vers des siphons, lesquels expulsent cette eau filtrée vers le milieu marin. Ces siphons forment de petits pores bien visibles dans la surface de l'ascidie, pouvant évoquer ceux de certaines éponges (confusions possibles)[4].
Croissance et cycle de vie : d’après les observations faites en Italie, l’optimum de croissance dans cette région semble être le printemps et l’automne, alors que les températures estivales et hivernales freinent le développement des colonies[2]. Une autre étude a montré que la pluviométrie (plus élevée au printemps et en automne en zone tempérée) ou d'autres apports d'eau douce (fonte des neiges/glaces) pourraient aussi défavoriser les espèces sensibles à une baisse de la salinité, et favoriser D. vexillum qui y est plus tolérant.
Reproduction : les ascidies coloniales sont hermaphrodites (à la fois mâle et femelle) et peuvent se reproduire sexuellement (par émission et rencontre de gamètes) mais aussi en bourgeonnant et formant des propagules[4].
Les larves de D. vexillum sont couvées dans la matrice de la colonie, puis planctoniques et dérivantes durant quelques heures puis se fixent sur une surface ou un objet dur[4].
Chaque larve se métamorphose alors en un zooïde potentiellement capable à lui seul de fonder une nouvelle colonie de milliards d’individus[4].
Des lobes peuvent aussi se détacher d’une colonie pour aller s’ancrer ailleurs et également fonder une nouvelle colonie[4].
Invasivité
Si le milieu lui convient, Didemnum vexillum se montre très envahissant grâce à une croissance rapide et une capacité à dominer ou éliminer les autres espèces[4]. Il est depuis le début des années 2000 classé parmi les nombreuses espèces devenant invasives hors de leur aire naturelle de répartition, et jugé à ce titre préoccupant dans plusieurs régions du monde.
Sa présence est maintenant signalée sur un large éventail de substrats (marins ou artificiels) dans le monde, où il est parfois à l'origine de pertes économiques importantes, pour la mariculture et la pêche maritime notamment (conchyliculture en particulier[9]).
C'est une espèce dont les pullulations semblent récentes et de plus en plus graves. Pour ces raisons, ses moyens et capacités de dispersion font l'objet d’études actives[10] afin notamment de mieux anticiper ses effets écologiques et économiques.
En limite nord de son aire actuelle et potentielle d’invasive, le réchauffement de la planète (et donc des océans) pourrait contribuer à son actuel développement sur de nouveaux territoires[11].
Il a été récemment observé en Europe du Nord-ouest (Pays-Bas, France, Irlande, pays de Galles, Écosse, Royaume-Uni (où il a été découvert en 2009[12]), au Canada, dans le Maryland sur la côte est des États-Unis (New Jersey, New York, Connecticut, Rhode Island, Massachusetts, New Hampshire, Maine) , au large des côtes de la Nouvelle-Angleterre sur le « banc Georges » ; les côtes américaines et canadiennes du Pacifique (Californie, Oregon, Washington, Colombie-Britannique, en Alaska et en Nouvelle-Zélande[11]. Lors d’un bioBlitz et d’une étude ayant en janvier 2011 mobilisé des plongeurs, il a été observé un recul hivernal de l’espèce correspondant à un refroidissement de l’eau après un épisode chaud en aout et sous une ferme aquacole, les colonies semblaient d’autant plus denses et présentes qu’on s’approchait du dessous de la ferme aquacole[13].
Habitat
Quand la température, et certaines "qualités" de l'eau lui conviennent (zone tempérée, teneur en microplancton, salinités dépassant 25 ppt), il peut coloniser tous les substrats durs artificiels et naturels (cailloux, galets et rochers, mares intertidales)[4]. Il peut coloniser des substrats à moins de 1 m de fond et au moins jusqu'à 81 m (selon les données disponibles en 2015[11]).
On observe aussi (au moins depuis 2010) des pullulations dans des herbiers de zostères[14] ; de la zone intertidale aux bordures du plateau continentale[4] - [15].
L'été 2012 une étude a montré que dans la lagune de Venise (550 km2 dont 10 % ont été transformés en marais salants) l’espèce ne pullulait que dans la zone euryhaline et intertidale bien balayées par les marées mais qu’elle n’a pas été trouvée dans les zones examinées de flux estuarien ni en périphérie des marais salants[2]. Les auteurs estiment que cette lagune présente des conditions favorables à la pullulation de l'espèce (conditions climatiques, géomorphologiques et de salinité), ainsi qu’un trafic maritime international font de cette lagune de manière plus générale, un secteur parfait pour l'introduction réussie d’espèces non indigènes de zone tempérée[2].
En laboratoire, des spécimens prélevés en Irlande et au Royaume-Uni se sont montrés plus tolérants aux faibles salinités que les tuniciers autochtones, et même que Diplosoma listerianum, une espèce proche de D. vexillum, cosmopolite et largement répartie dans le monde, occupant les mêmes types d’habitats [16]. Ceci laisse penser que cette espèce pourrait être favorisée par les apports d’eau douce et donc par le dérèglement climatique là où il induit une fonte accélérée des glaces, mais aussi par d’éventuelles augmentations des précipitations dans les bassins versants situés en « amont »[16]. Sur la base des données connues sur l'espèce, des chercheurs tentent de modéliser la niche écologique de l’espèce, de mieux comprendre ses vecteurs de propagation pour ainsi prospectivement prévoir où les prochaines invasions se feront[17].
À la fin des années 1990, en situation invasive, l'espèce a pour la première fois été observée en train de coloniser des habitats de zostère[18].
Origine et dynamique de répartition nouvelle
D. vexillum semble être originaire du Japon (il y a en tout cas été trouvé pour la première fois, dans la baie de Mutsu en 1926, et il y est encore commun, sur les roches comme sur les zoostères). Il était réputé limité aux climats tempérés, mais on en observe maintenant des invasions en zone froide (Alaska[19]).
Son aire de répartition est encore mal connue car en extension rapide depuis le début des années 2000, probablement parce qu’il profite à la fois du réchauffement des eaux tempérées du trafic et d’un trafic maritime croissant entre les régions et pays du monde.
Des propagules (fragments de colonies) sont transportés sur les coques de navires et dans les eaux de ballast, et parfois probablement par des engins ou infrastructures infestés (bouées, éléments de plates-formes flottantes ou de forage pétroliers ou gaziers offshore ou d’installations portuaires, corps morts, pontons, bassins flottants de pisciculture ou mariculture, etc.).
Dans certaines parties du monde, les plaisanciers sont ou ont été « considérés comme le vecteur le plus susceptible de distribution de tuniciers envahissants » (Ainsi en Irlande, l'espèce a d’abord et principalement été repérée dans des marinas[20], mais la clarté de l’eau et la pression d’observation y sont peut-être plus importantes que dans les ports de marine marchande). Les coques de navires caboteurs, des bateaux de pêche, de petits navires et de grand navires lents faisant du commerce à grande distance peuvent très probablement aussi contribuer à sa large diffusion dans le monde.
Il a aussi été trouvé (dont à Washington et en Colombie-Britannique) sur des récifs ou radeaux de moules ce qui invite à penser que les transferts de coquillages ou d'équipement de conchyliculture peuvent jouer un rôle actif dans la propagation de l’espèce.
Didemnum vexillum a aussi été trouvé sur des casiers de pêche sur lesquels il pouvait occulter la quasi-totalité du grillage qu’il utilise comme support de croissance. Ces objets « contaminés » sont rarement nettoyés avant d’être déplacés.
L'hypothèse conchylicole
En 1969 en Europe et en particulier en France, l'huître portugaise (Crassostrea angulata), massivement cultivée sur la façade atlantique a été presque éradiquée par une iridovirose. Pour continuer son activité l'industrie des huîtres a importé du Japon une grande quantité d'individus/naissains d'une autre espèce (l'huître du Pacifique ; Crassostrea gigas). Quelques efforts ont été faits pour tuer d'éventuels parasites ou organismes inopportuns éventuellement fixés sur ou dans ces huîtres importées (immersion des huîtres importées une heure en eau douce puis une heure en eau salée).
Mais peu après (début des années 1970) une nouvelle ascidie brune du genre Didemnum était détectée sur les parcs à huîtres des régions d'introduction des naissains japonais.
À la même époque, des naissains d'huître du Japon étaient également volontairement introduits face à la côte Pacifique du Canada et des États-Unis et là aussi : peu de temps après une nouvelle ascidie été signalée (qui sera bien plus tard identifiée comme étant D. vexillum[7]. À partir de ce moment, l'espèce semble commencer à devenir invasive sur de nombreux littoraux et fonds marins, jusqu'en Nouvelle-Zélande où elle est signalée une première fois en 2001 (seul cas alors connu pour tout l'hémisphère sud)[21].
Le dernier grand tsunami ayant touché le Japon pourrait encore contribuer à accélérer son expansion (des débris flottants ont été retrouvés les années suivantes jusqu'aux États-Unis).
Cout écologique, social et économique des invasions biologiques par D vexillum
Le « tapis colonial » peut rapidement recouvrir des substrats durs, mais aussi des organismes vivants benthiques fixés, certains crustacés ou plantes, etc. En particulier ce tapis peut asphyxier d’autres tuniciers, des éponges, des macroalgues, des hydrozoaires, des anémones, des bryozoaires ou encore des mollusques bivalves consommés par l'Homme tels que pétoncles, moules, huîtres, etc. avec alors des effets très négatifs pour les installations de mariculture, portuaires etc. et pour les réseaux trophiques marins concernés[4].
L'invasion d'un site de production moulière par ce tunicier peut faire chuter la production de 70 %[22].
Aux Pays-Bas, D. vexillum couvre jusqu'à 95 % des fonds marins de l'estuaire de l'Escaut, avec une forte diminution des oursins Psammechinus miliaris et de l'ophiure fragile (Ophiothrix fragilis)[23].
Moyens de lutte contre les pullulations
Ils font encore l'objet de tests et de travaux de recherche[24] - [25]. Momentanément un objet peut être isolé dans un sac plastique fermé à l'abri de la lumière, pour provoquer une anoxie mortelle à terme pour les didemnes (mais aussi pour la plupart des formes de vies "supérieures") ; il peut aussi dans les mêmes conditions être exposé à du chlore ou simplement à de l'eau douce, cependant une réinfestation reste possible ou probable et ce procédé ne peut être appliqué à de très grands objets.
Ils consisteraient principalement à limiter les transferts de propagules d’une région à l’autre, dont par les coques et eaux de ballasts et via le transport de matériel aquacole[26] (les tuniciers pouvant aussi profiter des résidus de nourriture non consommés par les poissons).
Références
- Gittenberger, Arjan, « Didemnum vexillum Kott, 2002 », World Register of Marine Species, (consulté le )
- Tagliapietra, D., Keppel, E., Sigovini, M., & Lambert, G. (2012). First record of the colonial ascidian Didemnum vexillum Kott, 2002 in the Mediterranean: Lagoon of Venice (Italy). BioInvasions Records, 1(4), 247-254.
- Invasive Species Alert : Colonial Sea squirt, PDF, 2 pages
- Characteristics, Alaska Department of Fish and Game, consulté 2016 02 11
- Kott P (2002) A complex didemnid ascidian from Whangamata, New Zealand. Journal of the Marine Biological Association of the UK, 82: 625–628, https://dx.doi.org/10.1017/S002530 15402005970
- Lambert G (2009) Adventures of a sea squirt sleuth: unraveling the identity of Didemnum vexillum, a global ascidian invader. Aquatic Invasions4: 5–28, https://dx.doi.org/10.3391/ai.2009. 4.1.2
- Lambert & Gretchen (2009) "Adventures of a sea squirt sleuth: unraveling the identity of Didemnum vexillum, a global ascidian invader". Aquatic Invasions 4 (1): 5–28. doi:10.3391/ai.2009.4.1.2 .
- Invasive Species — Didemnum Tunicate (Didemnum vexillum) ; Impacts, Alaska Department of Fish and Game, consulté 2016 02 11
- Invasive profiles ; Didemnum characteristics, ADFG, consulté 2016-02-11
- Fletcher, L. M., Forrest, B. M., & Bell, J. J. (2013). Natural dispersal mechanisms and dispersal potential of the invasive ascidian Didemnum vexillum. Biological invasions, 15(3), 627-643 (résumé)
- Distribution de D vexillum, Alaska Department of Fish and Game, consulté 2016 02 11
- Griffith K, Mowat S, Holt RHF, Ramsay K, Bishop JDD, Lambert G, Jenkins SR (2009) First records in Great Britain of the invasive colonial ascidian Didemnum vexillum Kott, 2002. Aquatic Invasions 4: 581–590, https://dx.doi.org/10. 3391/ai.2009.4.4.3
- Réponses (au caractère invasif de l'espèce), Alaska Department of Fish and Game, consulté 11 février 2016
- Carman MR, Grunden DW (2010) First occurrence of the invasive tunicate Didemnum vexillumin eelgrass habitat. Aquatic Invasions 5(1): 23–29, https://dx.doi.org/10.3391/ai. 2010.5.1.4
- GB Non-native species secretariat (2011-04-07). "Carpet sea squirt, Didemnum vexillum". Consulté 2015-01-21.
- Gröner F, Lenz M, Wahl M, Jenkins SR (2011) Stress resistance in two colonial ascidians from the Irish Sea: The recent invader Didemnum vexillumis more tolerant to low salinity than the cosmopolitan Diplosoma listerianum. Journal of Experimental MarineBiology and Ecology409: 48–52, https://dx.doi.org/10.1016/j.jembe.2011.08.002 (résumé)
- Herborg, L. M., O’Hara, P., & Therriault, T. W. (2009). Forecasting the potential distribution of the invasive tunicate Didemnum vexillum. Journal of Applied Ecology, 46(1), 64-72.
- Carman, M. R., & Grunden, D. W. (2010). First occurrence of the invasive tunicate Didemnum vexillum in eelgrass habitat. Aquatic Invasions, 5(1), 23-29
- Cohen, C. S., McCann, L., Davis, T., Shaw, L., & Ruiz, G. (2011). Discovery and significance of the colonial tunicate Didemnum vexillum in Alaska. Aquatic Invasions, 6(3), 263-271
- ICES WGITMO REPORT 2010
- Andrea Toran (2014-11-14). "Species Didemnum vexillum colonial tunicate; ascidian; sea squirt" . Marine nuisance species. USGS. Retrieved 2015-01-21.
- Carpet Sea Squirt ; YouTube; Great Britain Non-Native Species Secretariat, GBNNSS's channel ; mis en ligne le 29 mars 2010
- Bishop, John (2012-01-06). "GB non-natives factsheet editor". Consulté 2015-01-23
- McCann, L. D., Holzer, K. K., Davidson, I. C., Ashton, G. V., Chapman, M. D., & Ruiz, G. M. (2013). Promoting invasive species control and eradication in the sea: options for managing the tunicate invader Didemnum vexillum in Sitka, Alaska. Marine pollution bulletin, 77(1), 165-171.
- Forrest, B. M., & Hopkins, G. A. (2013). Population control to mitigate the spread of marine pests: insights from management of the Asian kelp Undaria pinnatifida and colonial ascidian Didemnum vexillum. Management of Biological Invasions, 4(4), 317-326.
- Denny, C. M. (2008). Development of a method to reduce the spread of the ascidian Didemnum vexillum with aquaculture transfers. ICES Journal of Marine Science: Journal du Conseil, 65(5), 805-810
Voir aussi
Articles connexes
Liens externes
- (en) Référence Catalogue of Life : Didemnum vexillum Kott, 2002
- (en) Référence World Register of Marine Species : espèce Didemnum vexillum Kott, 2002
- (fr) Référence DORIS : espèce Didemnum vexillum Kott, 2002
- (fr) Référence INPN : Didemnum vexillum Kott, 2002 (TAXREF)
Bibliographie
- Bullard, S. G., Lambert, G., Carman, M. R., Byrnes, J., Whitlatch, R. B., Ruiz, G., ... & Pederson, J. (2007). The colonial ascidian Didemnum sp. A: current distribution, basic biology and potential threat to marine communities of the northeast and west coasts of North America. Journal of Experimental Marine Biology and Ecology, 342(1), 99-108.
- Coutts, A.D.M. & Sinner, J. (2004) An updated benefit-cost analysis of management options for Didemnum vexillum in Queen Charlotte Sound (New Zealand), Cawthrone Report No. 295. Prepared for Marlborough District Council, Marlborough, New Zealand.
- Coutts, A.D.M. & Forrest, B.M. (2007) Development and application of tools for incursion response: lessons learned from the management of the fouling pest Didemnum vexillum. Journal of Experimental Marine Biology and Ecology, 342, 154–162.
- Lengyel, N. L., Collie, J. S., & Valentine, P. C. (2009). The invasive colonial ascidian Didemnum vexillum on Georges Bank—ecological effects and genetic identification. Aquatic Invasions, 4(1), 143-152.
- McCann, L. D., Holzer, K. K., Davidson, I. C., Ashton, G. V., Chapman, M. D., & Ruiz, G. M. (2013). Promoting invasive species control and eradication in the sea: options for managing the tunicate invader Didemnum vexillum in Sitka, Alaska. Marine pollution bulletin, 77(1), 165-171.
- Stefaniak, L., Lambert, G., Gittenberger, A., Zhang, H., Senjie Lin, S. & Whitlatch, R. (2008) Genetic conspecificity of the worldwide populations of Didemnum vexillum Kott, 2002. Aquatic Invasions, in press.
- Cohen, C. S., McCann, L., Davis, T., Shaw, L., & Ruiz, G. (2011). Discovery and significance of the colonial tunicate Didemnum vexillum in Alaska. Aquatic Invasions, 6(3), 263-271.