Diacétone alcool
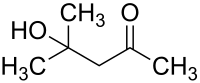
Le diacétone alcool (DAA) ou 4-hydroxy-4-méthylpentan-2-one est un composé organique de la famille des hydroxycétones, de formule C6H12O2. C'est un intermédiaire courant en synthèse organique, et il est aussi utilisé comme solvant[8], notamment pour les peroxydes organiques.
| Diacétone alcool | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | 4-hydroxy-4-méthylpentan-2-one | |
| Synonymes |
4-hydroxy-4-méthyl-2-pentanone, diacétonalcool |
|
| No CAS | ||
| No ECHA | 100.004.207 | |
| No CE | 204-626-7 | |
| No RTECS | SA9100000 | |
| PubChem | 31256 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide inncolore à l'odeur sucrée[1] | |
| Propriétés chimiques | ||
| Formule | C6H12O2 [Isomères] |
|
| Masse molaire[2] | 116,158 3 ± 0,006 2 g/mol C 62,04 %, H 10,41 %, O 27,55 %, |
|
| Propriétés physiques | ||
| T° fusion | −47 °C[1] | |
| T° ébullition | 166 °C[1] | |
| Solubilité | mélangeable à l'eau[1] | |
| Masse volumique | 0,93 g·cm-3 (20 °C)[1] | |
| Densité de vapeur | 4[1] | |
| Densité de vapeur du mélange vapeur-air | 1[1] | |
| T° d'auto-inflammation | 515 °C (classe T1)[1] | |
| Point d’éclair | 55 °C (coupelle fermée)[1] | |
| Limites d’explosivité dans l’air | 1,28 vol.% (62 g·m-3) – 6,9 vol.% (339 g·m-3[1] | |
| Pression de vapeur saturante | 1,32 hPa (20 °C 2,86 hPa (30 °C) 5,31 hPa (40 °C 9,49 hPa (50 °C[1] |
|
| Précautions | ||
| SGH[1] | ||
   Attention |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 2 520 mg·kg-1 (rat, oral)[3] 13 500 mg·kg-1 (lapin, dermique)[4] 933 mg·kg-1 (souris, i.p.)[5] 3 950 mg·kg-1 (souris, oral)[6] |
|
| LogP | -0,340[7] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés
Pur, le diacétone alcool se présente sous la forme d'un liquide incolore avec une légère odeur sucrée. C'est un liquide inflammable dont les vapeurs peuvent former avec l'air un mélange explosif au-dessus de son point d'éclair (56 °C). Il est mélangeable à l'eau et très peu volatil.
Il tend à se décomposer au-dessus de 90 °C, notamment en alcool de mésityle, acétone et eau. Il réagit dangereusement avec les bases, les métaux alcalins, les amines, les oxydants forts et les acides[1].
Synthèse
Le DAA est produit à partir aldolisation de deux molécules d'acétone en milieu basique.
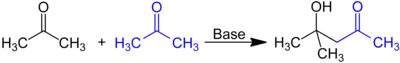
Dans l'industrie, on utilise généralement l'hydroxyde de baryum comme catalyseur. En laboratoire, on utilise souvent un extracteur de Soxhlet avec de l'hydroxyde de calcium[9].
Réactions
Le DAA est assez facilement déshydraté en oxyde de mésityle, une cétone α,β-insaturée.
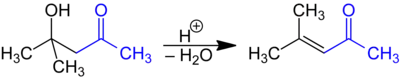
Ce dernier peut à son tour être hydrogéné en méthylisobutylcétone (MIBK), un solvant organique courant.
Hydrogéné, le DAA donne le 2-méthylpentane-2,4-diol (MPD ou hexylène glycol). Condensé avec l'urée, il donne la diacétone-urée.
Utilisations
Le diacétone alcool est utilisé dans les laques à base esters de cellulose[8] en particulier pour les usages en brossage où il produit un film dur avec un aspect billant et où son absence d'odeur présente un avantage. Il est utilisé dans les diluants pour laques (en), les patines, les lasures, les produits de préservation du bois et les pâtes d'impression ; dans les compositions de revêtement pour papier et textiles ; les marqueurs permanents[10], la fabrication de cuirs et soies synthétiques ; dans les imitations de feuilles d'or ; les ciments celluloïd ; comme agent de conservation des tissus animaux ; dans les composés de nettoyage des métaux ; dans la fabrication de films photo. Il est enfin utilisé dans certains liquides de frein où il est généralement mélangé à volume égal d'huile de ricin.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Diacetone alcohol » (voir la liste des auteurs) et en allemand « Diacetonalkohol » (voir la liste des auteurs).
- Entrée « 4-Hydroxy-4-methylpentan-2-one » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 août 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- National Technical Information Service. Vol. OTS0557732
- Raw Material Data Handbook, Vol.1: Organic Solvents, 1974. Vol. 1, Pg. 21, 1974.
- Shell Chemical Company. Unpublished Report. Vol. -, Pg. 3, 1961.
- Journal of the American Pharmaceutical Association, Scientific Edition. Vol. 45, Pg. 669, 1956.
- Fiche (en) « Diacétone alcool », sur ChemIDplus, consulté le 22 août 2020
- Stylianos Sifniades et Alan B. Levy, Ullmann's Encyclopedia of Industrial Chemistry, (ISBN 3527306730, DOI 10.1002/14356007.a01_079), « Acetone »
- Alfred Hoffman, « The condensation of acetone by means of calcium oxide », J. Am. Chem. Soc., vol. 31, no 6, , p. 722 (DOI 10.1021/ja01936a015)
- MSDS: Sharpie Chisel Tip Permanent Marker - "Household products database" US Department of Health and Human Services
