Développement de l'œil des vertébrés
Le développement de l'œil des vertébrés est la genèse et la formation structurelles et fonctionnelles de leurs organes de la vision. L'étude de ces processus est une partie de la biologie du développement. L'œil des vertébrés présente des différences très notables dans sa construction et ses performances, dépendantes de l'espèce, tandis que les phases de sa genèse présentent des similitudes fondamentales. Vu son processus de développement, l'œil des vertébrés est un exemple modèle pour un organe formé par un enchaînement de déclenchements contrôlés génétiquement. Ces inductions y sont tellement étroitement liées que les diverses composantes de l'œil — comme par exemple le cristallin, la cornée et la rétine — se tiennent en relation rigoureusement ordonnée et réciproque en fonction des étapes du développement, et apparaissent ainsi comme un système global. Les critiques de l'évolution ont longtemps supposé que ces parties n'auraient pu apparaître qu'indépendamment les unes des autres, et par suite ne pourraient se développer qu'indépendamment dans l'ontogénèse. Les découvertes sur le développement de l'œil ont montré que cette façon de voir est maintenant dépassée.
L'œil du vertébré est une partie du cerveau, dont il pousse comme vésicule optique (en). Dans le domaine de la tête, il y a alors une série d'interactions entre tissus, qui provoquent la formation du cristallin à partir de la surface, et qui définissent sa forme. Le développement de la rétine en de nombreuses couches de cellules photosensibles à la lumière et à la couleur, et les cellules nerveuses associées, ainsi que leur connexion avec les autres parties du cerveau est le processus le plus complexe du développement de l'œil. Il faut aboutir à un arrangement inversé des photorécepteurs, tournés dos à la lumière incidente. Les prolongements des cellules nerveuses se fraient, en un processus auto-organisé gouverné par des signaux chimiques, leur chemin jusqu'au cerveau, les axones passant en partie vers l'autre côté. La formation d'organes auxiliaires comme les muscles oculaires, les paupières et l'appareil lacrymal sont des processus secondaires qui complètent la formation de l'œil. Ce n'est que longtemps après la naissance que cette formation est terminée par la coordination des mouvements oculaires, en particulier chez les animaux à vision binoculaire, ainsi que l'optimisation de la netteté de vue.
L'évolution de l'œil des vertébrés
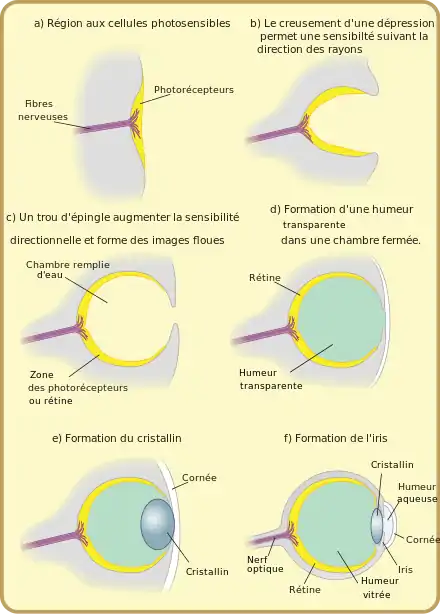
Comme l'anatomie de l'œil fossile n'a pas été transmise en détail, et qu'en outre les étapes fossiles des premiers vertébrés et de leurs ancêtres immédiats sont en fait inconnues, les énoncés suivants sur l'évolution de l'œil des vertébrés se fondent sur :
- des études d'anatomie comparée de la structure de l'œil (même sur le plan moléculaire) des grands groupes de vertébrés actuels,
- des études sur la génétique moléculaire des rapports de parenté de ces groupes de vertébrés,
- des études comparées du développement embryonnaire dans les divers groupes de vertébrés actuels.
L'évolution de l'œil des vertébrés peut être grossièrement divisée en six phases (Fig. 1)[1]. Dans ce schéma, des animaux bilatériens auraient développé il y a au moins 600 millions d'années (a) des photorécepteurs rhabdomériques (en forme de brosse), munis de cils, avec des formes anciennes du pigment photosensible, la protéine opsine. Dans ces pigments visuels sont intégrés des colorants sensibles à la lumière (chromophores), qui sont décisifs pour la sensibilité à la lumière (phototaxie) des animaux. Les récepteurs peuvent alors avoir été regroupés sur des ocelles, ou distribués sur tout le corps.
Dans une deuxième phase, il y a 580 à 550 millions d'années (protérozoïque tardif), les ancêtres immédiats des premiers vertébrés avaient développé des photorécepteurs ciliaires perfectionnés, avec la protéine opsine correspondante. Ceux-ci étaient sans doute très proches des photorécepteurs des plus étroits parents des vertébrés, les branchiostomatidae et à ceux des larves des tuniciers qui y ressemblent.
Dans la phase trois (b), il y a 550-530 millions d'années (Cambrien ancien), il y avait déjà un type de photorécepteur avec membrane externe et une sortie pour un transfert échelonné du signal vers la synapse. Le tissu du nœud nerveux dans la région de la tête (« cerveau ») formait des deux côtés des excroissances garnies de photorécepteurs (vésicule optique, ampoule oculaire). Ces ampoules ont alors commencé à se creuser en coupe, la partie interne de la coupe représentant la forme la plus ancienne de la rétine. Avec ce creusement de la vésicule se formait une superposition d'une forme ancienne d'épithélium pigmentaire de la rétine sur cette proto-rétine. Ensuite (c) est arrivée la « placode cristalline », homologue de la disposition cristalline embryonnaire de même nom chez les vertébrés supérieurs. La placode cristalline ne faisait tout d'abord qu'empêcher la pigmentation de la peau externe située au-dessus de la vésicule optique, si bien que la peau à ces endroits restait transparente (d). Cet œil primitif, il y a environ 530 millions d'années, encore privé des propriétés de formation des images sur la rétine, peut être comparée à celle des myxines, les vertébrés actuels les plus primitifs.
Dans la phase suivante, la quatrième, il y a quelque 530-500 millions d'années (Cambrien moyen), ont évolué cinq différentes cellules nouvelles dans les photorécepteurs, les cônes, chacun avec sa propre opsine ciliaire, ainsi que les cellules bipolaires et de nouvelles cellules ganglionnaires rétiniennes (cellule ganglionnaire rétinienne biplexiforme), condition pour une transmission plus fidèle du signal au nerf optique. Les cellules bipolaires et les cellules ganglionnaires sont organisées ici en une structure à trois couches au sein de la rétine. Par la rétractation de la placode cristalline dans la coupe oculaire, puis sa ligature se structure le cristallin (e). Ce n'est que plus tard qu'arriveront l'accommodation et l'iris (et donc la possibilité de modifier jusqu'à un certain point l'ouverture de la pupille), ainsi que les muscles oculaires externes pour faire remuer les yeux, avec leurs connexions nerveuses. À cette époque, il y a quelque 500 millions d'années, il existait ainsi déjà un œil qui était comparable dans ses grandes lignes à ceux de presque tous les vertébrés modernes. Il avait la construction d'une caméra simple, pouvait donc voir des images, et ressemblait le plus à celui de la lamproie marine moderne.
Dans la phase cinq, il y a 500-430 millions d'années, (Cambrien tardif jusqu'au Silurien tardif), la myéline, qui accélère la transmission des signaux dans l'ensemble du système nerveux, a évolué. Là-dessus arrive un nouveau type de photorécepteurs, les bâtonnets, qui permettent la vision en lumière faible. Avec ceux-ci apparaît pour les vertébrés un nouveau pigment visuel caractéristique, la rhodopsine. L'iris devient hautement contractile et peut alors ajuster le diamètre de la pupille aux conditions d'éclairage de façon optimale (adaptation visuelle). À l'intérieur du globe oculaire se font des muscles pour le cristallin, qui permettent une meilleure accommodation (f). Cet œil déjà relativement hautement évolué caractérisait probablement les poissons sans mâchoire à carapace aujourd'hui éteints, les ostracodermes, et sans doute était-il même très voisin de l'œil que l'on trouve chez de nombreux poissons modernes, ainsi que chez les gnathostomes.
Au cours de la sixième et dernière phase, commencée il y a quelque 430 millions d'années, la version de base de l'œil des tétrapodes est élaborée. Dans la foulée des nombreuses adaptations de l'organisme vertébré du genre poisson, à une vie hors de l'eau, qui a eu lieu environ il y a 375 millions d'années (dévonien tardif), le cristallin a pris une section de forme elliptique. Ceci a été rendu nécessaire parce que la lumière, en passant de l'air dans la cornée est plus réfractée qu'au passage de l'eau à la cornée. L'émergence de la paupière a permis la protection de l’œil contre le dessèchement à l'air[1].
En résumé, on peut dire qu'il a fallu à l'œil des gnathostomes 200 millions d'années pour passer des formes archaïques ne faisant que distinguer la clarté de l'obscurité à l'œil moderne à cristallin, voyant des images en couleurs à haute résolution. Tous les caractères fondamentaux, qui distinguent aussi l'œil de l'homme, ont pu être présents 50 millions d'années plus tard, à la fin du dévonien. Plus de 200 millions d'années plus tard, une série d'organismes endothermes, ainsi capables d'une vie nocturne active, ont réduit le nombre de leurs photorécepteurs inutiles dans ces conditions, et ont adapté leur rétine encore autrement à la vision nocturne. À côté de cela se sont développés dans d'autres lignées de gnathostomes des spécialisations de l'œil avec des modifications appropriées du type de base.
L'œil, exemple modèle de processus à déclenchements enchaînés
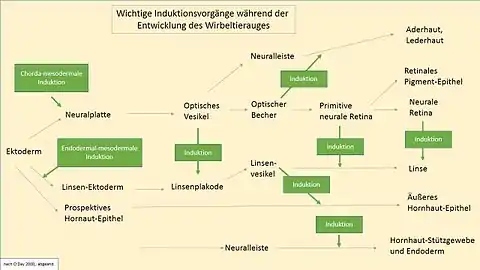
Pour que les processus génotypiques et phénotypiques du développement de l'œil se mettent en route et se déroulent dans la succession convenable, Il faut toute une cascade d'interactions entre tissus sous forme de déclencheurs successifs et entrelacés (chaîne d'inductions)[2] (Figs. 2 et 12). Trois segments spécifiques de l'ADN se trouvent au début de la chaîne. Ils contiennent chacun un type de gène important pour l'ensemble de la suite du déroulement du développement de l'œil, que l'on désigne par gène de changement, gène maître, gène maître de contrôle ou facteur de transcription. Ici, ce sont les gènes Rx1 (homéobox rétinienne), Six3 (Gène sine oculis), et avant tout — mesuré par l'abondante apparition dans la littérature spécialisée — le gène Pax6 (gène paired box 6) découvert en 1995 par Walter Gehring[3].
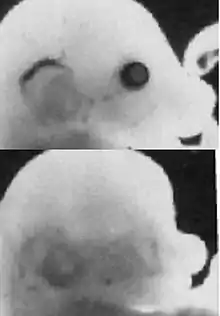
Par la suite, l'induction de la placode cristalline, et donc l'initiation du cristallin est déclenchée par deux facteurs principaux, premièrement l'expression de Pax6 dans l'épiderme de la tête, et deuxièmement la présence du tissu ectodermique spécifique. Les étapes du développement précoce du cristallin liées à Pax6 et à d'autres gènes sont profondément ancrées dans l'histoire de l'évolution et remarquablement similaires à travers les espèces. Pax6 lui-même est absolument identique chez la souris et chez l'homme. Les gènes cités, Pax6, Rx1 et Six3 sont un cercle nécessaire et suffisant pour l'induction de l'œil chez le vertébré. En utilisant du Pax6 de souris, une expérience a pu induire des yeux (ectopiques) sur les jambes de mouches drosophiles[4]. Cette expérience spectaculaire, avec laquelle la fonction du gène eyeless de la mouche homologue de Pax6 a été complètement remplie a démontré le haut niveau de conservation de Pax6. Une expérience semblable a réussi au moins en partie chez des vertébrés[5], notamment chez le poussin (1995)[6] ou au moyen de Sox3 chez le Xenopus laevis (2000)[7]. Dans ces expériences on a provoqué la formation de cristallins ou de placodes ectopiques. Le fait que ces essais n'ont pas conduit à des résultats aussi complets que chez les drosophiles fait conclure à la plus haute complexité des vertébrés. En tout cas, le développement de l'œil est complètement supprimé quand Pax6 est réprimé (Fig. 3).
Les gènes de contrôle maîtres nommés forment un réseau génétique stabilisant qui déclenche de nouvelles inductions[8], et active des centaines d'autres gènes. Pour l'œil de la drosophile, ce sont 2000 gènes. Rien que la pigmentation de l'iris humain, c'est-à-dire la couleur de l'œil, demande au moins 16 gènes différents[9]. D'autres inductions s'ensuivent au cours de la suite du développement de l'œil. Elles conduisent chaque fois à d'importantes étapes de développement, en faisant intervenir de nombreux gènes activés, comme l'origine du cristallin et de la cornée (Fig. 2).
Le rôle du gène Pax6
20 ans après sa découverte et sa position tout à fait spéciale comme « le » gène de contrôle maître, cette opinion peut être revue sous un nouvel angle.
Pour la spécificité de Pax6 comme gène maître, on peut citer le fait qu'il est d'une part exprimé tôt, dès les cellules de la souche oculaire, puis dans de nombreux tissus pendant l'ensemble du développement de l'œil, et cela chez la drosophile, l'homme et la pieuvre. On suppose que le développement de l'œil chez des espèces de différents embranchements est indépendant. Pax6 peut donc être considéré comme conservé à partir d'un ancêtre commun. En second lieu, la réduction de son expression conduit à une diminution de la taille de l'œil chez la drosophile, la souris et l'homme. Troisièmement, une expression erronée de Pax6 dans certains tissus, par exemple dans l'aile ou la patte de drosophile, peut provoquer des yeux ectopiques.
Contre une position de maître éminente, ou même seule, de Pax6 dans le développement de l'œil, on peut citer les faits suivants : premièrement, l'élimination de Pax6, ou du gène homologue Eyeless chez la drosophile, qui fait aussi partie de la famille de Pax6, et a une fonction comparable chez la mouche, ne conduit pas seulement à la perte de l'œil, mais aussi à celle d'autres parties du cerveau, et dans des cas extrêmes, chez la drosophile, à la perte totale de la tête[9]. Deuxièmement, d'autres gènes outre Pax6 prennent des rôles clés dans la développement précoce de l'œil, comme par exemple, outre les Rx1 et Sine oculis (Six)[10], aussi Eyes absent (Eya)[11] ou Dachshund (Dach)[12]. Ces gènes peuvent aussi induire des yeux ectopiques. La perte de leur fonction entraîne aussi la perte de l'œil. Ils montrent ainsi des propriétés de gènes de contrôle maîtres semblables à celles de Pax6.
En résumé, à présent, les caractéristiques de Pax6 dépassant les embranchements ne sont pas remises en question. Mais en comparaison avec la puissance d'autres gènes maîtres, elles sont relativisées. Selon l'état actuel de la science, il faut parler de la conservation dans l'évolution du réseau de régulation génétique de tout un groupe de gènes[3].
Phases du développement de l'œil
Introduction précoce du développement d'un champ oculaire
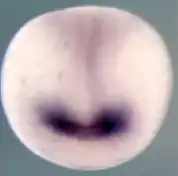
L'œil à cristallin des vertébrés peut être considéré comme un organe sensoriel poussant à partir du cerveau. Dès la fin de la gastrulation, les premiers aiguillages pour le développement de l'œil sont posés. C'est le cas encore dans une phase précoce du développement embryonnaire, quand la formation des trois feuillets germinaux, endoderme, mésoderme et ectoderme arrive à sa fin. Dans l'œil comme dans les autres organes des sens, l'ectoderme est le feuillet essentiel dont se développent les structures. Chez l'homme, ces premières étapes ont lieu à partir du 17e jour de grossesse.
Le développement de la plaque neurale en forme de semelle sur la gastrula (Fig. 4, surface gris clair), dont provient tout d'abord le tube neural (Fig. 4, bande médiane verticale), puis plus tard le cerveau et la moelle épinière, est déclenché par le mésoderme situé en dessous (induction), et il se forme ensuite un champ oculaire sur cette plaque (Fig. 4, violet). Les gènes cités, Rx1, Six3 et Pax6 sont essentiels pour ces étapes initiales. Pendant la formation du tube neural, le champ oculaire se partage en deux domaines oculaires externes, sous la direction du gène Sonic hedgehog (Shh), qui est activé sur une ligne médiane entre ces deux domaines, et y réprime Pax6. Sonic hedgehog donne ainsi l'explication du fait que les vertébrés ont deux yeux. S'il ne s'exprime pas à ce moment, se développe une cyclopie[13]. L'activation (expression) manquante des gènes cités conduit à l'absence de formation des yeux[8].
Vésicule optique et placode cristalline
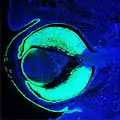 Fig. 5 : Œil de souris, 14,5 jours après la fécondation (E14,5) avec l'expression de Pax6 (vert). Correspond en gros à la phase 3 dans la Fig. 8
Fig. 5 : Œil de souris, 14,5 jours après la fécondation (E14,5) avec l'expression de Pax6 (vert). Correspond en gros à la phase 3 dans la Fig. 8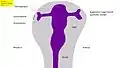 Fig. 6 : Développement de l'œil des vertébrés – Phase 1 : bourgeonnement du cerveau, et formation de la vésicule optique (Homme : 4e semaine)
Fig. 6 : Développement de l'œil des vertébrés – Phase 1 : bourgeonnement du cerveau, et formation de la vésicule optique (Homme : 4e semaine)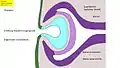 Fig. 7 : Phase 2 : invagination de l'ectoderme, formation de la coupe optique, de la placode cristalline, et des couches de la rétine (Homme : 5e semaine)
Fig. 7 : Phase 2 : invagination de l'ectoderme, formation de la coupe optique, de la placode cristalline, et des couches de la rétine (Homme : 5e semaine)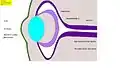 Fig. 8 : Phase 3 : Formation du cristallin, du corps de l'œil et de la cornée. (Homme, séparation du corps du cristallin, 6e semaine)
Fig. 8 : Phase 3 : Formation du cristallin, du corps de l'œil et de la cornée. (Homme, séparation du corps du cristallin, 6e semaine) Fig. 8.1 : Coupe au microscope : vésicule cérébrale et coupe oculaire, disposition du cristallin. Poulet (coloration hématoxyline-éosine)
Fig. 8.1 : Coupe au microscope : vésicule cérébrale et coupe oculaire, disposition du cristallin. Poulet (coloration hématoxyline-éosine)
Par la suite, il arrive chez l'homme environ au début du 2e mois de grossesse sur les champs oculaires une excroissance bilatérale de l'ectoderme avant, et sa croissance comme vésicule optique à partir du diencéphale (Fig. 6)[8], nommée tige optique. Ainsi, les informations arrivant sur la lumière pénètrent d'abord le diencéphale, leur traitement ayant lieu dans le télencéphale.
L'excroissance des vésicules optiques repose sur une migration cellulaire individuelle. Comme il a été découvert d'abord sur le poisson, la protéine Rx3 donne un cheminement moléculaire pour les cellules précurseurs des yeux. Elle communique à ces cellules l'information sur la manière de se diriger à partir du milieu du cerveau vers le champ oculaire, où il se produit de grandes accumulations de ces cellules[14] - [15]. La vésicule optique croissante interagit avec la couche externe et y déclenche comme nouvelle étape importante d'induction la formation de la placode cristalline, un épaississement de cet ectoderme et l'invagination de la fosse oculaire (Figs. 5 et 6). Sans vésicule, il ne se formerait aucun épaississement et aucun cristallin (à l'exception des amphibiens). Par divers signaux du mésoderme et de la vésicule optique, l'ectoderme de surface est de mieux en mieux préparé à la formation prospective du cristallin. Le tissu est d'abord marqué comme « compétent » pour la formation du cristallin, puis dans les étapes suivantes « spécifique du cristallin[16]. » Après le contact avec la vésicule et ses signaux, le tissu ne peut plus devenir que du cristallin. Seule la peau de la tête (épiderme) est ainsi en position de réagir aux signaux de la vésicule optique. Dans des expériences, on a pu montrer qu'une vésicule que l'on greffe dans une autre région que l'ectoderme de la tête, et qu'on laisse pousser, ne conduit pas à la formation d'un cristallin. Mais également, de l'épiderme de la tête greffé ne conduit à aucun cristallin s'il lui manque le contact avec une vésicule optique.
L'épaississement de l'ectoderme conduit à la déformation de la vésicule en coupe, la « coupe oculaire » (Fig. 7). Celle-ci fait que, par des signaux d'induction convenables, le cristallin, encore non transparent, se forme[2]. Après sa formation initiale, l'ectoderme superficiel se referme au-dessus de la vésicule. La petite boule de cristallin se détache de l'ectoderme, et s'enfonce (Fig. 8).
Cristallin et cornée
Le cristallin précoce, qui provient de la petite boule issue de la placode cristalline, est tout d'abord une boule creuse de cellules entourantes (Fig. 9.1). Chacune de ces cellules contient un noyau et de l'ADN. Le côté antérieur est dirigé vers l'extérieur de l'œil, le postérieur vers l'intérieur (Fig. 9.2). Les cellules sont entourées par une capsule contenant des matériaux protéiniques (montré seulement sur les Figs. 9.1 et 9.6). Dans une première étape, à partir de la 5e semaine chez l'homme, les cellules postérieures s'allongent dans le creux (Fig. 9.2, gris-bleu). Elles forment les « fibres primaires du cristallin », qui deviendra le « noyau cristallin ». Le dépôt de couches autour du noyau central arrive toujours à partir de l'« équateur du cristallin » (Fig. 9.4)[17]. En se rallongeant, ces fibres forment de nombreuses protéines, les protéines cristallines. Celles-ci remplissent le creux du cristallin et forment ses composantes principales, avec trois types et une proportion de 90 % de toutes les protéines du cristallin[18]. Tout d'abord, les fibres du cristallin se construisent. Ensuite, les cellules des fibres du cristallin suppriment leur noyau et autres organelles, notamment les centres énergétiques (mitochondries) (Fig. 9.3, bleu). Ceci réduit drastiquement les échanges de matière de la cellule, ainsi que la diffusion de la lumière. Ce processus ne conduit pas, comme ailleurs, à la mort programmée des cellules (apoptose). À cause de ces processus, les cellules ne peuvent plus se renouveler jusqu'à la mort, et c'est nécessaire.
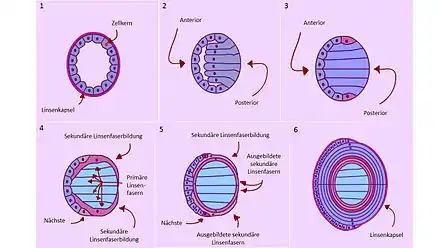
Les cellules antérieures restent comme une couche de cellules à une seule épaisseur sur la surface externe du cristallin (épithélium cristallin), et restent sur le cristallin complètement développé. Elles continuent à se diviser constamment, si bien qu'à leur extrémité inférieure, chez l'homme, à partir de la 7e semaine, des fibres cristallines secondaires apparaissent (Fig. 9.3, rouge). Ces fibres cristallines deviennent très longues et recouvrent le cristallin en anneaux concentriques comme des pelures d'oignon en plusieurs couches[19]. En plus, de nouvelles fibres cristallines secondaires poussent constamment des positions indiquées vers le haut et vers le bas autour du cristallin (Fig. 9.4), elles repoussent vers l'intérieur les fibres cristallines secondaires formées avant elles, tandis que de nouvelles fibres cristallines secondaires sont toujours formées (Fig. 9.4, brun), et poussent de même autour du cristallin. La couche antérieure forme constamment par division des cellules des matériaux de provision pour ce processus. Par la formation continuelle de nouveaux anneaux, le cristallin peut pousser (Fig. 9.6)[20]. Pendant tout le temps du développement prénatal du cristallin, un réseau vasculaire de vaisseaux sanguins est étendu à l'arrière et sur les côtés, la tunica vasculosa lentis, qui ne disparaît que peu après la naissance.
La formation de nouvelles fibres cristallines secondaires continue au cours de la vie entière de l'organisme. Le cristallin n'en grossit plus beaucoup, mais prend de la densité. Le cristallin développé contient un noyau de cellules précoces (Fig. 9.6, bleu clair). Avec l'âge, le cristallin perd de son élasticité, et perd de plus en plus sa faculté d'accommodation. Le cristallin fini consiste d'un seul tissu organique de cellules vivantes et transparentes.
Chez la salamandre, le cristallin peut être régénéré. Ceci par transdifférenciation, un développement inverse par étapes de cellules sur le bord mésodermique de l'iris en un état précoce (régénération cristalline de Wolff). On peut ainsi régénérer le cristallin jusqu'à 18 fois[21]. Certains tissus de l'iris et de la rétine neuronale sont également régénérables chez la salamandre[22].
Le processuss suivant l'induction du cristallin est encore une induction, cette fois-ci du cristallin avec l'ectoderme superficiel. Elle y conduit à un nouvel épaississement, la cornée (Figs. 5 et 8)[2]. Contrairement aux cellules du cristallin, les cellules de la cornée ont une durée de vie extrêmement courte, et se renouvellent même après la naissance toutes les semaines. La cornée est fortement parcourue par des nerfs. Le bord antérieur de la coupe devient la pupille. La cornée (cornea) provient d'une transformation de l'ectoderme superficiel en épithélium antérieur. La choroïde et la sclérotique proviennent du mésenchyme mésodermique de la tête. La formation de la sclérotique permet l'apparition de vaisseaux sanguins qui parcourent la rétine.
Rétine
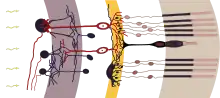
Avant que survienne la différenciation de la rétine, il y a un tissu d'un champ de cellules précurseurs indifférenciées de la rétine. De même que pour les phases précédentes d'induction de la vésicule ou du cristallin, il faut que des étapes ordonnées de différenciation soient établies. Toutes ces cellules précurseurs de la rétine expriment dans ce but une suite commune de facteurs de transcription, c'est-à-dire des gènes qui à leur tour expriment d'autres gènes. Ce sont Pax6, Six3, Six6, Lbx2 et Hes1. Les cellules sont à ce stade encore des cellules souches multipotentes, c'est-à-dire qu'elles peuvent encore se différencier en différentes cellules finales. Elles deviennent, outre les cellules de Müller partiellement conductrices de la lumière, avant tout les cellules des photorécepteurs ainsi que divers types de cellules nerveuses, qui se couplent entre elles comme les cellules horizontales, ou forment le signal, comme les cellules bipolaires, et le modulent comme les cellules amacrines, avant qu'il atteigne les cellules ganglionnaires de la rétine, dont les prolongements peuvent transporter les signaux hors de l'œil vers d'autres domaines du cerveau[23]. Les mécanismes qui garantissent ici une différenciation précise pour le développement de la rétine sont des activités de gènes aussi bien de la vésicule optique (« intrinsèques ») que par les régions mésenchymatiques hors de l'œil (« extrinsèques »). Ici, les facteurs de croissance des fibroblastes (FGF) jouent un rôle important[24]. Une onde d'expression se renforçant elle-même de Sonic hedgehog, qui balaie la couche des cellules ganglionnaires, cause la première la différenciation des cellules ganglionnaires[25]. Une autre onde de Shh, qui est exprimée en travers dans la couche interne, donne le coup d'envoi de la différenciation d'autres cellules neuronales de la rétine. Les deux découvertes ont été faites chez le poisson-zèbre[26].
La paroi de la coupe oculaire consiste maintenant d'un feuillet externe et d'un feuillet interne, dans lesquels se formeront plus tard d'autres couches rétiniennes (Fig. 7 simple, Fig. 10 couche interne plus détaillée). Le feuillet mince, dirigé vers l'extérieur (Fig. 8), forme l'épithélium pigmentaire rétinien (RPE), qui assombrit, absorbe la lumière et sert à la régénération des cellules sensorielles. La structure du feuillet interne plus épais sera décrite plus en détail ci-après. Cette « couche rétinienne neuronale » consiste en cellules nerveuses et est subdivisée en sous-couches interne et externe (Fig. 10). Au cours du développement, il se forme dans la couche neuronale une autre sous-couche médiane avec les cellules bipolaires de la rétine. Leur tâche est de rassembler les informations des photorécepteurs photosensibles (cônes et bâtonnets), de les pondérer et de les diriger vers les cellules ganglionnaires vers l'intérieur de la rétine (Fig. 10 g.). En résumé, il se développe ainsi dans la rétine de l'œil comme dans les autres organes des sens, par exemple l'oreille, pour l'essentiel trois couches de cellules ici superposées : cellules réceptrices, bipolaires et ganglionnaires, dont les neurones se projettent sur des régions du cerveau. Cet ordonnancement est valable pour l'homme comme pour d'autres vertébrés.
La formation des cônes et des bâtonnets a lieu sur le côté externe de la couche interne (Fig. 10 dr., noyaux cellulaires des photorécepteurs devant une couche blanche en arrière-plan, prolongements photosensibles devant une couche brune en arrière-plan). Les trois types différents de cônes chez l'homme servent à distinguer les couleurs de la lumière. Les bâtonnets ne transmettent que l'intensité comme intensité de clarté. Comme chez l'homme, il n'y a qu'un seul type de bâtonnets, il ne peut avoir aucune sensation de couleur par faible lumière. Les animaux nocturnes ont développé plusieurs types de bâtonnets.
La majeure partie du développement complexe de la rétine se déroule chez l'homme en une onde de croissance de cellules coordonnée à partir du milieu du 3e mois jusqu'au 4e. Puis, le nerf optique est complètement myélinisé pour conduction adéquate du signal. La tache jaune (macula lutea) avec la plus haute densité de cellules spéciales (cônes) ne commence à se développer qu'après 8 mois[27]. Elle continue à croître jusqu'après la naissance. Après environ 5 mois, la liaison nerveuse de l'œil avec le cerveau est terminée. L'embryon présente dès le 7e mois de grossesse certaines formes de mouvements de l'œil, appelées REM (Rapid Eye Movement), qui soutiennent la synchronisation de la rétine avec le cortex visuel dans le cerveau[28].
Position retournée (inverse) des photorécepteurs
L'œil des vertébrés est considéré comme une partie du cerveau, parce que sa première situation dérive de celui-ci. Ceci n'est pas le cas par exemple chez la pieuvre, qui n'appartient pas aux vertébrés, mais aux céphalopodes, chez laquelle l'œil a son origine dans une invagination de la surface externe. Le processus de développement chez le vertébré avec une rétine inversée a de nombreuses conséquences : tout d'abord, le nerf optique ramassé vers l'intérieur pour conduire vers le cerveau, forme une tache aveugle, car aucune cellule sensorielle photosensible ne se trouve à l'endroit où il sort de l'œil. Deuxièmement, les fibres nerveuses, les cellules nerveuses et les vaisseaux sanguins se trouvent sur le côté interne exposé à la lumière, si bien que la lumière doit les traverser avant d'atteindre les photorécepteurs. Troisièmement, les longs prolongements des photorécepteurs des cônes et bâtonnets sont dirigés vers l'extérieur vers l'épithélium — soit à l'opposé de la lumière[29] - [30]. La lumière doit donc traverser aussi bien les couches superposées, mais aussi les photorécepteurs eux-mêmes, avant d'atteindre leur extrémité externe photosensible (Fig. 10). Chez la pieuvre, l'itinéraire est plus simple : la lumière y atteint directement les récepteurs.
Pour des composantes de l'œil semblables et aussi bien arrangées, la structure inversée de la rétine des vertébrés indique une solution évolutionnaire « suboptimale » . La pieuvre pourrait sans doute mieux voir par faible lumière, car les signaux lumineux incidents rencontrent moins d'obstacles sur leur chemin. Selon la théorie de l'évolution, les solutions d'évolution n'ont pas besoin d'être parfaites, il faut seulement qu'elles soient assez bonnes pour que l'espèce soit suffisamment bien adaptée à ses conditions d'environnement pour pouvoir survivre[31]. L'œil inversé est adapté à la vision dans l'obscurité chez les oiseaux nocturnes par une amélioration des propriétés de la rétine.
Les différences structurelles entre vertébrés et pieuvre indiquent au moins pour l'élément de construction de la rétine une histoire de l'origine de ces types d'yeux indépendante l'une de l'autre mais convergente. D'autre part, il y a dans les gènes modulateurs des bases génétiques coïncidentes ou au moins semblables, et ainsi homologues. La génétique du développement de l'œil donne, avec le rapport simultané à la convergence et l'homologie, des indices sur l'histoire de son évolution. En d'autres termes, les photorécepteurs ou les réseaux de gènes initiateurs de l'œil peuvent avoir surgi une ou plusieurs fois, mais certains éléments de construction de l'œil, comme le cristallin ou la rétine à plusieurs couches sont apparus en tous cas plusieurs fois indépendamment.
Voies optiques et composantes
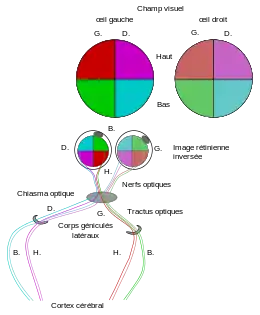
Outre les bâtonnets et les cônes comme photorécepteurs de l'œil, la rétine forme aussi quelques millions de cellules nerveuses pour un premier traitement de l'information. Pour que l'œil puisse fonctionner comme organe des sens, il faut que les informations lumineuses incidentes soient transmises au cerveau comme à une « station d'utilisation de niveau supérieur[2] ». Tout d'abord, il se forme sur la couche interne de la rétine (Fig. 10, g.) des cellules ganglionnaires. Ces cellules forment des axones qui traversent la rétine, puis doivent ensuite chercher et trouver des buts définis dans le cerveau. Le pilotage de cette recherche de buts topographique est un processus auto-organisé (guidage axonal). Ce sont des processus chimiques compliqués qui en sont responsables : des molécules dans la rétine et dans le cerveau moyen (tectum) forment des gradients chimiques étagés. Les gradients de concentration qui en découlent par diffusion, aident à diriger la direction de croissance des axones[32]. Les axones sont rassemblés sur la tache aveugle et chez les mammifères, conduits de là comme cordon nerveux central, le nerf optique, par la voie visuelle avec diverses structures neuronales vers le cortex visuel (Fig. 11). Après une étape intermédiaire, ils atteignent d'abord le centre visuel primaire pour un traitement préliminaire, puis le centre visuel secondaire. Sur ce chemin, il se passe un croisement partiel des nerfs optiques, le chiasma optique. Les axones du nerf optique de l'œil gauche correspondant à la moitié gauche de la rétine, c'est-à-dire la moitié droite du champ visuel, atteignent le centre optique primaire de la moitié gauche du cerveau et inversement pour l'autre côté du même œil, et également pour ceux de l'œil droit. Dans le domaine de réception du cerveau, il faut que les cellules arrivant déjà en nombreuses fibres isolées soient encore triées, afin qu'un traitement précis soit possible. Un deuxième tri entre parties supérieure et inférieure du champ visuel a lieu dans les « corps géniculés latéraux ». Les axones aboutissent selon leur origine dans des diverses aires étroitement délimitées. Ce processus s'appelle projection rétino-tectale. Il est substantiellement régi par des gradients d'éphrine et des récepteurs pour l'éphrine[32] - [33]. À une carte sur la rétine correspond une copie dans le cerveau. Chez les vertébrés autres que les mammifères (poissons, amphibiens, reptiles et oiseaux) il se forme un croisement complet des voies optiques. Tous les axones d'un œil d'un côté sont conduits sur le côté opposé du cerveau[2]. L'effet du croisement des nerfs optiques peut être démontré expérimentalement chez le Xenopus laevis, en supprimant une coupe oculaire et la réimplantant de l'autre côté. Il s'ensuit une association sans croisement des régions de la rétine dans le cerveau moyen[34]. L'animal cherchant sa nourriture dirige sa langue dans des directions fausses, et n'apprend qu'avec le temps une orientation correcte.
Muscles oculaires externes
Chez le vertébré, on distingue les muscles oculaires internes et externes en fonction de leur fonction et de leur situation. Les muscles externes, moteurs des mouvements oculaires ont leur origine en même temps que la capsule de Tenon (une partie de l'appareil des ligaments) et que le tissu gras de l'orbite. Ils sont tous des descendants du tissu de liaison embryonnaire (mésenchyme), qui entoure la vésicule optique, et sont formés de somitomères, certains segments du mésoderme du corps de l'embryon qui poussent des deux côtés (Fig. 12). Les muscles oculaires, qui seront excités par le nerf oculomoteur : droit supérieur, droit inférieur, droit moyen, oblique inférieur, trouvent leur origine en même temps que le releveur des paupières à partir des somitomères 1 et 2 ; l'oblique supérieur du 3e, le droit latéral, ainsi que le rétracteur de l'œil, absent chez l'homme, du 5e somitomère[35] - [36] - [37]. Les cellules musculaires des myotomes des somites migrent vers leur territoires destinataires, où les structures musculaires sont alors formées.
La suite du développement est dirigée à partir de trois centres de croissance, auxquels à chacun est attribué un nerf. C'est ainsi que se produit l'innervation motrice ultérieure des muscles oculaires par les trois nerfs cérébraux, le nerf oculomoteur (III), le trochléaire (IV), et l'abducens (VI). Le développement des muscles oculaires externes dépend d'un développement normal de l'orbite, alors que celui de l'appareil des ligaments en est indépendant[38]. Chez l'homme, la musculature de l'œil se développe tard, seulement au cinquième mois. Une coordination complète de toutes les formes de mouvements oculaires n'a lieu qu'après la naissance, à l'âge de nourrisson.
Paupières
Dans la 7e semaine, les paupières voient le jour sous forme de deux plis de peau, qui poussent de dessus et de dessous sur l'œil. En raison du recollement de leurs bords d'épithélium, elles restent fermées entre la 10e semaine et le 7e mois. Sur leur bord apparaissent les cils, et l'invagination de cordons de l'épithélium forme les glandes sébacées et les follicule pileux ciliaires. Pendant cette phase, il naît aussi la membrane nictitante aussi nommée « troisième paupière », au coin nasal des paupières. Simultanément se forme à partir du mésenchyme de la tête la conjonctive[39] - [40].
Appareil lacrymal
Dans la 9e semaine de grossesse, une série de pousses épithéliales du sac latéral de la conjonctive entre dans le mésenchyme se trouvant par-dessous, et formera la base des glandes lacrymales. Elles sont séparées en deux groupes de taille différente par le tendon du muscle élévateur de la paupière supérieure. De la « gouttière lacrymo-nasale » qui se forme vers la 7e semaine de grossesse proviennent les canaux lacrymaux. Leur creusement commence certes dès le 3e mois de grossesse, mais leurs orifices de sortie ne s'ouvriront que vers le 7e mois de grossesse[39].
Pupille et muscles oculaires internes
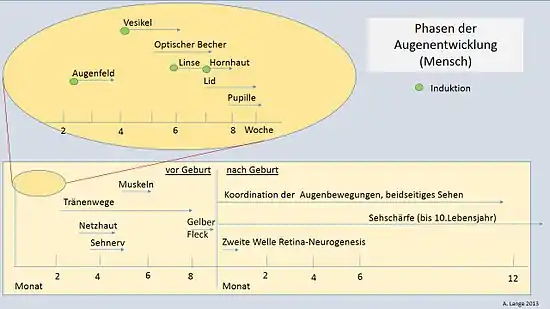
Environ à la 8e semaine de grossesse se forme chez l'homme, par l'arrondissement de l'ouverture de la coupe oculaire, la pupille, qui réagit dynamiquement à l'intensité lumineuse comme un diaphragme. Entre la coupe oculaire et l'épithélium superficiel naissent les muscles oculaires internes, les muscles annulaires et ciliaires et les fibres radiales de l'iris. Leurs cellules proviennent des cellules épithéliales ectodermiques de la coupe oculaire[40]. Le muscle ciliaire, qui règle constamment l'œil sur les diverses distances d'objet (accommodation), provient du mésoderme à l'intérieur de la choroïde et est considéré comme un dérivé de la branche neurale[41].
Dans le stade final de la grossesse il se produit chez l'embryon des réactions de la pupille, qui contrairement à des vues précédentes, sont déjà possibles et nécessaires dans l'utérus. Un élargissement de la pupille par le muscle dilatateur de la pupille voué à cette tâche est commandé par le système nerveux sympathique, une partie du système nerveux végétatif, et peut dans cette mesure être l'expression d'une excitation émotionnelle. La réaction lumineuse contrôle le nombre des neurones dans la rétine. Simultanément, il régule le développement des vaisseaux sanguins dans l'œil. Les photons dans le corps maternel activent chez l'embryon de souris une protéine, la mélanopsine, qui provoque le développement normal des vaisseaux et des neurones[42].
Développement ultérieur après la naissance
Le développement de l'œil n'est pas terminé à la naissance. Il n'atteint sa pleine taille qu'au début de la puberté, et subit pendant la première année encore une série de modifications (Fig. 13). C'est ainsi que s'étend le champ de vision ; le cristallin, la macula et la pigmentation de l'iris subissent des améliorations structurelles. Une coordination complète de toutes les formes de mouvements oculaires et notamment la formation de la vision binoculaire durent jusqu'à quelques mois après la naissance. Beaucoup de cellules du corps géniculé latéral, un élément de la voie optique, ne peuvent pas encore réagir aux signaux lumineux transmis par les cellules ganglionnaires de la rétine. L'acuité visuelle n'est pas encore complètement achevée à la naissance en raison d'une instabilité de la fixation. En réalité, l'acuité visuelle se développe jusqu'environ la 10e année de vie[38] - [43].
Pathologie
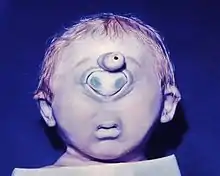
Sans doute la plus spectaculaire erreur de formation est l'œil de cyclope déjà évoqué, la cyclopie. En l'absence de séparation des deux bases oculaires, il se forme un conglomérat de parties de l'œil au milieu de la moitié supérieure du visage (Fig. ci-contre) En raison de la malfaçon corrélative du cerveau, les fœtus ne sont pas viables. Une clôture incomplète de la coupe oculaire embryonnaire conduit à des formations fendues, « colobomes » d'étendue variable : colobome de l'iris, de la choroïde, de la rétine. Les maladies virales de la mère pendant le premier tiers de la grossesse, mais aussi la prise de nombreux médicaments, peuvent conduire à des troubles du développement. On connaît le trouble du cristallin, à côté d'autres dommages, dus à la rubéole pendant la 4e à la 8e semaine de grossesse, soit dans la phase de développement du cristallin. Des restes de la membrane pupillaire, malformations dues à de mauvais enchaînements, ne sont pas rares, et sont sans inconvénient. Ils ont aussi été étudiés et décrits chez d'autres vertébrés (rat, lapin)[44].
Particularités chez certains vertébrés

Il faut aux vertébrés répondre à des besoins spécifiques, comme pour la perception dans l'obscurité (chats, oiseaux de nuit), ou une acuité visuelle à grande distance (rapaces). En particulier les chats, mais aussi les chiens, les chevaux et les bœufs ont développé par exemple comme renforcements de la lumière résiduelle pour une meilleure vision nocturne une couche rétroréfléchissante derrière ou au milieu de la rétine, le tapetum lucidum (Fig. 14)[45]. Chez les rapaces, d'autres différences de développement apparaissent. Leurs yeux sont relativement grands, ce qui permet une grande réception de lumière et ainsi une grande image de l'objet observé sur la rétine et dans le cerveau. La division de l'objet fixé sur une plus grande surface, donc un plus grand nombre de cellules de la rétine, conduit à une image plus riche en détails.
Les yeux des rapaces se forment sur la face avant de la tête, frontalement, ce qui permet l'observation simultanée d'un objet par les deux yeux. Cette disposition qui permet la vision binoculaire, est la condition préalable pour une vision dans l'espace, comme chez l'homme.
Pour optimiser leur acuité visuelle, les rapaces ont développé une accommodation hautement spécialisée, neuromusculaire. De fins muscles ciliaires y ajustent la courbure du cristallin à des éloignements variables de l'objet. De plus, les rapaces ont développé, outre la fovéa centrale, une fosse sensible latérale dans la rétine[46]. Il y règne comme dans la fovéa centrale une densification des cônes. En outre, tous les oiseaux disposent au sein du corps vitré d'un éventail en forme de peigne, le pecten oculi (en)[47]. Cette structure parcourue par d'étroits capillaires a pour fonction une irrigation sanguine et une nutrition accrues de la rétine.

L'homme voit net à diverses distances en changeant le rayon de courbure de son cristallin et déplaçant ainsi le foyer. Les serpents et poissons obtiennent le même effet en changeant la distance du cristallin à la rétine. Par un muscle spécial, les poissons peuvent tirer le cristallin de sa position de repos vers la rétine, les serpents dans l'autre sens. Les serpents ne disposent pas de paupières. La surface de leur œil est revêtue d'une écaille transparente. Des différences ont lieu pour la perception des couleurs. Tandis que l'homme forme trois types de cônes (vision trichromatique), la plupart des mammifères n'en développent que deux types (vision dichromatique), les reptiles et les oiseaux qui en descendent par contre en ont quatre (vision tétrachromatique)[48], les pigeons même cinq. Contrairement aux hommes, les oiseaux peuvent voir la lumière ultraviolette. Les requins, les baleines, les dauphins et les phoques ne voient pas les couleurs et ne possèdent qu'un type de cône sensible au vert.
Unique dans le développement de l'œil des vertébrés est la migration d'un des deux yeux chez les poissons plats. Pendant le début de sa croissance, un œil peut migrer devant la nageoire dorsale ou à travers sa base, vers le haut de l'autre côté du corps. La migration peut se produire aussi bien vers le côté gauche (turbot) que vers le droit (carrelet, sole)[49].


Quelques tortues marines, notamment le Graptemys (Graptemys pseudogeographica), peuvent tourner leurs yeux autour d'un axe imaginaire reliant les pupilles (Fig. 16 und 17). La ligne centrale des yeux reste alors la plupart du temps horizontale, même lorsque l'animal nage vers le haut ou vers le bas et regarde alors dans la direction de sa nage. Sur le plan de la ligne centrale noire, la rétine a la plus haute densité de récepteurs, si bien que l'animal vivant tout près du bord ou dans l'eau est au mieux adapté pour voir le long de la ligne horizontale. Ce développement unique est sans doute coordonné par le sens de l'équilibre dans le cerveau (organe vestibulaire), qui contrôle dans ce but des muscles oculaires spécifiques[50]. L'adaptation des yeux des vertébrés, comme l'anableps qui doivent pouvoir voir aussi bien sous l'eau qu'en-dehors pose une exigence très grande. La cornée se développe partagée en deux : la moitié supérieure est fortement courbée pour la vision hors de l'eau, et la moitié inférieure bien moins courbée pour la vision sous l'eau (Fig. 15), d'où le nom vulgaire de quatre-yeux. C'est ainsi qu'il est tenu compte de la différence entre les indices de réfraction de l'air et de l'eau, et une vision également bonne dans l'air et dans l'eau. La rétine de l'anableps se développe aussi en deux parties. La moitié destinée à la vision dans l'air a deux fois plus de cônes que l'autre[49].
Les caméléons développent plusieurs propriétés originales de leurs yeux. Ceux-ci sont mobiles indépendamment l'un de l'autre. On suppose que cela aboutit à un traitement indépendant et séparé de l'information des deux yeux dans le cerveau. Avec la petite ouverture de leurs yeux, les caméléons obtiennent un effet de camera obscura supplémentaire, qui leur permet de voir net à un kilomètre. Leur vitesse de focalisation est environ quatre fois plus grande que celle de l'homme[51]. D'autres particularités des yeux de vertébrés sont le cristallin sphérique, focalisé à courte distance au repos chez les poissons, les cristallins multifocaux chez beaucoup d'espèces de chats, la position de la rétine en oblique par rapport au cristallin chez le cheval, ce qui provoque un effet de vision glissante, ou la membrane nictitante protectrice chez les grenouilles, les oiseaux et les chiens, existant aussi à l'état rudimentaire dans l'angle nasal de l'œil chez l'homme[49]. Les processus de développement et la génétique des composantes décrites ici et de leur différences chez les vertébrés n'ont pas encore été beaucoup explorés.
Chronologie des découvertes scientifiques sur le développement de l'œil
| Année | Chercheur | Découverte |
|---|---|---|
| v. 350 av. J.-C. | Aristote[52] | L'origine de l'œil et d'autres organes n'est pas préformée, mais ils naissent l'un après l'autre à la manière d'une réaction en chaîne[53]. Liaison de l'œil avec le cerveau, l'œil comme partie du cerveau (observé sur un embryon de poulet)[54]. Liaison œil-cerveau cependant non reconnue comme une liaison de physiologie des sens[55]. |
| 1660 | E. Mariotte | Tache aveugle |
| 1817 | Ch. Pander | La vésicule optique provient du cerveau antérieur. |
| 1830 | E. Huschke | Le cristallin se forme à partir de cellules ectodermiques superficielles. |
| 1830 | E. Huschke | La coupe optique est formée à partir de la vésicule. |
| 1850–55 | R. Remak | L'épiderme du cristallin se développe à partir de la vésicule cristalline. |
| 1861 | A. v. Kölliker | La rétine provient de deux couches de la coupe optique. |
| 1875 | J. P. Müller | Les fibres du nerf optique commencent dans la rétine et poussent jusqu'au cerveau antérieur. |
| 1895 | G. Wolff | Première description de la régénération du cristallin par transformation de tissu à partir de l'iris chez la salamandre[56]. |
| 1920 | H. Spemann | L'induction du cristallin résulte de la vésicule optique. |
| 1963 | R.W. Sperry | Croissance et orientation des fibres du nerf optique[32]. |
| 1992 | R. Grainger | Étapes de l'induction du cristallin : de la compétence pour le cristallin jusqu'à la spécialisation en cristallin de l'ectoderme[16]. |
| 1995 | W. Gehring | Découverte du gène Pax6 comme gène modulateur pour tous les types d'yeux[4]. |
| 1999 | R. Chow & al. | Le gène Pax6 est démontré comme inducteur pour l'œil chez le vertébré[5]. |
| 2002 | A. Knecht & al. | Induction du tronc neural comme processus multigénétique[57]. |
| 2002 | S. Wang & al. | Régulation de la différenciation cellulaire de la rétine[23]. |
| 2003 | M. Zuber & al. | Le réseau des gènes de régulation pour la formation de l'œil relativise la position isolée de Pax6[3]. |
| 2006 | M. Rembold & al. | La migration cellulaire individuelle dans le cerveau provoque la formation de la vésicule optique[14] - [15]. |
| 2008 | P. Betancour & al. | Un réseau de gènes de régulation dirige la formation de la tige neuronale[58]. |
| 2013 | S. Rao & al. | La diffusion de la lumière dans le corps maternel active la mélanopsine pour la formation des vaisseaux et des neurones[42]. |
Liens internet
- (de) « Online Animation der Augenentwicklung » (consulté le )
- (en) « Developmental origins of the eye » (consulté le )
- (en) « PY4302 Developmental Neuroscience Eye Development – PowerPoint PPT Presentation » (consulté le )
- (en) « Eye development » (consulté le )
- (de) « Bilder der frühen Ausbildung des Augenfelds bei Xenopus laevis durch Pax6-Rx1-Sox3-Expression auf der Neuralplatte » (consulté le )
- (de) « Ein tiefer Einblick in die Evolution der Augen. Ein Masterkontrollgen kontrolliert die Entwicklung », sur Neue Zürcher Zeitung, (consulté le )
- (de) « Zebrafisch: Augenenmorphogenese im Film » (consulté le )
- (en) « Eye Development : (Special Issue) », The International Journal of Developmental Biology, University of the Basque Country Press (UBC Press), vol. 48, nos 8/9, , p. 685–1058 (lire en ligne, consulté le )
- (en) James F. Fadool, John E. Dowling, « Zebrafish: A model system for the study of eye genetics » (consulté le )
Références
- (en) Trevor D. Lamb, Shaun P. Collin et Edward N. Pugh Jr., « Evolution of the vertebrate eye: opsins, photoreceptors, retina and eye cup », Nature Reviews, vol. 8, , p. 960–975
- (de) Werner A. Müller et Monika Hassel, Entwicklungsbiologie und Reproduktionsbiologie von Mensch und Tieren, Springer Spektrum, , 5e éd.
- (en) Michael E. Zuber, Gaia Gestri, Andrea S. Viczian, Giuseppina Barsacchi et William A. Harris, « Specification of the vertebrate eye by a network of eye field transcription factors », Development, vol. 130, no 12, , p. 5155–5167
- (en) Georg Halder, Patrick Callaerts et Walter J. Gehring, « Induction of Ectopic Eyes by Targeted Expression of the eyeless Gene in Drosophila », Science, vol. 267, , p. 1788–1792
- (en) Robert L. Chow, Curtis R. Altmann, Richard A. Lang et Ali Hemmati-Brivanlou, « Pax6 induces ectopic eyes in a vertebrate », Development, vol. 126, , p. 4213–4222
- (en) D. Uwanogho, M. Rex, E.J. Cartwright, G. Pearl, C. Healy, P.J. Scotting et P.T. Sharpe, « Embryonic expression of the chicken Sox2, Sox3 and Sox11 genes suggests an interactive role in neuronal development Mech », Development, vol. 49, , p. 23–36
- (en) Reinhard W. Köste, Ronald P. Kühnlein et Joachim Wittbrodt, « Ectopic Sox3 activity elicits sensory placode formation », Science direct, vol. 95, nos 1–2, , p. 175–187
- (de) Michael Kühl et Susanne Gessert, Entwicklungsbiologie, coll. « UTB Basics »,
- (en) Désirée White et Montserrat Rabago-Smith, « Genotype–phenotype associations and human eye color », Journal of Human Genetics, vol. 56, , p. 5–7
- (en) M. A. Serikaku et J.E. O’Tousa, « Sine oculis is a homeobox gene required for Drosophila visual system development », Genetics, vol. 138, no 4, , p. 1137–1150
- (en) Nancy M. Bonini, Quang T. Bui, Gladys L. Gray-Board et John M. Warrick, « The Drosophila eyes absent gene directs ectopic eye formation in a pathway conserved between flies and vertebrates », Development, vol. 124, , p. 4819–4826
- (en) T. A. Heanue, R. J. Davis, D. H. Rowitch, A. Kispert, A. P. McMahon, G. Mardon et C.J. Tabin, « Dach1, a vertebrate homologue of Drosophila dachshund, is expressed in the developing eye and ear of both chick and mouse and is regulated independently of Pax and Eya genes », Mech Dev, vol. 111, nos 1-2, , p. 75–87
- (en) Chin Chiang, Ying Litingtung, Eric Lee, Keith E. Young, Jeffrey L Corden, Heiner Westphal et Philip A. Beachy, « Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function », Nature, vol. 383, no 6599, , p. 407–413 (PMID 8837770, DOI 10.1038/383407a0)
- (en) M. Rembold, F. Loosli, R. J. Adams et J. Wittbrodt, « Individual cell migration serves as the driving force for optic vesicle evagination », Science, vol. 313, no 5790, , p. 1130–1134
- (de) « Ein wanderndes Auge. », sur Das Biotechnologie und Life Sciences Portal Baden-Württemberg, (consulté le )
- (en) R. M. Grainger, « Embryonic lens induction: Shedding light on vertebrate tissue determination », Transgen, vol. 8, , p. 349–355
- (de) Bertram Schnorr et Monika Kressin, Embryologie der Haustiere, Enke, 6e éd.
- (de) Nick Lane, « 7: Sehen », dans Leben - Verblüffende Erfindungen der Evolution, Primus Verlag,
- (de) Faszination Lebenswissenschaften, Wiley-VCH,
- (de) Renate Lüllmann-Rauch et Friedrich Paulsen, Taschenbuch der Histologie, Stuttgart, Thieme, 4e éd.
- (en) Égouchi, Goro et al., « Regenerative capacity in newts is not altered by repeated regeneration and ageing », Nature Communication, , p. 384
- (en) Leon S. Stone, « Regeneration of the Lens, Iris, and Neural Retina in a Vertebrate Eye », Yale J Biol Med, vol. 32, no 6, , p. 464–473
- (en) S. W. Wang, X. Mu, W. J. Bowers et W. H. Klein, « Retinal ganglion cell differentiation in cultured mouse retinal explants », Methods, vol. 28, no 4, , p. 448–456
- (en) M. J. Belliveau et C. L. Cepko, « Extrinsic and intrinsic factors control the genesis of amacrine and cone cells in the rat retina », Development, vol. 126, no 3, , p. 555–566
- (en) C. J. Neumann et C. Nüsslein-Volhard, « Patterning of the zebrafish retina by a wave of sonic hedgehog activity », Science, vol. 289, no 5487, , p. 2137–2139
- (en) Alena Shkumatava, Sabine Fischer, Ferenc Müller, Uwe Strahle et Carl J. Neumann, « Sonic hedgehog, secreted by amacrine cells, acts as a short-range signal to direct differentiation and lamination in the zebrafish retina », Development, vol. 131, , p. 3849–3858
- (en) S. J. Isenberg, « Macular development in the premature infant », Am J Ophthalmol, vol. 101, no 1, , p. 74–80
- (en) Linda Conlin, « Embryonic Eye Development », (consulté le )
- (de) W. Westheide, R. M. Rieger et G. Rieger (dir.), Spezielle Zoologie, Springer Verlag, , 759 p. (ISBN 978-3-8274-2039-8), 2 : Wirbel- oder Schädeltiere, p. 100
- (de) Johannes W. Rohen et Elke Lütjen-Drecoll, Funktionelle Histologie, Schattauer, F.K. Verlag, , 4e éd., 500 p. (ISBN 3-7945-2044-0, lire en ligne), p. 476
- (de) Axel Lange, Darwins Erbe im Umbau. Die Säulen der Erweiterten Synthese in der Evolutionstheorie, Wurtzbourg, Königshausen & Neumann, , 424 p. (ISBN 978-3-8260-4813-5, lire en ligne), p. 91–94
- (en) R. W. Sperry, « Chemoaffinity in the Orderly Growth of Nerve Fiber patterns and Connections », Proc. Natl. Acad. Sci. (USA), vol. 50, , p. 703–710
- (en) D.D. O’Leary et D.G. Wilkinson, « Eph receptors and ephrins in neural development », Curr Opin Neurobiol., vol. 9, no 1, , p. 65–73
- (en) M. Jacobson, « Retinal ganglion cells: specification of central connections in larval Xenopus laevis », Science, vol. 155, no 3766, , p. 1106–1108
- selon Wolfgang Maier : Kopf. dans (de) W. Westheide et R. Rieger (dir.), Spezielle Zoologie, Stuttgart/Jena, Gustav Fischer, (ISBN 3-8274-1482-2), 1: Einzeller und Wirbellose Tiere, p. 32
- (de) Milton Hildebrand et George Goslow, Vergleichende und funktionelle Anatomie der Wirbeltiere : (édition originale anglaise), USA, John Wiley & Sons, , 713 p. (ISBN 3-540-00757-1), p. 204 sq
- (de) Jan Langman et Thomas W. Sadler, Medizinische Embryologie. Die normale menschliche Entwicklung und ihre Fehlbildungen, Stuttgart, Thieme Verlag, , 10e éd. (ISBN 3-13-446610-4), p. 172 sq
- (de) Herbert Kaufmann, W. de Decker et al., Strabismus : (édition retravaillée et étendue), Stuttgart/New York, Georg Thieme, , 4e éd., 659 p. (ISBN 978-3-13-129724-2)
- Walther Grauman, Dieter Sasse: Compact Lehrbuch der gesamten Anatomie 4: Sinnessysteme, Haut, ZNS, Periphere Leitungsbahnen. 1. Auflage. Band 4, Schattauer Verlag, 2004, (ISBN 3-7945-2064-5).
- (de) Martina Ibounigg, Spezielle Embryologie, Munich, GRIN Verlag, (ISBN 3-638-98508-3, DOI 10.3239/9783638985086)
- (en) R. W. Dudek et J. D. Fix, « Eye », dans Embryology – Board Review Series, Lippincott Williams & Wilkins, , 3e éd. (ISBN 0-7817-5726-6), p. 92
- (en) Sujata Rao, Christina Chun, Jieqing Fan, J. Matthew Kofron, Michael B. Yang, Rashmi S. Hegde, Napoleone Ferrara, David R. Copenhagen et Richard A. Lang, « A direct and melanopsin-dependent fetal light response regulates mouse eye development », Nature, no 494, , p. 243–246
- (de) Barbara Käsmann-Kellner, « Entwicklung des Sehens im Kindesalter – Amblyopie und Screening », sur Universitäts-Augenklinik Homburg (consulté le )
- (en) G. Bargsten, « Persistant remnants of the pupillary membrane in adult rats of different strains », Z. Versuchstierkunde, vol. 30, , p. 117–121
- (de) Paul Simoens, « Sehorgan, Organum visus », dans Franz-Viktor Salomon, Hans Geyer, Uwe Gille, Anatomie für die Tiermedizin : (édition retravaillée et étendue), Stuttgart, Enke, , 2e éd. (ISBN 978-3-8304-1075-1), p. 579–612
- (de) O.-E. Lund et B. von Barsewisch, « Die Macula in der Tierreihe. Erkrankungen der Macula », Deutsche Ophthalmologische Gesellschaft, Springer, vol. 73, , p. 11–17
- (en) S. G. Kiama, J. N. Maina, J. Bhattacharjee et K. D. Weyrauch, « Functional morphology of the pecten oculi in the nocturnal spotted eagle owl (Bubo bubo africanus), and the diurnal black kite (Milvus migrans) and domestic fowl (Gallus gallus var. domesticus): a comparative study », Journal of Zoology, vol. 254, , p. 521–528
- (de) Timothy H. Goldsmith, « Vögel sehen die Welt bunter », Spektrum der Wissenschaft, , p. 96–103 (lire en ligne, consulté le )
- (de) Georg Glaeser et Hannes F. Paulus, Die Evolution des Auges, Springer-Spektrum,
- (en) Kenneth T. Brown, « A linear area centralis extending across the turtle retina and stabilized to the horizon by non-visual cues », Vision Research, vol. 9, no 9, , p. 1053–1062
- (en) A. Herrel, J.J. Meyers, P. Aerts et K.C. Nishikawa, « The Mechanics of prey prehension in chameleons », Journal of Experimental Biology, vol. 203, , p. 3255–3263
- (de) Aristote, Naturgeschichte der Tiere [« Histoire naturelle des animaux »], Nabu Press,
- (de) Horst Seidl, Beiträge zu Aristoteles' Naturphilosophie, Editions Rodopi, , p. 146
- (de) Carolin M. Oser-Grote, « Das Auge und der Sehvorgang bei Aristoteles und der hippokratischen Schrift De carnibus », dans Wolfgang Kullmann, Aristotelische Biologie : Intentionen, Methoden, Ergebnisse, Stuttgart, Steiner, (ISBN 3-515-07047-8), p. 339
- (de) Carolin M. Oser-Grote, « Das Auge und der Sehvorgang bei Aristoteles und der hippokratischen Schrift De carnibus », dans Wolfgang Kullmann, Aristotelische Biologie : Intentionen, Methoden, Ergebnisse, Stuttgart, Steiner, (ISBN 3-515-07047-8), p. 340
- (de) Gustav Wolff, « Entwicklungsphysiologische Studien; Teil I: Die Regeneration der Urodelenlinse », dans Roux Arch. Entw. Mech. Org., t. 1, p. 280–390
- (en) A. K. Knecht et M. Bronner-Fraser, « Induction of the neural crest: a multigene process », Nat Rev Genet., vol. 3, no 6, , p. 453–461
- (en) Paola Betancur, Marianne Bronner-Fraser et Tatjana Sauka-Spengler, Assembling Neural Crest Regulatory Circuits into a Gene Regulatory Network, vol. 26, coll. « Annual Review of Cell and Developmental Biology », p. 581–603
Bibliographie
- (de) Jan Langman et Thomas W. Sadler, Medizinische Embryologie. Die normale menschliche Entwicklung und ihre Fehlbildungen, Stuttgart, Thieme Verlag, , 10e éd. (ISBN 3-13-446610-4)