Cycloate
Le cycloate est un composé organique de la famille chimique des thiocarbamates, de formule C11H21NOS. Cest la substance active d'un produit phytopharmaceutique (ou produit phytopharmaceutique, ou pesticide), qui présente un effet herbicide.
| Cycloate | |
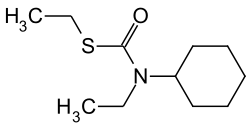
| |
| Identification | |
|---|---|
| Nom systématique | N-cyclohexyl-N-éthylcarbamothioate de S-éthyle |
| No CAS | |
| No ECHA | 100.013.166 |
| PubChem | 14337 |
| SMILES | |
| InChI | |
| Apparence | liquide huileux incolore, odeur aromatique[1] |
| Propriétés chimiques | |
| Formule | C11H21NOS [Isomères] |
| Masse molaire[2] | 215,356 ± 0,016 g/mol C 61,35 %, H 9,83 %, N 6,5 %, O 7,43 %, S 14,89 %, |
| Propriétés physiques | |
| T° fusion | 11,5 °C[1] |
| T° ébullition | 145 à 146 °C (13,00 hPa)[3] |
| Solubilité | 85 mg·l-1 (eau, 22 °C) miscible avec la plupart des solvants organiques (acétone, benzène, méthanol, éthanol, xylène, kérosène, etc.)[1] |
| Masse volumique | 1,016 g·cm-3 (20 °C)[3] |
| Point d’éclair | > 100 °C[3] |
| Écotoxicologie | |
| DL50 | 1,678 mg·kg-1 (rat, oral)[3] 3,000 mg·kg-1 (lapin, dermique)[3] |
| CL50 | 4 h-22,500 mg·m-3 (rat, inhalation)[3] |
| LogP | 3,88[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le cycloate est un liquide huileux incolore, à l'odeur aromatique[1]. Il est stable par hydrolyse ou photolyse, et est excrété par les urines principalement sous forme de N-éthylcyclohexylamine après ingestion par les mammifères[4]. C'est aussi sous cette forme qu'il est rejeté comme produit de dégradation par les plantes[5].
Ses caractéristiques physico-chimiques dont l'ordre de grandeur est indiqué ci-après, influencent les risques de transfert de cette substance active vers les eaux, et le risque de pollution des eaux :
- Hydrolyse à pH 7 : stable,
- Solubilité : 95 mg·L-1,
- Coefficient de partage carbone organique-eau : 430 cm3·g-1. Ce paramètre, noté Koc, représente le potentiel de rétention de cette substance active sur la matière organique du sol. La mobilité de la matière active est réduite par son absorption sur les particules du sol.
- Durée de demi-vie : 30 jours. Ce paramètre, noté DT50, représente le potentiel de dégradation de cette substance active, et sa vitesse de dégradation dans le sol.
- Coefficient de partage octanol-eau : 4,11. Ce paramètre, noté log Kow ou log P, mesure l’hydrophilie (valeurs faibles) ou la lipophilie (valeurs fortes) de la substance active.
Synthèse
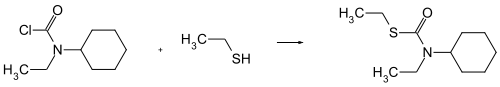
Le cycloate peut être produit par réaction entre le chlorure de N-cyclohexyl-N-éthylcarbamoyle avec l'éthanethiol[1] :
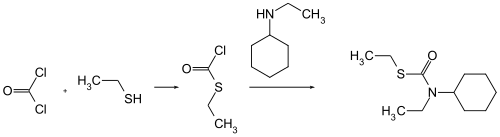
Alternativement, il peut être produit par réaction entre le phosgène et l'éthanethiol, produisant le thiochlorformiate d'éthyle qui est ensuite mis â réagir avec la N-éthylcyclohexylamine[6]
Utilisation
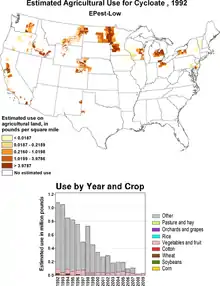
Le cycloate est utilisé comme herbicide, contre les graminées et les mauvaises herbes à feuille large. Son usage aux États-Unis a été approuvé en juillet 1967, dans le cadre de la culture de l'épinard et de la betterave sucrière. Son utilisation domestique reste interdite. En 1999, les États-Unis en utilisaient environ 300 tonnes. Depuis son utilisation a largement chuté[1] - [4].
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est non soutenue en vue de l'inscription à l’annexe I de la directive 91/414/CEE.
- pour la France : cette substance active n'est pas autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché.
Écotoxicologie
Sur le plan de l’écotoxicologie, les concentrations létales 50 (CL50) dont l'ordre de grandeur est indiqué ci-après, sont observées :
Voir aussi
Notes et références
- « Cycloate » dans la base de données Hazardous Substances Data Bank
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Cycloate, consultée le 21 juillet 2019.
- EPA: Reregistration Eligibility Decision (RED) for Cycloate
- (en) John H. Montgomery, Agrochemicals Desk Reference : Second Edition, Boca Raton/New York, CRC Press, , 656 p. (ISBN 1-56670-167-8), p. 117
- Thomas A. Unger, Pesticide Synthesis Handbook, William Andrew, , 1104 p. (ISBN 0-8155-1853-6, lire en ligne), p. 103