Carbone 14
Le carbone 14, noté 14C, est l'isotope du carbone[2] - [3] - [4] dont le nombre de masse est égal à 14 (c'est un isobare de la forme la plus commune de l'azote) : son noyau atomique compte 6 protons et 8 neutrons avec un spin 0+ pour une masse atomique de 14,003 241 99 g/mol. Il est caractérisé par un excès de masse de 3 019,89 keV et une énergie de liaison nucléaire par nucléon de 7 520 keV[1]. Le carbone 14 a longtemps été le seul radioisotope du carbone à avoir des applications. Pour cette raison, il était appelé radiocarbone[5].
| Présence naturelle | 1 ppt |
|---|---|
| Demi-vie | 5 730 ± 40 ans[1] |
| Produit de désintégration | 14N |
| Masse atomique | 14,003241989(4) u |
| Spin | 0+[1] |
| Excès d'énergie | 3 019,893 ± 0,004 keV[1] |
| Énergie de liaison par nucléon | 7 520 keV[1] |
Un gramme de carbone 14 pur présente une activité de 164,9 GBq. L'unique mode de désintégration est l'émission d'une particule β avec une chaleur de réaction de 156 keV en se transmutant en azote 14N ; avec une période radioactive de 5 730 ± 40 ans, selon la réaction :
Sur Terre, le carbone 14 est formé lors de l'absorption de neutrons par des atomes d'azote de la stratosphère et des couches hautes de la troposphère et l’expulsion d'un proton :
que l'on résume en :
Les neutrons proviennent de la collision des rayons cosmiques avec les noyaux d'atomes de l'atmosphère, principalement l'azote.
Applications
L'application la plus connue du carbone 14 est la datation mais il est aussi utilisé comme traceur biologique ou plus récemment pour reconstituer l'évolution au cours des derniers millénaires du climat, du champ magnétique ou de l'activité solaire[6].
Découverte
Le carbone 14 a été découvert le par Martin Kamen du Radiation Laboratory et Samuel Ruben du département de Chimie de l'université de Californie à Berkeley.
Dès 1934, à Yale, Franz Kurie suggère l'existence du carbone 14. Il observe en effet que l'exposition d'azote à des neutrons rapides produit parfois dans une chambre à brouillard de Wilson une longue trace fine au lieu de la courte trace plus épaisse laissée par une particule alpha. Dès 1936, il est établi que les neutrons rapides réagissent avec l'azote pour donner du bore tandis que les neutrons lents réagissent avec l'azote pour former du carbone 14. Ceci correspond à la « découverte au sens physique » du carbone 14 par opposition à sa « découverte au sens chimique », c'est-à-dire sa production en quantité suffisante pour pouvoir mesurer une activité.
Kamen et Ruben collaborent à des recherches interdisciplinaires sur les traceurs biologiques dans le but de déterminer le produit initial de la fixation du dioxyde de carbone lors de la photosynthèse. L'utilisation du carbone 11 comme traceur est très difficile en raison de sa courte période radioactive (21 minutes). Ruben essaye cependant de développer une technique d'étude de la photosynthèse : il fait pousser une plante en présence de dioxyde de carbone contenant du carbone 11, la tue, puis sépare et analyse ses composants chimiques, avant que la radioactivité ne devienne indétectable, pour trouver quels composants contiennent le traceur. L'échec de cette technique stimule la recherche d'un autre isotope radioactif à plus longue période radioactive, le carbone 14.
Une des principales sources de financement du Radiation Laboratory est la fabrication dans ses cyclotrons de radioisotopes pour la recherche biomédicale. À la fin de l'année 1939, Ernest Orlando Lawrence, directeur du Radiation Laboratory, est inquiet de la concurrence d'isotopes stables rares comme le carbone 13, l'azote 15 ou l'oxygène 18 qui peuvent se substituer aux radioisotopes comme traceurs biologiques. Il offre à Kamen et Ruben un accès illimité aux cyclotrons de 37 et 60 pouces pour rechercher des radioisotopes de périodes radioactives plus élevées pour les principaux éléments présents dans les composés organiques : hydrogène, carbone, azote ou oxygène.
Cette campagne de recherche systématique commence par le carbone. Kamen et Ruben bombardent du graphite avec des deutons (noyaux de deutérium). La faible activité qu'ils mesurent le , d'environ quatre fois le bruit de fond, confirme l'existence du carbone 14 avec une période radioactive qui se révèle bien supérieure (plusieurs milliers d'années) à ce que prévoyait la théorie. Cette période radioactive très longue, et donc la faible activité du carbone 14, explique pourquoi celui-ci n'a pas été découvert auparavant.
Kamen et Ruben constatent par la suite que la réaction de neutrons lents avec de l'azote pour donner du carbone 14 est nettement plus productive que la réaction deuton-carbone 13.
L'application du carbone 14 comme traceur biologique reste toutefois limitée par son coût de production, le cyclotron étant la seule source de neutrons disponible.
Après la Seconde Guerre mondiale, le développement des réacteurs nucléaires, qui utilisent le graphite comme modérateur, autorise la production massive de carbone 14, dont l'emploi se répand dans tous les domaines de recherche biomédicale.
Le carbone 14 comme polluant

Accidents industriels
En tant que radionucléide artificiel, le carbone 14 peut aussi quand il a été accidentellement ou volontairement libéré dans l'environnement être un polluant. Ainsi, à titre d'exemple, en France, près d'un ancien laboratoire de la société Isotopchim au lieu-dit « le Belvédère de Ganagobie » (30 km au nord-ouest de Forcalquier, dans les Alpes-de-Haute-Provence), des arbres ont bioaccumulé (de 1989 à 1997) des quantités significatives de carbone 14 provenant de rejets atmosphériques du laboratoire voisin qui produisait des marqueurs moléculaires radioactifs pour la chimie fine. L'IRSN a produit une fiche[7] sur le 14C et l'environnement, après avoir évalué les conséquences radiologiques de deux hypothèses qui étaient :
- le maintien du site en l'état, en particulier en laissant sur place les arbres et en continuant l’entretien du site qui est fait actuellement ;
- l’enlèvement total ou partiel des arbres contaminés.
Les conclusions de l'IRSN sont que maintenir sur place des arbres conduit à un risque radiologique infime pour les riverains (moins d’un centième de dose annuelle due au carbone 14 présent naturellement dans l’environnement qui est de 12 microsievert), les conséquences pour les arbres ou l'écosystème étant difficiles à évaluer[8].
Des cas particuliers existent[9] dont le carbone 14 d'essais nucléaires ou d'accidents (la catastrophe de Tchernobyl en particulier) ayant été capté et piégé par des plantes annuelles près du lieu d'un accident (ex. : Artemisia absinthium après l'accident de Tchernobyl)[9], et surtout par des arbres, qui dans leurs racines et dans leurs cernes peuvent piéger ce 14C pendant toute leur durée de vie. Dans la partie la plus biodisponible de l'arbre, il est principalement localisé dans l'épaisseur de quelques cernes de croissance correspondant à l'époque de la contamination (bois formé durant quelques années, avant que le 14C n'ait eu le temps d'être dilué dans l'environnement) ; voir illustrations. Il peut être relargué lors d'incendies de forêt. Des années après, il pourra aussi repasser dans l'écosystème via les insectes xylophages et saproxylophages qui consommeront ces cernes « radiomarqués », ou les champignons qui le dégraderont.
Centrales électriques au charbon
Les centrales au charbon n'émettent, compte tenu de l'âge de la houille, que du carbone 12 (et du carbone 13) et diminuent légèrement la teneur en carbone 14 dans l'atmosphère, les océans et à la surface terrestre. La radioactivité du charbon se trouve dans les cendres et est constituée principalement par celle de l'uranium, du radium et du thorium.
Essais nucléaires
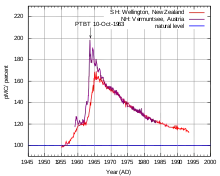
Après la Seconde Guerre mondiale et le premier usage de la bombe atomique, les nombreux essais nucléaires atmosphériques des années 1960 ont libéré une grande quantité de divers radionucléides et radioisotopes (dont le carbone 14) dans l'air ; assez pour doubler le taux normal de 14C de l'atmosphère[10], et par suite pour le faire augmenter dans la biomasse[10] (et par suite dans la nécromasse).
L'écotoxicologie et la toxicologie nucléaire considèrent — hors quelques exceptions (voir plus bas) — que ce carbone 14 s'est largement dilué dans l'air et les mers, et que la part du 14C artificiel n'est plus distinguable de celui circulant naturellement (dont dans la biomasse qui contient plus de cent fois plus de carbone que ce que contient tout l'air de la planète[10]).
Le stock global de carbone 14 de la biomasse a presque partout retrouvé son niveau d’activité d'origine.
Les spécialistes (et l'IRSN en France) considèrent que « Les scénarios catastrophiques de bioaccumulation rencontrés dans le cas de toxiques comme le mercure ou le DDT sont donc exclus dans le cas du carbone 14 »[10].
Incidence sur la radiodatation
Une conséquence de faibles rejets de carbone 14 dans l'environnement est de créer pour les chercheurs du futur des « anomalies » dans une datation par le carbone 14 faite sur les tissus ainsi marqués. Le carbone 14 ajouté artificiellement aura pour effet de fausser les résultats de la datation en donnant des âges apparents plus bas que ce qu'ils sont réellement, pouvant aller jusqu'à afficher des âges apparents négatifs si le marquage en carbone 14 est suffisamment important.
Inversement, la végétation le long des autoroutes et axes de grande circulation automobile présente un marquage négatif : le gaz carbonique métabolisé par cette végétation provenant majoritairement de combustibles fossiles, dont le carbone 14 a disparu après quelques dizaines de milliers d'années, l'équilibre isotopique qui y est relevé peut correspondre à des datations de plusieurs milliers d'années, pour des plantes pourtant encore sur pied.
Radioactivité naturelle
Avec le potassium 40, le carbone 14 constitue la deuxième source de radioactivité du corps humain.
Notes et références
-
(en) « Live Chart of Nuclides: 14
6C
8 », sur https://www-nds.iaea.org/, AIEA, (consulté le ). - « Carbone », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales (sens 1) [consulté le 30 mai 2016].
- Informations lexicographiques et étymologiques de « carbone » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales [consulté le 30 mai 2016].
- Entrée « carbone 14 », sur Dictionnaires de français (en ligne), Larousse (consulté le ).
- Informations lexicographiques et étymologiques de « radiocarbone » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales [consulté le 30 mai 2016].
- (en) T. J. Heaton, E. Bard, Bronk Ramsey, M. Butzin, P. Köhler, R. Muscheler, P. J. Reimer et L. Wacker, « Radiocarbon: A key tracer for studying Earth’s dynamo, climate system, carbon cycle, and Sun », Science, vol. 374, no 6568, (DOI 10.1126/science.abd7096, lire en ligne).
- IRSN, Fiche pédagogique sur le 14C et l'environnement
- Bilan IRSN 2009 de la surveillance radiologique de l’environnement en France : vers une évolution de la stratégie de surveillance, 3 février 2011
- Grodzinsky, D. M. (1995c), Ecological and biological consequences of Chernobyl catastrophe. 4. In: Bar’yakhtar, V. G. (éd.), Chernobyl Catastrophe: History, Social, Economics, Geochemical, Medical and Biological Consequence (Naukova Dumka, Kiev), (ru) « lire en ligne »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- Jean‐Claude Barescut (directeur du programme « Risques chroniques »), Institut de radioprotection et de sûreté nucléaire, Note technique Risque chronique et radioactivité Le programme de recherche « ENVIRHOM » (lancé en 2001 et mobilisant en 2004 près de 40 chercheurs), Environnement, Risques & Santé, vol. 3, no 3, 173-7, mai-juin 2004
Voir aussi
Bibliographie
- (en) John F. Marra, Hot Carbon : Carbon-14 and a Revolution in Science, Columbia University Press, , 280 p. (ISBN 978-0-231-18670-4 et 0-231-18670-3)
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |