Aspergillome
L'aspergillome, ou aspergillose pulmonaire chronique, est une maladie infectieuse humaine du poumon causée par la colonisation d'une cavité par un champignon du genre Aspergillus, le plus souvent Aspergillus fumigatus. Les spores se transmettent par l'air, sans contagiosité entre les personnes. Il s'agit d'une complication fréquente des cavernes tuberculeuses, qui sont elles-mêmes la première séquelle de la tuberculose pulmonaire, et correspondent à une destruction localisée du poumon. Les cavités des cavernes pulmonaires se défendent mal contre l'infection à Aspergillus, qui y prolifère alors jusqu'à former une pseudo-tumeur comblant partiellement la caverne. On estime que, chaque année, plus de 370 000 personnes dans le monde développent ainsi un aspergillome.
| Causes | Aspergillus ou Aspergillus fumigatus |
|---|
| Médicament | Antimycosique, triazole, itraconazole, voriconazole et posaconazole |
|---|---|
| Spécialité | Infectiologie |
![]() Mise en garde médicale
Mise en garde médicale
On distingue plusieurs formes d'aspergillomes, dont la gravité et les symptômes varient avec l'état général de la personne malade. L'aspergillome se distingue lui-même des autres infections à Aspergillus par son caractère local. On en distingue plusieurs formes selon leur taille et le degré de destruction du poumon sous-jacent. La complication majeure des aspergillomes est le saignement, qui entraîne une expectoration de sang appelée hémoptysie, et peut parfois engager le pronostic vital. Le diagnostic est réalisé sur un faisceau d'éléments regroupant l'aspect radiologique et la recherche du champignon. Le traitement est médical, par antifongiques, ou chirurgical.
Historique
Le genre Aspergillus a été décrit en 1729 par le botaniste italien Pier Antonio Micheli[1]. La première description de l'aspergillome chez l'être humain est attribuée à John Hughes Bennett en 1842[2], mais cette paternité a été remise en cause[3]. C'est en 1847 que Theodor Sluyter a rapporté le premier cas humain certain d'aspergillose diffuse[4], et en 1855 le médecin allemand Friedrich Küchenmeister a fait la première description autopsique d'un aspergillome développé dans un cancer bronchique excavé[5]. Les premiers aspergillomes développés sur une caverne tuberculeuse ont été décrits à partir de 1856[6] - [7]. Ce n'est toutefois qu'en 1938 que leur description radiologique est réalisée[8], et en 1952 que la classification des lésions a été affinée[3]. Les premiers essais de traitement par antifongique datent de 1959[9], décennie où a été développé le traitement chirurgical[10].
Généralités
Germes en cause

Aspergillus fumigatus est un champignon saprophyte du sol, très courant, et l'un de ceux relâchant le plus de spores dans l'air[11]. Les spores, de 2 à 3 µm de diamètre, sont suffisamment petites pour progresser dans l'arbre respiratoire jusqu'aux alvéoles pulmonaires, et assez nombreuses pour qu'un être humain en inhale plusieurs centaines par jour[11]. Elles sont normalement éliminées par le système immunitaire et ne sont pathogènes que dans certains cas.
Si tous les champignons du genre Aspergillus sont potentiellement pathogènes (notamment A. flavus, A. terreus, A. niger et A. nidulans), Aspergillus fumigatus est responsable de 90 % des infections pulmonaires chez l'humain[11]. On en distingue plusieurs types : aspergillose bronchopulmonaire allergique, aspergillose invasive et aspergillome. Au contraire des infections diffuses comme l'aspergillose invasive et l'aspergillose bronchopulmonaire allergique, les aspergillomes sont des infections locales caractérisées par le développement du champignon dans une cavité. Les sinusites aspergillaires en sont une autre forme, où le champignon se développe dans la cavité naturelle d'un sinus de la face[12].
Terrain
Si les infections diffuses du poumon par Aspergillus sont l'apanage des patients immunodéprimés[11], la colonisation d'une cavité pulmonaire par le champignon, menant à la formation d'un aspergillome, atteint principalement les sujets immunocompétents[11] porteurs d'une maladie pulmonaire chronique sous-jacente[13]. Les aspergillomes ne sont pas contagieux d'un être humain à l'autre, la contamination se faisant à partir de l'air inhalé.
Les aspergillomes se développent majoritairement sur des cavernes tuberculeuses[14] ; entre 17 et 25 % des patients porteurs de cavernes présentent aussi un aspergillome[14] - [15]. Depuis les années 1980, cette proportion a décru en Europe. En 2010, 15 % des patients présentant un aspergillome au Royaume-Uni avaient un antécédent de tuberculose pulmonaire, contre 93 % des patients coréens[16]. Les autres infections à mycobactéries, plus rares que la tuberculose, sont également pourvoyeuses d'aspergillomes[13].
Si la fréquence des cavernes séquellaires a diminué dans les pays développés à la fin du XXe siècle grâce à une meilleure prise en charge de la tuberculose pulmonaire, certains patients tuberculeux demeurent particulièrement à risque[14] - [17]. Encore au début du XXIe siècle, la tuberculose reste dans le monde le facteur de risque principal des aspergillomes[13], facteur de risque renforcé en cas de déficit immunitaire global ou de destruction du poumon par la maladie[14]. Les aspergillomes après tuberculose sont la principale séquelle de la tuberculose pulmonaire : en 2007[18], 7,7 millions de personnes dans le monde ont souffert d'une tuberculose pulmonaire, et on estime que 372 000 ont développé au moins un aspergillome, principalement en Asie du Sud-Est, dans les régions du Pacifique et en Afrique. Il existe un sous-diagnostic des aspergillomes chez ces patients, alors diagnostiqués à tort comme présentant une tuberculose pulmonaire non bacillifère ou une fibrose pulmonaire[18]. Tout patient ayant eu la tuberculose et présentant des crachats sanglants doit être considéré atteint d'aspergillome[17].
En dehors de la tuberculose, d'autres maladies pulmonaires peuvent entraîner la formation de cavités où un aspergillome peut se développer. Chez les patients séropositifs au VIH, la pneumocystose est, après la tuberculose, le deuxième grand facteur de risque d'aspergillome[19]. Chez les patients immunocompétents, la bronchique chronique, l'emphysème et la dilatation des bronches[16] sont les principaux facteurs de risque en dehors de la tuberculose. La sarcoïdose pulmonaire, une maladie peu fréquente[20], se complique néanmoins d'aspergillome dans environ 6 % des cas[21]. Les interventions majeures de chirurgie thoracique (lobectomie pulmonaire, pneumonectomie ou pariétectomie associée à une résection pulmonaire) sont également un facteur de risque[14] - [22]. Environ 3,6 % des patients opérés d'une lobectomie pulmonaire pour cancer développent un aspergillome plusieurs mois ou plusieurs années après[22].
Physiopathologie
Formation des cavernes tuberculeuses
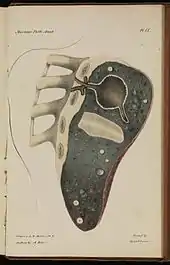
Une caverne est une cavité creusée au sein du parenchyme pulmonaire[23]. Les cavernes sont une complication fréquente de la tuberculose pulmonaire, apparaissant après la primo-infection tuberculeuse[24].
Les bacilles tuberculeux se développent initialement dans le poumon sous forme de nodules, appelés granulomes, qui sont peu à peu entourés de lymphocytes et de macrophages destinés à contenir l'infection[24]. Un granulome peut évoluer soit vers la disparition sans cicatrice, soit vers la caverne, sans que les mécanismes sous-jacents soient compris en totalité[23]. Les vestiges de macrophages détruits occupent le centre du granulome et forment la majeure partie de la nécrose caséeuse[23]. Chez certains patients, cette nécrose se liquéfie et devient un milieu adapté aux bacilles, qui prolifèrent. Des enzymes protéolytiques érodent alors la capsule fibreuse située en périphérie du granulome, et son centre liquide peut alors se vider peu à peu en étant remplacé par de l'air venu des bronches[23]. Lorsqu'une caverne tuberculeuse arrive en communication avec l'arbre bronchique, la dissémination des bacilles dans l'air expiré augmente la contagiosité[24] - [25]. Par ailleurs, la quantité importante de bacilles contenues dans les cavernes favorise le développement de résistances aux anti-tuberculeux[25]. Une fois la nécrose liquéfiée évacuée, la périphérie du granulome persiste autour d'un espace vide sensible aux infections et forme ainsi une caverne.
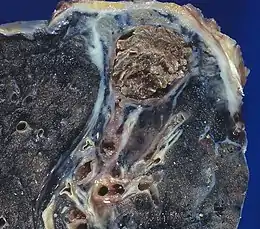
Composition d'un aspergillome
.jpg.webp)
Un aspergillome se présente sous la forme d'une pseudo-tumeur souvent sphérique, appelée « grelot aspergillaire[26] » ou « truffe aspergillaire[27]. » Elle est composée des filaments (mycélium et hyphes) du champignon, pris dans une matrice protéique de polysaccharides[28]. Des structures sporulantes bordent l'aspergillome[11] - [14].
On distingue plusieurs formes cliniques d'aspergillose pulmonaire chronique, qui peuvent se combiner[29] - [30] :
- aspergillome pulmonaire simple, où un aspergillome typique est appendu dans une cavité au sein du poumon, souvent sans signes cliniques, sans évolution radiologique à 3 mois d'écart, et avec parfois une sérologie négative ;
- aspergillome pulmonaire complexe (ou aspergillome cavitaire pulmonaire chronique), où une ou plusieurs cavités sont porteuses d'aspergillome, avec des signes cliniques et une progression radiologique des lésions ;
- fibrose pulmonaire aspergillaire chronique, où au moins deux lobes pulmonaires ont été détruits par un aspergillome complexe ;
- nodule aspergillaire, où l'aspergillome n'est pas développé au sein d'une cavité, mais au milieu de parenchyme sain ;
- aspergillose invasive sub-aiguë, chez les patients immunodéprimés, où une aspergillose invasive évolue sur quelques mois et crée des cavités et des nodules.
Un aspergillome simple est le plus souvent unique, mais des formes multiples ou bilatérales ont été décrites[14]. Si chez les patients immunodéprimés les aspergillomes se développent dans l'ensemble du poumon, chez les patients immunocompétents les aspergillomes sont plus souvent observés au sommet des lobes supérieurs du poumon, ou dans le segment apical des lobes inférieurs[14]. Il existe un continuum évolutif entre les différents types d'aspergillome[31] - [32]. La progression d'un stade à l'autre est favorisée en particulier par l'immunodépression[31], notamment l'infection à VIH mal contrôlée[33].
Mécanisme de formation de l'aspergillome
Les mécanismes sous-tendant la formation des aspergillomes sont encore mal connus[34] et pour certains débattus[35].
L'adhésion des spores à l'épithélium respiratoire, menant à la formation d'un biofilm, est la première étape de la formation d'un aspergillome[36] - [37]. Les spores en contact avec l'épithélium bronchique et les alvéoles pulmonaires produisent des enzymes, de la classe des protéases, qui dégradent les protéines des tissus voisins. L'élastine et le collagène y sont particulièrement sensibles[34] - [38]. Le contact avec les spores entraîne alors une desquamation de l'épithélium et la libération de cytokines pro-inflammatoires[34]. Les interleukines produites localement jouent un rôle dans la formation de l'aspergillome, certaines variations génétiques favorisant l'apparition des aspergillomes complexes[39], ainsi que le profil immunitaire génétique de l'hôte[40] - [35]. La desquamation et l'inflammation qui en résultent diminuent l'efficacité de la barrière épithéliale, facilitant l'infection par Aspergillus[34].
Manifestations cliniques
L'aspergillome est souvent asymptomatique[11] - [31], découvert sur une radiographie thoracique ou par un scan médical réalisé pour d'autres raisons.
L'hémoptysie (saignement d'origine pulmonaire ou bronchique se manifestant par des crachats sanglants) est le signe clinique le plus fréquent de l'aspergillome[11] - [41]. Les hémoptysies concernent 54 à 87 % des patients, et sont massives dans 10 % des cas[14]. Le mécanisme déclencheur de l'érosion des vaisseaux bronchiques est mal connu[14] ; il pourrait être soit mécanique, par frottement de la masse aspergillaire contre la paroi, soit chimique par production locale d'une toxine. Pour certains, la présence d'anastomoses entre les vaisseaux bronchiques et la circulation pulmonaire serait un facteur favorisant[42]. Le risque d'hémoptysie devient significatif à partir d'une cavité mesurant plus de 2 cm de diamètre[43].
Un autre symptôme fréquent est une toux grasse productive[13] - [41]. Les autres symptômes observés (fatigue, toux sèche chronique, perte de poids, fièvre) sont peu spécifiques[31] et peuvent être liés à la maladie pulmonaire sous-jacente sans qu'il soit possible d'incriminer avec certitude l'aspergillome.
La mortalité des patients porteurs d'un aspergillome est de 5 à 6 % par an[31]. Jusqu'à 26 % des patients porteurs d'un aspergillome meurent d'une hémoptysie massive[32].
Examens complémentaires
Identification du germe
L'identification de la souche d'Aspergillus en cause peut être réalisée de diverses manière[29]. La recherche du germe sur des prélèvements de crachats est souvent peu informative, en raison de la grande abondance des spores dans l'air qui contaminent le prélèvement[44]. L'analyse des crachats doit comporter au moins 3 prélèvements distincts[45] afin d'augmenter la probabilité d'identifier le germe. En revanche, son identification sur un prélèvement réalisé en fibroscopie bronchique est beaucoup plus spécifique ; l'examen direct recherche des filaments mycéliens, et la culture recherche la souche même. La culture se réalise sur une gélose de Sabouraud additionnée d'antibiotiques, ou une gélose à l'extrait de malt en incubation à 30 °C[46].
La détection moléculaire par PCR est plus sensible que la culture simple et ne nécessite qu'un seul prélèvement[29] - [45]. La biopsie des lésions, le plus souvent chirurgicale mais aussi par échoendoscopie bronchique (EBUS), démontre la meilleure sensibilité et la meilleure spécificité pour le diagnostic mycologique. Il s'agit cependant d'un examen plus invasif[47] - [48].
Il est possible de rechercher dans les crachats le galactomannane, un sucre complexe produit par le champignon[49]. Son antigène est également parfois détectable dans le sang[46].
Au plan immunologique, l'antigène d'A. fumigatus peut être recherché dans les crachats. La présence dans le sang des anticorps anti Aspergillus, recherchée par une sérologie, est essentielle au diagnostic[29] - [44] - [41]. Elle permet de différencier une infection récente d'une infection ancienne, mais aussi de différencier une simple colonisation bronchique d'une véritable infection[29] - [50]. En cas de doute diagnostic, sa négativité permet d'exclure un aspergillome.
Résistance aux antifongiques
Une fois la souche identifiée en culture, il est recommandé de tester sa sensibilité aux différents traitements anti-fongiques[45]. Il peut exister plusieurs souches différentes chez un même patient, avec des sensibilités différentes aux antifongiques[28].
L'émergence de résistances des Aspergillus aux antifongiques est un phénomène amorcé à la fin des années 1990[51] ; le premier cas publié dans la littérature médicale date de 1997[52]. Aux Pays-Bas, le taux de résistance est passé de 2,5 % en 2000 à 4,9 % en 2002 et 6,6 % en 2004 pour atteindre 10 % en 2009[53]. La répartition géographique des résistances est hétérogène et concerne surtout l'Europe de l'Ouest et la Scandinavie[51]. Les résistances concernent principalement les triazoles[54], qui sont la classe d'antifongiques recommandée en première intention.
Initialement, les résistances n'existaient pas d'emblée et apparaissaient au cours du traitement[54]. Toutefois, depuis 2008, des cas de résistance chez des patients n'ayant jamais reçus d'antifongiques ont été décrits[55], traduisant une diffusion des résistances dans le réservoir sauvage d'Aspergillus fumigatus[56]. Elles sont liées principalement à une mutation dans la protéine ciblée par les triazoles, qui sont les antifongiques les plus prescrits dans les infections aspergillaires. Cette protéine-cible est une enzyme, la lanosterol 14α-déméthylase, codée par le gène cyp51A[54]. Les souches résistantes le sont donc généralement à plusieurs triazoles à la fois[54]. Depuis 2010, d'autres mécanismes de résistance sont également apparus[56].
L'apparition des résistances est préoccupante à plusieurs titres[54]. Peu d'antifongiques sont disponibles, et les résistances limitent les options thérapeutiques. Enfin, les résistances concernent les triazoles, qui sont les seules molécules disponibles par voie orale. Cependant, le risque de diffusion mondiale des résistances est faible[57].
Imagerie
Sur la radiographie pulmonaire, un aspergillome simple apparaît comme un nodule dense, le plus souvent entouré d'un croissant aérique[11]. La radiographie seule ne suffit pas au diagnostic ; un scanner est recommandé[29]. Sur le scanner thoracique, le centre de la cavité est occupé par l'aspergillome[58]. La pseudo-tumeur bouge dans la cavité lorsque le patient change de position (signe de Monod)[58]. Dans l'aspergillome simple, il n'y a pas d'évolution entre les examens et la paroi de la cavité est le plus souvent fine[13]. Un aspergillome complexe[13] présente en revanche l'aspect d'une cavité (ou plusieurs) à parois épaisses, comportant en son centre une truffe aspergillaire. Il existe parfois un début de fibrose pulmonaire[59]. La plèvre adjacente a également un aspect fibrosé, et l'évolution radiologique est lente, mais toujours vers l'aggravation[13]. Un halo en verre dépoli peut également entourer les lésions[45].
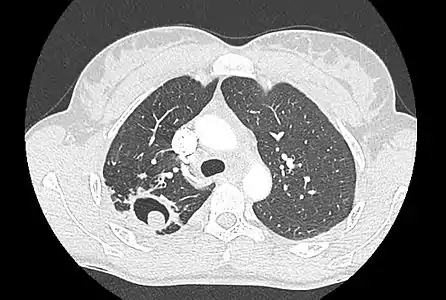 Aspect scannographique typique d'un aspergillome développé dans une caverne tuberculeuse.
Aspect scannographique typique d'un aspergillome développé dans une caverne tuberculeuse.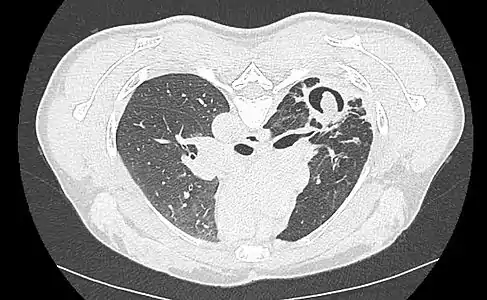 Le changement de position modifie la position du grelot aspergillaire dans la cavité (signe de Monod).
Le changement de position modifie la position du grelot aspergillaire dans la cavité (signe de Monod).
Le diagnostic radiologique seul n'est cependant pas adapté, d'autres lésions pouvant avoir une présentation similaire (cancer pulmonaire excavé[60] - [14] notamment, mais aussi abcès pulmonaire et kyste hydatique[14]). L'injection de produit de contraste iodé, dans le but de mieux visualiser les vaisseaux, permet de dépister un anévrysme de Rasmussen[61], une dilatation pseudo-anévrysmale de l'artère pulmonaire au voisinage d'une cavité intrapulmonaire à risque de rupture, qui entraîne alors une hémoptysie massive souvent fatale[62].
La tomographie par émission de positrons (TEP scanner) n'est pas utile dans le diagnostic d'aspergillome[63], qui présente toujours une hyperfixation et est lui-même un diagnostic différentiel des cancers bronchiques excavés[64].
Démarche diagnostique
Le diagnostic d'aspergillome se fait sur un faisceau d'éléments[29] - [48] : concordance entre l'aspect scanographique et le diagnostic mycologique, après avoir éliminé les autres diagnostics possibles. Si l'aspect radiologique est typique, la sérologie seule suffit à confirmer le diagnostic dans plus de 90 % des cas. En cas de sérologie négative, il faut alors affirmer la présence du champignon par d'autres moyens (culture ou PCR) : analyse des crachats, lavage broncho-alvéolaire, biopsie à l'aiguille... D'autres maladies infectieuses doivent aussi être écartées, notamment l'histoplasmose et la coccidioïdomycose, ainsi qu'une tuberculose pulmonaire évolutive. La découverte, au cours du bilan, d'une infection conjointe par une bactérie, telles que Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus et Pseudomonas aeruginosa, et les germes anaérobies n'exclut pas le diagnostic d'aspergillome.
L'aspergillome étant une infection localisée, il n'y a pas de réponse globale du système immunitaire. Il n'existe donc pas de syndrome inflammatoire ni d'élévation des globules blancs[65].
Traitement
Diverses sociétés savantes ont émis des recommandations sur la prise en charge[29] - [32] - [45] - [66], sans toujours un consensus franc entre elles. La prise en charge des aspergillomes est rendue complexe par le terrain affaibli des patients, et notamment une insuffisance respiratoire préexistante séquellaire de tuberculose ou de bronchite chronique[13]. L'approche est pluridisciplinaire et implique tant les spécialistes des maladies infectieuses que les chirurgiens thoraciques et les pneumologues.
Traitement antifongique
L'itraconazole, de la classe des triazoles, est recommandé en première intention[67]. En cas d'intolérance, de non-réponse au traitement ou de résistance du germe, le voriconazole (aussi de la classe des triazoles)[68] puis le posaconazole peut être proposé en alternative[15]. Une attention particulière doit être prêtée aux interactions médicamenteuses causées par les triazoles, qui modifient l'activité d'autres médicaments par leur rôle d'inhibiteurs enzymatiques[69].
L'administration de triazoles par voie orale permet de stabiliser les lésions et diminue le risque d'hémoptysie massive, avec habituellement peu d'effets indésirables[67] - [70]. La réponse au traitement est lente, imposant un traitement de 4 à 6 mois, voire 9 mois[15] - [29]. Chez les patients répondant bien au traitement après cette durée, et qui ne sont pas éligibles à une chirurgie, le traitement peut être prolongé de plusieurs mois[70], voire plusieurs années[67]. Les patients uniquement stabilisés peuvent bénéficier d'un traitement au long cours, l'arrêt du traitement entraînant parfois une aggravation des symptômes[67] - [29].
Le traitement intraveineux est habituellement réservé aux patients présentant des formes rapidement évolutives ou en cas d'échec des triazoles (résistance ou mauvaise tolérance)[29]. L'amphotéricine B[71], la micafungine[72] et la caspofungine[73], qui sont des alternatives aux triazoles, ne sont en effet disponibles que par voie injectable. Il est également possible de réaliser un traitement d'induction intraveineux, puis de continuer par des triazoles oraux[29]. Le traitement par amphotéricine B, même court, doit s'accompagner d'une surveillance étroite de la fonction rénale[29].
En cas d'échec du traitement initial par antifongiques, une autre maladie évolutive doit être recherchée, en premier lieu une récidive de tuberculose[35]. Les traitements antituberculeux pouvant induire une résistance aux azolés, celle-ci doit également être éliminée[35].
L'encadrement du geste chirurgical par un traitement antifongique est débattu[74]. Il ne semble pas y avoir de gain de survie ou de diminution des récidives[74] - [75] - [76]. Toutefois, chez les patients immunodéprimés, le traitement antifongique postopératoire est recommandé[74] - [29], ainsi que pour les patients chez qui la résection chirurgicale est incomplète[29]. Il n'y a pas de durée de traitement recommandée : elle doit être étudiée au cas par cas[29]. Certains[48] préconisent six mois de traitement total minimum.
Indications chirurgicales
La chirurgie est un des traitements curatifs de l'aspergillome[77] - [78] - [79]. Elle vise à retirer l'ensemble des lésions d'aspergillome et peut donc varier, en étendue, de la simple résection de nodule (pour les aspergillomes simples) à la lobectomie ou la pneumonectomie pour les aspergillomes complexes[80].
Pour les aspergilloses simples, la chirurgie est recommandée en première intention[66] - [29] en raison du faible taux de complications et de la guérison qui s'ensuit[81]. Lorsque la fonction pulmonaire le permet, la chirurgie est alors le traitement de référence[82]. Toutefois, pour certains[48], un aspergillome simple non symptomatique doit être simplement surveillé sans faire l'objet d'un traitement, ni antifongique ni chirurgical. Pour les aspergillomes complexes, la prise en charge chirurgicale est indiquée principalement en cas d'hémoptysie[77] - [66], et un traitement antifongique à vie lui est autant que possible préféré[66]. Les gestes chirurgicaux sur les aspergillomes complexes sont en effet difficiles et risqués[66] - [78] - [79], avec un taux de récidive pouvant atteindre 25 %[82]. La réussite du geste, définie par une absence de récidive, est en effet conditionnée par la possibilité d'une résection complète, sans ouverture de l'aspergillome qui ensemence la cavité, ainsi que par la capacité du poumon à réoccuper l'ensemble de la cavité pleurale, sans décollement résiduel[29] - [83].
Les résections pulmonaires majeures, en particulier les pneumonectomies, ont un taux de complication plus élevé que pour un cancer, lorsqu'elles sont réalisées pour des causes infectieuses[84]. Le taux de complications des résections pulmonaires pour aspergillome est plus élevé chez les patients présentant des cavernes tuberculeuses que chez patients simplement immunodéprimés[77]. Les complications postopératoires atteignent quasi exclusivement les patients symptomatiques[81]. Au premier rang des complications chirurgicales[82] des aspergillomes complexes, on trouve le saignement, le bullage prolongé, la fistule bronchopleurale, et l'infection par Aspergillus de la cavité résiduelle. Le mauvais état général préopératoire des patients est un des facteurs de risque de complications. Une prise en charge globale préopératoire est donc recommandée, avec un traitement de la dénutrition[29], un sevrage alcoolo-tabagique et une stabilisation des autres maladies sous-jacentes, notamment le diabète[48]. Un traitement antifongique préopératoire est également recommandé[48].
Lorsqu'une résection pulmonaire est considérée comme trop risquée au vu de l'état général, ou contre-indiquée par une insuffisance respiratoire, une simple mise à la peau de la cavité abcédée peut être réalisée[85] - [81], suivie au besoin d'une thoracoplastie[86] dont le rôle est d'affaisser la cavité résiduelle.
Autres traitements
En cas d'hémoptysie massive sur un aspergillome complexe, une embolisation des artères bronchiques peut être réalisée[66] - [87]. Le résultat est cependant moins bon que pour les autres causes d'hémoptysie[88] en raison de l'hypervascularisation des aspergillomes complexes. L'embolisation est donc considérée comme une mesure d'attente avant une chirurgie à réaliser hors du contexte de l'urgence vitale, ou un traitement par antifongiques adaptés en cas de contre-indication chirurgicale définitive[89] - [66].
L'administration directe d'antifongiques dans la cavité de l'aspergillome (amphotéricine B le plus souvent[90] - [91]) est une technique aux résultats hétérogènes[31]. En 2009, elle est principalement utilisée dans le traitement des hémoptysies massives chez les patients non opérables[31] et, selon une étude publiée en 2013, son bénéfice à long terme est inconnu[91].
Particularités en cas d'immunodépression
Chez un patient sous immunosuppresseurs, il est recommandé de diminuer, autant que possible, l'intensité de l'immunosuppression dès la suspicion du diagnostic afin de diminuer la vitesse de progression[29].
Pronostic et suivi
Les facteurs pronostics principaux retrouvés historiquement[32] comprennent la sévérité de la maladie pulmonaire sous-jacente, l'aggravation rapide radiologique ou biologique[92], l'immunodépression et la co-existence d'une sarcoïdose[93] ou d'une infection à VIH[33].
La bonne réponse au traitement est définie par une régression des lésions observées radiologiquement[43]. La corrélation entre la qualité de la réponse initiale et le pronostic à long terme n'a pas été étudiée[35]. On observe la première année une amélioration clinique et radiologique chez environ 50 % des patients[35].
Le but du suivi est de s'assurer de l'absence de progression des lésions aspergillaires complexes[29]. Il est recommandé de réaliser un scanner de contrôle 3 à 6 mois après le début du traitement[29] - [15] - [94]. La réalisation d'un scanner low dose[95], moins irradiant, est recommandée[96]. Le résultat à long terme de la chirurgie dépend principalement de l'état général des patients[81].
La mortalité à long terme (plus de 10 ans après le diagnostic) est comprise entre 37 et 67 % selon les séries[35]. Les facteurs de risque de mortalité sont[97] un âge avancé, un traitement par corticoïdes, une maigreur (IMC < 18,5) et un syndrome inflammatoire au moment du diagnostic. La destruction du tissu pulmonaire et l'insuffisance respiratoire sont également des facteurs de mauvais pronostic[32] - [35].
Notes et références
- (la) Pier Antonio Micheli, Nova plantarum genera, Florence, (lire en ligne), p. 212
- (en) John Hughes Bennett, « XVII. On the Parasitic Vegetable Structures found growing in Living Animals », Transactions of the Royal Society of Edinburgh, Cambridge University Press (CUP), vol. 15, no 02, , p. 277-294 (ISSN 0080-4568, DOI 10.1017/s0080456800029963, lire en ligne).
- (en) K. F. W. Hinson, A. J. Moon, et N. S. Plummer, « Broncho-pulmonary Aspergillosis : Review and a Report of Eight New Cases », Thorax, BMJ, vol. 4, no 7, , p. 317-333 (PMID 13015523, lire en ligne).
- (la) Theodor Sluyter, « De vegetabilibus organismi animalis parasitis, ac de novo epiphyto in pityriasi versicolore obvio », Diss Inaug Berlin, Berolini, , p. 25
- (de) Friedrich Küchenmeister, Die in und an dem Körper des lebenden Menschen vorkommenden Parasiten, Leipzig, B.G. Teubner, (lire en ligne).
- (de) N. Friedreich, « Fall von Pneumonomycosis aspergillina », Virchows Archiv, vol. 10, no 4, , p. 510-512 (ISSN 0945-6317, lire en ligne, consulté le )
- (de) Paul Fürbringer, « Beobachtungen über Lungenmycose beim Menschen », Virchows Archiv, vol. 66, no 3, , p. 330-365 (ISSN 0945-6317, lire en ligne, consulté le )
- F. Dévé, « Une nouvelle forme anatomo-radiologique de mycose pulmonaire primitive: le mégamycétome intra bronchiectatique », Arch Med Chir Appar Resp, no 13, , p. 337-361, cité par Denning et coll.
- (en) Victor A. Kelmenson, « Treatment of Pulmonary Aspergillosis », CHEST Journal, Elsevier BV, vol. 36, no 4, , p. 442 (ISSN 0012-3692, DOI 10.1378/chest.36.4.442, lire en ligne).
- (en) R. C. Daly, P. C. Pairolero, J. M. Piehler, V. F. Trastek, W. S. Payne et P. E. Bernatz, « Pulmonary aspergilloma. Results of surgical treatment », The Journal of Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 92, no 6, , p. 981-988 (ISSN 0022-5223, PMID 3097424, lire en ligne).
- Latgé et coll 2002.
- « Aspergillose », sur Institut Pasteur, (consulté le ).
- Kosmidis et coll 2014.
- Passera et coll 2013.
- (en) Timothy W. Felton, Caroline Baxter, Caroline Moore, Stephen. Roberts, William Hope et David Denning, « Efficacy and Safety of Posaconazole for Chronic Pulmonary Aspergillosis », Clinical Infectious Diseases, Oxford University Press (OUP), vol. 51, no 12, , p. 1383-1391 (ISSN 1058-4838, DOI 10.1086/657306, lire en ligne).
- (en) N. L. Smith et D. W. Denning, « Underlying conditions in chronic pulmonary aspergillosis including simple aspergilloma », European Respiratory Journal, European Respiratory Society (ERS), vol. 37, no 4, , p. 865-872 (ISSN 0903-1936, DOI 10.1183/09031936.00054810, lire en ligne).
- R. G. Bopaka, W. El Khattabi, M. Choubi, B. El Bied, A. Aichane et H. Afif, « Aspergillomes pulmonaires », Revue des Maladies Respiratoires, Elsevier BV, vol. 32, , A159 (ISSN 0761-8425, DOI 10.1016/j.rmr.2014.10.136, lire en ligne).
- (en) David Denning, Alex Pleuvry et Donald Cole, « Global burden of chronic pulmonary aspergillosis as a sequel to pulmonary tuberculosis », Bulletin of the World Health Organization, WHO Press, vol. 89, no 12, , p. 864-872 (ISSN 0042-9686, DOI 10.2471/blt.11.089441, lire en ligne).
- (en) Alissa K. Greenberg, Jocelyn Knapp, William N. Rom et Doreen J. Addrizzo-Harris, « Clinical Presentation of Pulmonary Mycetoma in HIV-Infected Patients », Chest, Elsevier BV, vol. 122, no 3, , p. 886-892 (ISSN 0012-3692, DOI 10.1378/chest.122.3.886, lire en ligne).
- (en) Sandrine Hours, Hilario Nunes, Marianne Kambouchner, Yurdagül Uzunhan, Michel W. Brauner, Dominique Valeyre et Pierre-Yves Brillet, « Pulmonary Cavitary Sarcoidosis », Medicine, Ovid Technologies (Wolters Kluwer Health), vol. 87, no 3, , p. 142-151 (ISSN 0025-7974, DOI 10.1097/md.0b013e3181775a73, lire en ligne).
- (en) David W. Denning, Alex Pleuvry et Donald C. Cole, « Global burden of chronic pulmonary aspergillosis complicating sarcoidosis », Eur Respir J, European Respiratory Society (ERS), vol. 41, no 3, , p. 621-626 (ISSN 0903-1936, DOI 10.1183/09031936.00226911, lire en ligne).
- (en) Atsuhisa Tamura, Junko Suzuki, Takeshi Fukami, Hirotoshi Matsui, Shinobu Akagawa, Ken Ohta, Akira Hebisawa et Fumiaki Takahashi, « Chronic pulmonary aspergillosis as a sequel to lobectomy for lung cancer », Interact CardioVasc Thorac Surg, Oxford University Press (OUP), vol. 21, no 5, , p. 650-656 (ISSN 1569-9293, DOI 10.1093/icvts/ivv239, lire en ligne).
- (en) Keertan Dheda, Helen Booth, Jim F. Huggett, Margaret A. Johnson, Alimuddin Zumla et Graham W. Rook, « Lung Remodeling in Pulmonary Tuberculosis », The Journal of Infectious Diseases, Oxford University Press (OUP), vol. 192, no 7, , p. 1201-1209 (ISSN 0022-1899, DOI 10.1086/444545, lire en ligne).
- (en) Catherine W. M. Ong, Paul T. Elkington et Jon S. Friedland, « Tuberculosis, Pulmonary Cavitation, and Matrix Metalloproteinases », Am J Respir Crit Care Med, American Thoracic Society, vol. 190, no 1, , p. 9-18 (ISSN 1073-449X, DOI 10.1164/rccm.201311-2106pp, lire en ligne).
- (en) Waseem Saeed, « Cavitating pulmonary tuberculosis: a global challenge », Clinical Medicine, Royal College of Physicians, vol. 12, no 1, , p. 40-41 (ISSN 1470-2118, DOI 10.7861/clinmedicine.12-1-40, lire en ligne).
- Joëlson Lovaniaina Rakotoson, Notahiana Razafindramaro, Jocelyn Robert Rakotomizao, Hanta Marie Danielle Vololontiana, Radonirina Lazasoa Andrianasolo, Kiady Ravahatra, Michel Tiaray, Jobeline Rajaoarifetra, Hendriniaina Rakotoharivelo et Ange Christophe Félix Andrianarisoa, « Les aspergillomes pulmonaires: à propos de 37 cas à Madagascar », The Pan African Medical Journal, vol. 10, no 4, (ISSN 1937-8688, DOI 10.11604/pamj.2011.10.4.936, lire en ligne).
- G. Massard, « Place de la chirurgie dans le traitement des aspergilloses thoraciques », Revue des Maladies Respiratoires, Elsevier-Masson, vol. 22, no 3, , p. 466-472 (lire en ligne).
- (en) S. J. Howard, A. C. Pasqualotto, M. J. Anderson, H. Leatherbarrow, A. M. Albarrag, E. Harrison, L. Gregson, P. Bowyer et D. W. Denning, « Major variations in Aspergillus fumigatus arising within aspergillomas in chronic pulmonary aspergillosis », Mycoses, Wiley-Blackwell, vol. 56, no 4, , p. 434-441 (ISSN 0933-7407, DOI 10.1111/myc.12047, lire en ligne).
- Denning et coll 2015.
- M. Marcq, P. Germaud, L. Cellerin, C. Sagan et E. Chailleux, « Aspergilloses respiratoires complexes : difficultés diagnostiques et thérapeutiques », Revue des Maladies Respiratoires, vol. 21, no 6, , p. 1162-1166 (ISSN 0761-8425, lire en ligne, consulté le ).
- (en) Brent P. Riscili et Karen L. Wood, « Noninvasive Pulmonary Aspergillus Infections », Clinics in Chest Medicine, Elsevier BV, vol. 30, no 2, , p. 315-335 (ISSN 0272-5231, DOI 10.1016/j.ccm.2009.02.008, lire en ligne).
- Stevens et coll 2000.
- (en) Doreen J. Addrizzo-Harris, Timothy J. Harkin, Georgeann McGuinness, David P. Naidich et William N. Rom, « Pulmonary Aspergilloma and AIDS », Chest, Elsevier BV, vol. 111, no 3, , p. 612-618 (ISSN 0012-3692, DOI 10.1378/chest.111.3.612, lire en ligne).
- (en) Elena Svirshchevskaya, Dmitrii Zubkov, Isabelle Mouyna et Nadia Berkova, « Innate Immunity and the Role of Epithelial Barrier During Aspergillus fumigatus Infection », Current Immunology Reviews, Bentham Science Publishers Ltd., vol. 8, no 3, , p. 254-261 (ISSN 1573-3955, DOI 10.2174/157339512800671985, lire en ligne).
- (en) K. E. Schweer, C. Bangard, K. Hekmat et O. A. Cornel, « Chronic pulmonary aspergillosis », Mycoses, Wiley-Blackwell, vol. 57, no 5, , p. 257-270 (ISSN 0933-7407, DOI 10.1111/myc.12152, lire en ligne).
- (en) Savneet Kaur et Shweta Singh, « Biofilm formation by Aspergillus fumigatus », Med Mycol, Oxford University Press (OUP), , p. 1-8 (ISSN 1369-3786, DOI 10.3109/13693786.2013.819592, lire en ligne).
- (en) Carys A. Croft, Luka Culibrk, Margo M. Moore et Scott J. Tebbutt, « Interactions of Aspergillus fumigatus Conidia with Airway Epithelial Cells: A Critical Review », Front. Microbiol., Frontiers Media SA, vol. 7, (ISSN 1664-302X, DOI 10.13039/501100000038, lire en ligne).
- (en) M. Monod, K. Jaton-Ogay et U. Reichard, « Aspergillus fumigatus-Secreted Proteases As Antigenic Molecules and Virulence Factors », Aspergillus fumigatus, S. Karger AG, , p. 182-192 (ISBN 3-8055-6714-6, DOI 10.1159/000060294, lire en ligne).
- (en) N. L. D. Smith, J. Hankinson, A. Simpson, P. Bowyer et D. W. Denning, « A prominent role for the IL1 pathway and IL15 in susceptibility to chronic cavitary pulmonary aspergillosis », Clinical Microbiology and Infection, Elsevier BV, vol. 20, no 8, , O480-O488 (ISSN 1198-743X, DOI 10.13039/501100000272, lire en ligne).
- (en) Mudit Vaid, Savneet Kaur, Helen Sambatakou, Taruna Madan, David W. Denning et P. Usha Sarma, « Distinct alleles of mannose-binding lectin (MBL) and surfactant proteins A (SP-A) in patients with chronic cavitary pulmonary aspergillosis and allergic bronchopulmonary aspergillosis », Clinical Chemical Laboratory Medicine, Walter de Gruyter GmbH, vol. 45, no 2, (ISSN 1434-6621, DOI 10.1515/cclm.2007.033, lire en ligne).
- F. Mahboub, H. Jabri, W. Elkhattabi, H. Moubachir et H. Afif, « Sérologie aspergillaire et diagnostic des aspergillomes pulmonaires », Revue des Maladies Respiratoires, Elsevier BV, vol. 33, , A231-A232 (ISSN 0761-8425, DOI 10.1016/j.rmr.2015.10.506, lire en ligne).
- (en) Rajeev Shah, Pradeep Vaideeswar et Shobhana P Pandit, « Pathology of pulmonary aspergillomas », Indian Journal of Pathology and Microbiology, Medknow, vol. 51, no 3, , p. 342 (ISSN 0377-4929, DOI 10.4103/0377-4929.42507, lire en ligne).
- (en) Jung-Kyu Lee, Yeon Joo Lee, Sung Soo Park, Jong Sun Park, Young-Jae Cho, Young Sik Park, Ho Il Yoon, Choon-Taek Lee et Jae Ho Lee, « Clinical course and prognostic factors of pulmonary aspergilloma », Respirology, Wiley-Blackwell, vol. 19, no 7, , p. 1066-1072 (ISSN 1323-7799, DOI 10.1111/resp.12344, lire en ligne).
- (en) M. L. Uffredi, G. Mangiapan, J. Cadranel et G. Kac, « Significance of Aspergillus fumigatus Isolation from Respiratory Specimens of Nongranulocytopenic Patients », European Journal of Clinical Microbiology & Infectious Diseases, Springer Science + Business Media, vol. 22, no 8, , p. 457-462 (ISSN 0934-9723, DOI 10.1007/s10096-003-0970-y, lire en ligne).
- (en) Silke Schelenz, Rosemary A Barnes, Richard C Barton, Joanne R Cleverley, Sebastian B Lucas, Christopher C Kibbler et David W Denning, « British Society for Medical Mycology best practice recommendations for the diagnosis of serious fungal diseases », The Lancet Infectious Diseases, Elsevier BV, vol. 15, no 4, , p. 461-474 (ISSN 1473-3099, DOI 10.1016/s1473-3099(15)70006-x, lire en ligne).
- « Aspergillus : diagnostic biologique », sur MemoBio (consulté le ).
- (en) Young Rak Choi, Jin Young An, Mi Kyeong Kim, Hye-Suk Han, Ki Hyeong Lee, Si-Wook Kim, Ki Man Lee et Kang Hyeon Choe, « The diagnostic efficacy and safety of endobronchial ultrasound-guided transbronchial needle aspiration as an initial diagnostic tool », Korean J Intern Med, Korean Association of Internal Medicine, vol. 28, no 6, , p. 660 (ISSN 1226-3303, DOI 10.3904/kjim.2013.28.6.660, lire en ligne).
- Godet et coll 2014.
- (en) Yuta Kono, Kenji Tsushima, Koichi Yamaguchi, Nao Kurita, Seiko Soeda, Akahito Fujiwara, Shinya Sugiyama, Yuki Togashi, Satoshi Kasagi, Masako To, Yasuo To et Yasuhiro Setoguchi, « The utility of galactomannan antigen in the bronchial washing and serum for diagnosing pulmonary aspergillosis », Respiratory Medicine, Elsevier BV, vol. 107, no 7, , p. 1094-1100 (ISSN 0954-6111, DOI 10.1016/j.rmed.2013.04.007, lire en ligne).
- (en) C.G. Baxter, D.W. Denning, A.M. Jones, A. Todd, C.B. Moore et M.D. Richardson, « Performance of two Aspergillus IgG EIA assays compared with the precipitin test in chronic and allergic aspergillosis », Clinical Microbiology and Infection, Elsevier BV, vol. 19, no 4, , E197-E204 (ISSN 1198-743X, DOI 10.1111/1469-0691.12133, lire en ligne).
- (en) A Mayr et C Lass-Flörl, « Epidemiology and antifungal resistance in invasive aspergillosis according to primary disease - review of the literature », Eur J Med Res, Springer Nature, vol. 16, no 4, , p. 153 (ISSN 2047-783X, DOI 10.1186/2047-783x-16-4-153, lire en ligne).
- (en) D. Denning, « Correlation between in-vitro susceptibility testing to itraconazole and in-vivo outcome of Aspergillus fumigatus infection », Journal of Antimicrobial Chemotherapy, Oxford University Press (OUP), vol. 40, no 3, , p. 401-414 (ISSN 1460-2091, DOI 10.1093/jac/40.3.401, lire en ligne).
- (en) Paul E. Verweij, Susan J. Howard, Willem J.G. Melchers et David W. Denning, « Azole-resistance in Aspergillus: Proposed nomenclature and breakpoints », Drug Resistance Updates, Elsevier BV, vol. 12, no 6, , p. 141-147 (ISSN 1368-7646, DOI 10.1016/j.drup.2009.09.002, lire en ligne).
- (en) Susan J. Howard, Dasa Cerar, Michael J. Anderson, Ahmed Albarrag, Matthew C. Fisher, Alessandro C. Pasqualotto, Michel Laverdiere, Maiken C. Arendrup, David S. Perlin et David W. Denning, « Frequency and Evolution of Azole Resistance in Aspergillus fumigatus Associated with Treatment Failure1 », Emerg. Infect. Dis., Centers for Disease Control and Prevention (CDC), vol. 15, no 7, , p. 1068-1076 (ISSN 1080-6040, DOI 10.3201/eid1507.090043, lire en ligne).
- (en) Eveline Snelders, Henrich A. L van der Lee, Judith Kuijpers, Anthonius J. M. M Rijs, János Varga, Robert A Samson, Emilia Mellado, A. Rogier T Donders, Willem J. G Melchers et Paul E Verweij, « Emergence of Azole Resistance in Aspergillus fumigatus and Spread of a Single Resistance Mechanism », PLoS Med, Public Library of Science (PLoS), vol. 5, no 11, , e219 (ISSN 1549-1676, DOI 10.1371/journal.pmed.0050219, lire en ligne).
- (en) Anuradha Chowdhary, Cheshta Sharma, Ferry Hagen et Jacques F Meis, « Exploring azole antifungal drug resistance in Aspergillus fumigatus with special reference to resistance mechanisms », Future Microbiology, Future Medicine Ltd, vol. 9, no 5, , p. 697-711 (ISSN 1746-0913, DOI 10.2217/fmb.14.27, lire en ligne).
- (en) Sarah P. Georgiadou et Dimitrios P. Kontoyiannis, « The impact of azole resistance on aspergillosis guidelines », Annals of the New York Academy of Sciences, Wiley-Blackwell, vol. 1272, no 1, , p. 15-22 (ISSN 0077-8923, DOI 10.1111/j.1749-6632.2012.06795.x, lire en ligne).
- (en) S. Sharma, S. K. Dubey, N. Kumar et D. Sundriyal, « 'Monod' and 'air crescent' sign in aspergilloma », Case Reports, BMJ, vol. 2013, no sep13 1, , bcr2013200936-bcr2013200936 (ISSN 1757-790X, DOI 10.1136/bcr-2013-200936, lire en ligne).
- (en) Karen C Patterson et Mary E Strek, « Diagnosis and Treatment of Pulmonary Aspergillosis Syndromes », Chest, Elsevier BV, vol. 146, no 5, , p. 1358-1368 (ISSN 0012-3692, DOI 10.1378/chest.14-0917, lire en ligne).
- (en) Lan-Fu Wang, Hsi Chu, Yuh-Min Chen et Reury-Perng Perng, « Adenocarcinoma of the Lung Presenting as a Mycetoma With an Air Crescent Sign », Chest, Elsevier BV, vol. 131, no 4, , p. 1239-1242 (ISSN 0012-3692, DOI 10.1378/chest.06-1551, lire en ligne).
- (en) Kshitij Chatterjee, Brendon Colaco, Clinton Colaco, Michael Hellman et Nikhil Meena, « Rasmussen's aneurysm: A forgotten scourge », Respiratory Medicine Case Reports, Elsevier BV, vol. 16, , p. 74-76 (ISSN 2213-0071, DOI 10.1016/j.rmcr.2015.08.003, lire en ligne).
- (en) Madiha Syed et Jill Irby, « Airway management of ruptured pulmonary artery "Rasmussen" aneurysm and massive hemoptysis », BMC Research Notes, Springer Science + Business Media, vol. 8, no 1, (ISSN 1756-0500, DOI 10.1186/s13104-015-1313-7, lire en ligne).
- (en) Caroline G. Baxter, Paul Bishop, Su Enn Low, Kweku Baiden-Amissah et David W. Denning, « Pulmonary aspergillosis: an alternative diagnosis to lung cancer after positive [18F]FDG positron emission tomography », Thorax, BMJ, vol. 66, no 7, , p. 638-640 (ISSN 0040-6376, DOI 10.1136/thx.2010.155515, lire en ligne).
- (en) Fernando F. Gazzoni1, Luiz Carlos Severo, Edson Marchiori, Klaus L. Irion, Marcos D. Guimarães, Myrna C. Godoy, Ana P. G. Sartori et Bruno Hochhegger, « Fungal diseases mimicking primary lung cancer: radiologic-pathologic correlation », Mycoses, Wiley-Blackwell, vol. 57, no 4, , p. 197-208 (ISSN 0933-7407, DOI 10.1111/myc.12150, lire en ligne).
- (en) Adilia Warris, « The biology of pulmonary aspergillus infections », Journal of Infection, Elsevier BV, vol. 69, , S36-S41 (ISSN 0163-4453, DOI 10.1016/j.jinf.2014.07.011, lire en ligne).
- Walsh et coll 2008.
- (en) Ritesh Agarwal, Gella Vishwanath, Ashutosh N. Aggarwal, Mandeep Garg, Dheeraj Gupta et Arunaloke Chakrabarti, « Itraconazole in chronic cavitary pulmonary aspergillosis: a randomised controlled trial and systematic review of literature », Mycoses, Wiley-Blackwell, vol. 56, no 5, , p. 559-570 (ISSN 0933-7407, DOI 10.1111/myc.12075, lire en ligne).
- (en) G. Cucchetto, A. Cazzadori, M. Conti, G. L. Cascio, P. Braggio et E. Concia, « Treatment of chronic pulmonary aspergillosis with voriconazole: review of a case series », Infection, Springer Science + Business Media, vol. 43, no 3, , p. 277-286 (ISSN 0300-8126, DOI 10.1007/s15010-014-0711-4, lire en ligne).
- (en) R. M. Tucker, D. W. Denning, L. H. Hanson, M. G. Rinaldi, J. R. Graybill, P. K. Sharkey, D. Pappagianis et D. A. Stevens, « Interaction of Azoles with Rifampin, Phenytoin, and Carbamazepine: In Vitro and Clinical Observations », Clinical Infectious Diseases, Oxford University Press (OUP), vol. 14, no 1, , p. 165-174 (ISSN 1058-4838, DOI 10.1093/clinids/14.1.165, lire en ligne).
- (en) Juliette Camuset, Hilario Nunes, Marie-Christine Dombret, Anne Bergeron, Priscilla Henno, Bruno Philippe, Gaelle Dauriat, Gilles Mangiapan, Antoine Rabbat et Jacques Cadranel, « Treatment of Chronic Pulmonary Aspergillosis by Voriconazole in Nonimmunocompromised Patients », Chest, Elsevier BV, vol. 131, no 5, , p. 1435-1441 (ISSN 0012-3692, DOI 10.1378/chest.06-2441, lire en ligne).
- (en) Hae-Seong Nam, Kyeongman Jeon, Sang-Won Um, Gee Young Suh, Man Pyo Chung, Hojoong Kim, O. Jung Kwon et Won-Jung Koh, « Clinical characteristics and treatment outcomes of chronic necrotizing pulmonary aspergillosis: a review of 43 cases », International Journal of Infectious Diseases, Elsevier BV, vol. 14, no 6, , e479-e482 (ISSN 1201-9712, DOI 10.1016/j.ijid.2009.07.011, lire en ligne).
- (en) Shigeru Kohno, Koichi Izumikawa, Kenji Ogawa, Atsuyuki Kurashima, Niro Okimoto, Ryoichi Amitani, Hiroshi Kakeya, Yoshihito Niki et Yoshitsugu Miyazaki, « Intravenous micafungin versus voriconazole for chronic pulmonary aspergillosis: A multicenter trial in Japan », Journal of Infection, Elsevier BV, vol. 61, no 5, , p. 410-418 (ISSN 0163-4453, DOI 10.1016/j.jinf.2010.08.005, lire en ligne).
- (en) G. J. Keir, B. Garfield, D. M. Hansell, M. R. Loebinger, R. Wilson, E. A. Renzoni, A. U. Wells et T. M. Maher, « Cyclical caspofungin for chronic pulmonary aspergillosis in sarcoidosis », Thorax, BMJ, vol. 69, no 3, , p. 287-288 (ISSN 0040-6376, DOI 10.1136/thoraxjnl-2013-203988, lire en ligne).
- (en) Lotfi Benhamed et Didier Woelffle, « Adjuvant antifungal therapy after pulmonary surgery for aspergilloma: is it useful? », Interact CardioVasc Thorac Surg, Oxford University Press (OUP), vol. 18, no 6, , p. 835-837 (ISSN 1569-9293, DOI 10.1093/icvts/ivu069, lire en ligne).
- (en) Dariusz Sagan et Kazimierz Gozdziuk, « Surgery for Pulmonary Aspergilloma in Immunocompetent Patients: No Benefit From Adjuvant Antifungal Pharmacotherapy », The Annals of Thoracic Surgery, Elsevier BV, vol. 89, no 5, , p. 1603-1610 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2010.02.037, lire en ligne).
- P.-B. Pagès, R. Grima, P. Mordant, B. Grand, A. Badia, F. Le Pimpec-Barthes, A. Bernard et M. Riquet, « Un traitement antifongique périopératoire influence-t-il la morbidité postopératoire et la survie à long terme après une résection pulmonaire pour aspergillome ? », Revue de Pneumologie Clinique, Elsevier BV, vol. 70, no 6, , p. 322-328 (ISSN 0761-8417, DOI 10.1016/j.pneumo.2014.08.002, lire en ligne).
- (en) K. Al-Kattan, M. Ashour, W. Hajjar, M. Salah El Din, M. Fouda et A. Al Bakry, « Surgery for pulmonary aspergilloma in post-tuberculous vs. immuno-compromised patients », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 20, no 4, , p. 728-733 (ISSN 1010-7940, DOI 10.1016/s1010-7940(01)00837-5, lire en ligne).
- G. Massard, « Place de la chirurgie dans le traitement des aspergillomes », Revue des Maladies Respiratoires, vol. 22, no 3, , p. 466-472 (ISSN 0761-8425, lire en ligne, consulté le )
- Mohamed Caidi, Hassane Kabiri, Said Al Aziz, Abderrahman El Maslout et Abdellatif Benosman, « Chirurgie des aspergillomes pulmonaires », La Presse Médicale, Elsevier BV, vol. 35, no 12, , p. 1819-1824 (ISSN 0755-4982, DOI 10.1016/s0755-4982(06)74907-7, lire en ligne).
- (en) Yuji Shiraishi, Naoya Katsuragi, Yutsuki Nakajima, Masahiro Hashizume, Nobumasa Takahashi et Yoshikazu Miyasaka, « Pneumonectomy for complex aspergilloma: is it still dangerous? », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 29, no 1, , p. 9-13 (ISSN 1010-7940, DOI 10.1016/j.ejcts.2005.10.043, lire en ligne).
- (en) Jean-François Regnard, Philippe Icard, Maurizio Nicolosi, Lorenzo Spagiarri, Pierre Magdeleinat, Bertrand Jauffret et Philippe Levasseur, « Aspergilloma: a series of 89 surgical cases », The Annals of Thoracic Surgery, Elsevier BV, vol. 69, no 3, , p. 898-903 (ISSN 0003-4975, DOI 10.1016/s0003-4975(99)01334-x, lire en ligne).
- (en) Shakil Farid, Shaza Mohamed, Mohan Devbhandari, Matthew Kneale, Malcolm Richardson, Sing Y Soon, Mark T Jones, Piotr Krysiak, Rajesh Shah, David W Denning et Kandadai Rammohan, « Results of surgery for chronic pulmonary Aspergillosis, optimal antifungal therapy and proposed high risk factors for recurrence - a National Centre’s experience », J Cardiothorac Surg, Springer Nature, vol. 8, no 1, , p. 180 (ISSN 1749-8090, DOI 10.1186/1749-8090-8-180, lire en ligne).
- (en) Alaa Brik, Abdel Meged Salem, Al Rady Kamal, Mohamed Abdel-Sadek, Mohamed Essa, Mamdoh El Sharawy, Ahmed Deebes et Khaled Abdel Bary, « Surgical outcome of pulmonary aspergilloma », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 34, no 4, , p. 882-885 (ISSN 1010-7940, DOI 10.1016/j.ejcts.2008.06.049, lire en ligne).
- (en) Caroline Rivera, Alex Arame, Ciprian Pricopi, Marc Riquet, Giuseppe Mangiameli, Mahdi Abdennadher, Marcel Dahan et Françoise Le Pimpec Barthes, « Pneumonectomy for benign disease: indications and postoperative outcomes, a nationwide study », Eur J Cardiothorac Surg, Oxford University Press (OUP), vol. 48, no 3, , p. 435-440 (ISSN 1010-7940, DOI 10.1093/ejcts/ezu439, lire en ligne).
- (en) Takeo Nakada, Tadashi Akiba, Takuya Inagaki, Toshiaki Morikawa et Takao Ohki, « Simplified Cavernostomy Using Wound Protector for Complex Pulmonary Aspergilloma », The Annals of Thoracic Surgery, Elsevier BV, vol. 98, no 1, , p. 360-361 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2013.11.087, lire en ligne).
- (en) Renaud Grima, Athanase Krassas, Patrick Bagan, Alain Badia, Françoise Le Pimpec Barthes et Marc Riquet, « Treatment of complicated pulmonary aspergillomas with cavernostomy and muscle flap: interest of concomitant limited thoracoplasty », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 36, no 5, , p. 910-913 (ISSN 1010-7940, DOI 10.1016/j.ejcts.2009.05.007, lire en ligne).
- (en) Akira Kato, Sho Kudo, Koichi Matsumoto, Tetsuhiro Fukahori, Toshihisa Shimizu, Akira Uchino et Shinichiro Hayashi, « Bronchial Artery Embolization for Hemoptysis Due to Benign Diseases: Immediate and Long-Term Results », CardioVascular and Interventional Radiology, Springer Science + Business Media, vol. 23, no 5, , p. 351-357 (ISSN 0174-1551, DOI 10.1007/s002700010062, lire en ligne).
- (en) Jie Chen, Liang-an Chen, Zhi-Xin Liang, Chun-Sun Li, Qing Tian, Zhen Yang, Yan-Wen Jiang et Dan-Yang She, « Immediate and Long-term Results of Bronchial Artery Embolization for Hemoptysis Due to Benign Versus Malignant Pulmonary Diseases », The American Journal of the Medical Sciences, Elsevier BV, vol. 348, no 3, , p. 204-209 (ISSN 0002-9629, DOI 10.1097/maj.0000000000000226, lire en ligne).
- (en) Peter Corr, « Management of Severe Hemoptysis from Pulmonary Aspergilloma Using Endovascular Embolization », CardioVascular and Interventional Radiology, Springer Science + Business Media, vol. 29, no 5, , p. 807-810 (ISSN 0174-1551, DOI 10.1007/s00270-005-0329-0, lire en ligne).
- (en) Takayuki Takeda, Hideki Itano, Ryouhei Kakehashi, Shinichi Fukita, Masahiko Saitoh et Sorou Takeda, « Direct transbronchial administration of liposomal amphotericin B into a pulmonary aspergilloma », Respiratory Medicine Case Reports, Elsevier BV, vol. 11, , p. 7-11 (ISSN 2213-0071, DOI 10.1016/j.rmcr.2013.12.003, lire en ligne).
- (en) Jared N. Kravitz, Max W. Berry, Stephen I. Schabel et Marc A. Judson, « A Modern Series of Percutaneous Intracavitary Instillation of Amphotericin B for the Treatment of Severe Hemoptysis From Pulmonary Aspergilloma », Chest, Elsevier BV, vol. 143, no 5, , p. 1414-1421 (ISSN 0012-3692, DOI 10.1378/chest.12-1784, lire en ligne).
- (en) J F Tomee, T S van der Werf, J P Latge, G H Koeter, A E Dubois et H F Kauffman, « Serologic monitoring of disease and treatment in a patient with pulmonary aspergilloma. », Am J Respir Crit Care Med, American Thoracic Society, vol. 151, no 1, , p. 199-204 (ISSN 1073-449X, DOI 10.1164/ajrccm.151.1.7812553, lire en ligne).
- (en) James R. Tomlinson et Steven A Sahn, « Aspergilloma in Sarcoid and Tuberculosis », Chest, Elsevier BV, vol. 92, no 3, , p. 505-508 (ISSN 0012-3692, DOI 10.1378/chest.92.3.505, lire en ligne).
- (en) J. Cadranel, B. Philippe, C. Hennequin, A. Bergeron, E. Bergot, A. Bourdin, V. Cottin, T. Jeanfaivre, C. Godet, M. Pineau et P. Germaud, « Voriconazole for chronic pulmonary aspergillosis: a prospective multicenter trial », Eur J Clin Microbiol Infect Dis, Springer Science + Business Media, vol. 31, no 11, , p. 3231-3239 (ISSN 0934-9723, DOI 10.1007/s10096-012-1690-y, lire en ligne).
- Stéphanie Lavaud, « Le scanner « low dose », un espoir pour le dépistage du cancer du poumon », sur Medscape, (consulté le ).
- (en) William R. Hendee et F. Marc Edwards, « ALARA and an integrated approach to radiation protection », Seminars in Nuclear Medicine, Elsevier BV, vol. 16, no 2, , p. 142-150 (ISSN 0001-2998, DOI 10.1016/s0001-2998(86)80027-7, lire en ligne).
- (en) Keitaro Nakamoto, Noboru Takayanagi, Tetsu Kanauchi, Takashi Ishiguro, Tsutomu Yanagisawa et Yutaka Sugita, « Prognostic Factors in 194 Patients with Chronic Necrotizing Pulmonary Aspergillosis », Intern. Med., Japanese Society of Internal Medicine, vol. 52, no 7, , p. 727-734 (ISSN 0918-2918, DOI 10.2169/internalmedicine.52.9142, lire en ligne).
Annexes
Articles généraux
- (en) Jean-Paul Latgé, « Aspergillus fumigatus and Aspergillosis », Clinical Microbiology Reviews, American Society for Microbiology, vol. 12, , p. 310-350 (ISSN 0893-8512, lire en ligne).
- (en) Eliseo Passera, Adriano Rizzi, Mario Robustellini, Gerolamo Rossi, Claudio Della Pona, Fabio Massera et Gaetano Rocco, « Pulmonary Aspergilloma », Thoracic Surgery Clinics, Elsevier BV, vol. 22, no 3, , p. 345-361 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2012.04.001, lire en ligne).
- (en) Chris Kosmidis et David W. Denning, « The clinical spectrum of pulmonary aspergillosis », Thorax, BMJ, vol. 70, no 3, , p. 270-277 (ISSN 0040-6376, DOI 10.1136/thoraxjnl-2014-206291, lire en ligne).
- (en) Cendrine Godet, Bruno Philippe, François Laurent et Jacques Cadranel, « Chronic Pulmonary Aspergillosis: An Update on Diagnosis and Treatment », Respiration, S. Karger AG, vol. 88, no 2, , p. 162-174 (ISSN 1423-0356, DOI 10.1159/000362674, lire en ligne).
Recommandations des sociétés savantes
- (en) David W. Denning, Jacques Cadranel, Catherine Beigelman-Aubry, Florence Ader, Arunaloke Chakrabarti, Stijn Blot, Andrew J. Ullmann, George Dimopoulos et Christoph Lange, « Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management », Eur Respir J, European Respiratory Society (ERS), vol. 47, no 1, , p. 45-68 (ISSN 0903-1936, DOI 10.1183/13993003.00583-2015, lire en ligne).
- (en) D. A. Stevens, V. L. Kan, M. A. Judson, V. A. Morrison, S. Dummer, D. W. Denning, J. E. Bennett, T. J. Walsh, T. F. Patterson et G. A. Pankey, « Practice Guidelines for Diseases Caused by Aspergillus », Clinical Infectious Diseases, Oxford University Press (OUP), vol. 30, no 4, , p. 696-709 (ISSN 1058-4838, DOI 10.1086/313756, lire en ligne).
- (en) Thomas J. Walsh, Elias J. Anaissie, David W. Denning, Raoul Herbrecht, Dimitrios P. Kontoyiannis, Kieren A. Marr, Vicki A. Morrison, Brahm H. Segal, William J. Steinbach, David A. Stevens, Jo Anne van Burik, John R. Wingard et Thomas F. Patterson, « Treatment of Aspergillosis: Clinical Practice Guidelines of the Infectious Diseases Society of America », Clinical Infectious Diseases, Oxford University Press (OUP), vol. 46, no 3, , p. 327-360 (ISSN 1058-4838, DOI 10.1086/525258, lire en ligne).
Articles connexes
- Causes : Aspergillus, le plus souvent Aspergillus fumigatus.
- Symptômes : souvent aucun, mais possibilité d'hémoptysie (crachats sanglants) et symptômes divers (fièvre, toux).
- Traitement : antimycosique (Triazole : Itraconazole, Voriconazole, Posaconazole voir Amphotéricine B, Micafungine, Caspofungine)
Liens externes
- A. Taytard, « Aspergillome », sur Respir.com, (consulté le ).
- « Aspergillose », sur Institut Pasteur, (consulté le ).
- Association française des enseignants de parasitologie et mycologie (ANOFEL), « Aspergilloses et autres champignons filamenteux opportunistes », sur Campus de Parasitologie-Mycologie (consulté le ).
- Anne Lejay et coll., « Chirurgie de l’aspergillome : une évolution vers de meilleurs résultats » [PDF], sur Société française de chirurgie thoracique et cardiovasculaire, (consulté le ).