Pariétectomie
Une pariétectomie est une intervention de chirurgie thoracique consistant en la résection (ablation partielle) d'une région de la paroi thoracique, emportant une partie des éléments osseux (côtes ou sternum). La pariétectomie peut être réalisée isolément ou conjointement à une résection pulmonaire. Elle est le plus souvent réalisée en intervention soit sur une tumeur développée aux dépens de la paroi (sarcome, cancer du sein, etc.), soit une tumeur pulmonaire envahissant la paroi.
Historique

La pariétectomie était appelée au XIXe siècle et au début du XXe siècle thoracectomie. Il existe alors un double sens à la thoracectomie, qui désigne autant une pariétectomie moderne qu'une thoracoplastie[1].
Les premières pariétectomies ont été effectuées lors d'interventions pour cancer du sein en prolongement du curage ganglionnaire de la chaine mammaire interne, par des élèves de William Halsted (1852-1922) dont Joseph Bloodgood (1867-1935). Toutefois, en 1858, Alfred Velpeau considérait qu'un envahissement du gril costal était une contre-indication à la chirurgie en raison de la fréquence des récidives[2]. Plus tard, l'anglais William Handley (1872-1962) la réalise plusieurs fois, mais ces opérations sont jugées trop graves pour un bénéfice douteux. En 1928, Wiener publie une série de 6 cas, avec 2 décès opératoires, 2 décès post-opératoires et 2 survies à 2 et 4 ans[3]. Les récidives locales étant majoritairement causées par un envahissement ganglionnaire non symptomatique, la mastectomie radicale étendue a été développée à partir de 1952 par le chirurgien italien Mario Margottini[4]. Le sein est alors retiré en bloc avec la paroi thoracique antérieure et la chaîne ganglionnaire thoracique interne. De manière encore plus invasive, la mastectomie super-radicale, développée par Owen Wangensteen en 1950, emporte en un seul bloc le sein, le tiers proximal de la clavicule, les arcs costaux antérieurs et l'hémi-sternum correspondant ainsi que les chaînes ganglionnaires thoracique interne, axillaire et sous-claviculaire[4]. Ces interventions, étant grevées d'une lourde mortalité (environ 15 %), et d'importantes complications associées à un résultat fonctionnel médiocre, ont été abandonnées dans les années 1960 au profit de la radiothérapie[4].
C'est en 1899 que la première pariétectomie pour une tumeur développée aux dépens de la paroi thoracique a été réalisée, par Parham[5]. Il fallut attendre la fin de la Deuxième Guerre Mondiale pour que les pariétectomies soient couramment réalisées dans le cas de tumeurs pulmonaires à envahissement pariétal. Les reconstructions utilisaient du matériel biologique issu du patient : dure-mère, lambeaux de fascia lata... Toutefois, ce matériel manquait de rigidité et la perte de fonction ventilatoire était importante après la chirurgie, entraînant des périodes de ventilation mécanique prolongée. L'arrivée sur le marché, en 1974, de plaques et de barres rigides de polyméthacrylate de méthyle a permis la généralisation des stabilisations par matériel prothétique[5].
Au XIXe siècle, les pariétectomies étaient également réalisées pour des lésions infectieuses, surtout tuberculeuses. La résection des côtes, développée dans cette indication par Théodore Tuffier en France, entraînait un affaissement de la paroi destiné à effacer la cavité infectée[6]. La thoracectomie péricardique[7] (ou intervention de Brauer[8]) consistait en la résection d'une partie du sternum et des arcs antérieurs des côtes afin de soulager une péricardite constrictive. Le plus souvent, l'opération n'est effectuée que lors d'une adhérence ou d'un envahissement des côtes ou des espaces intercostaux. C'est une résection de la paroi « à la demande des lésions ». En 1908, Antonin Gosset écrit : « le plus simple est de provoquer un pneumothorax progressif, puis de réséquer côtes, muscles intercostaux, et plèvre pariétale. »
Anatomie de la paroi thoracique
La paroi thoracique est composée du squelette de la cage thoracique et des muscles s'y insérant. Le squelette thoracique regroupe les 12 paires de côtes, qui s'articulent à l'arrière avec la colonne vertébrale et à l'avant avec le sternum par l'intermédiaire des cartilages costaux. Entre les côtes se trouvent les espaces intercostaux, occupés par les muscles intercostaux, qui sont vascularisés par les artères intercostales. À l'extérieur, les muscles du tronc s'insèrent sur la paroi thoracique, notamment le muscle dentelé antérieur, le muscle pectoral et le muscle grand dorsal.
On parle de pariétectomie pour désigner une résection chirurgicale emportant une ou plusieurs côtes, avec les espaces intercostaux adjacents, ou le sternum, ainsi que parfois les muscles et les tissus mous situés en regard.
Indications
Tumeurs de la paroi thoracique
Les tumeurs primitives de la paroi thoracique composent 5 % de tous les cancers thoraciques[9]. Elles sont dominées par les chondrosarcomes et les sarcomes radio-induits.
Lorsqu'il s'agit de tumeurs développées initialement aux dépens d'un autre organe[9], il s'agit le plus souvent de cancers du sein en récidive locale après un premier traitement chirurgical. Une récidive locale concerne en effet jusqu'à 20 % des patients atteints d'un cancer du sein. Au moment du diagnostic initial, un cancer du sein localement avancé peut infiltrer d'emblée les structures de la paroi thoracique dans 20 à 25 % des cas[10]. Toutefois, tous ces patients ne sont pas susceptibles de bénéficier d'une pariétectomie, notamment s'ils présentent des lésions métastatiques[10]. L'envahissement pariétal observé est variable, allant de la simple infiltration du muscle grand pectoral à l'envahissement de la cage thoracique elle-même[10]. L'ESMO ne recommande pas systématiquement une chirurgie d'emblée pour ces patients, préférant une discussion au cas par cas[11]. Lorsque la chirurgie est réalisée, elle doit viser à la résection complète et comprendre un curage ganglionnaire[11].
Le bilan préopératoire doit comprendre un dépistage et une prise en charge de dénutrition, ainsi qu'un sevrage tabagique de 6 à 8 semaines[9]. Dans le cas d'une récidive locale d'un cancer du sein, la paroi a été souvent fragilisée par les interventions antérieures et la radiothérapie, et ces facteurs de risque de mauvaise cicatrisation doivent être, autant que possible, éliminés. Une IRM[9] est utile afin de préciser l'extension locale, en particulier pour les sarcomes dont les berges peuvent être mal visualisées au scanner. Le bilan doit également s'attacher à affirmer le caractère local de la tumeur (par un TEP scanner et un scanner cérébral)[10] ; une extension à distance contre-indiquerait la chirurgie. Cependant, si une résection complète n'est pas possible, il est possible malgré tout de réaliser une chirurgie à visée antalgique ou de propreté, en cas notamment de plaie cutanée suintante[9] - [12].
Tumeurs pulmonaires envahissant la paroi
L'envahissement pariétal concerne environ 5 % des cancers bronchiques non à petites cellules opérés[13] et 32 % des tumeurs T3 opérées[14]. L'envahissement se fait d'abord aux dépens de la plèvre pariétale (26 à 70 % des cas), puis des muscles intercostaux (13 à 74 %) et enfin des côtes (24 à 74 %)[14].
L'envahissement pariétal est diagnostiqué à la fois cliniquement, par les douleurs de paroi augmentées à la palpation, et radiologiquement, par le scanner[13]. Il n'existe pas de lien entre la taille de la tumeur et la profondeur de l'envahissement pariétal[14].
Le bilan préopératoire peut comporter, outre les explorations fonctionnelles respiratoires et le bilan d'extension habituel, une IRM[13] afin de diagnostiquer un envahissement de la moelle épinière, qui contre-indiquerait une chirurgie[14]. Elle permet également de bien objectiver l'envahissement du plexus brachial et des vaisseaux sous-claviers dans les tumeurs de Pancoast. Toutefois, dans le cas d'un simple contact pariétal éloigné des structures vasculaires et nerveuses nobles, il n'y a pas lieu de réaliser de bilan plus poussé que le scanner initial[14].
Avant la chirurgie, un traitement par radio-chimiothérapie néoadjuvante est habituellement préconisé[13].
Ostéoradionécrose de la paroi thoracique
Les lésions radiques faisant suite à une radiothérapie peuvent être retardées de plusieurs mois voire de plusieurs années et concernent 5 à 15 % des patients irradiés[15]. Ces lésions tardives sont caractérisées par une détérioration progressive des tissus par diminution de la microvascularisation. Le tissu normal est remplacé par un tissu fibreux dense, qui nécrose lorsque l'apport sanguin d'oxygène se réduit encore[15]. En cas d'apparition d'une plaie cutanée, une biopsie doit s'assurer qu'il ne s'agit pas de récidive du cancer initial, souvent du sein. Une ostéoradionécrose intéressant la paroi thoracique doit faire envisager une pariétectomie de propreté[9]. Il est là encore important de dépister et traiter une dénutrition préopératoire ainsi qu'un tabagisme actif[9].
Dans le cadre d'un antécédent d'irradiation de la paroi, un syndrome de Stewart-Treves peut également conduire à réaliser une pariétectomie.
Les infections nécrosantes de la paroi thoracique sont une entité rare et grave, avec une mortalité importante[15]. Le traitement chirurgical doit être précoce, et peut se limiter à un débridement des tissus mous nécrosés sans résection des arcs costaux. Toutefois, lorsque ce dernier geste s'impose, l'utilisation de matériel prothétique synthétique est contre-indiquée pour la reconstruction en raison du risque infectieux.
Voies d'accès
Dans le cas d'une tumeur primitive de la paroi thoracique, l'abord se fait en regard de la tumeur. On tend à considérer, notamment pour les sarcomes, que les marges de résection n'ont pas besoin d'être aussi larges que par le passé[12], mais il faut autant que possible se trouver en tissu sain tant macroscopiquement que microscopiquement[12]. Lorsqu'il s'agit d'un cancer du sein localement avancé, mastectomie et pariétectomie sont réalisées dans le même temps chirurgical, de manière que la tumeur soit retirée en un seul bloc[10] - [11].
Lorsqu'une résection pulmonaire doit être associée, plusieurs cas de figure se présentent selon la localisation de la zone de paroi à réséquer. Une thoracotomie postéro-latérale sera le plus souvent l'abord privilégié[13] - [14]. Toutefois, dans le cas d'une tumeur de Pancoast, il est possible de réaliser un abord cervicothoracique antérieur (voie de Cormier-Dartevelle-Grunenwald)[14]. Il est important que la résection de la tumeur soit réalisée en bloc, emportant d'un seul tenant la partie pulmonaire et la paroi[16]. Dans le cas de ces cancers pulmonaires envahissant la paroi, la longueur des marges de résection sont débattues[14] : certains auteurs préconisent de réséquer une côte au-dessus et une côte en dessous de l'envahissement macroscopique, avec des marges latérales de 4 à 7 cm. Il existe cependant un minimum reconnu de marge de 1 cm autour de la tumeur[14]. Dans le cas d'une résection très postérieure nécessitant la désarticulation de la côte, il n'y a pas de consensus sur la nécessité ou non de réaliser une corporectomie vertébrale afin de s'assurer de la qualité des marges[14]. En cas d'envahissement de la plèvre pariétale sans envahissement macroscopique du grill costal, il n'y a pas de bénéfice de survie à réaliser une partiétectomie de principe en regard de la zone d'accolement[14].
Dans le cas du traitement des ostéoradionécroses, l'incision doit passer au propre des tissus nécrotiques et infectés.
Reconstruction
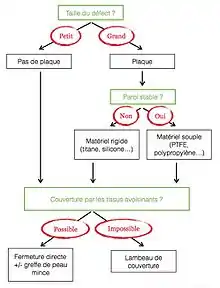
Diverses techniques de reconstruction de la paroi sont utilisées :
- fermeture directe ;
- mise en place de plaque prothétique souple (résorbable ou non), qui est à préférer à du matériel rigide en raison de sa meilleure compliance lors des mouvements respiratoires[13] ;
- mise en place de matériel d'ostéosynthèse (barres en titane ou en acier) ;
- lambeaux musculaires ou musculocutanés.
Un algorithme d'aide à la stratégie de reconstruction a été publié en 2004[17]. Le choix de la technique et du matériel se fait en premier lieu selon l'importance de l'instabilité pariétale entraînée par la résection[16]. Celle-ci entraîne en effet une respiration paradoxale voire une hernie pulmonaire qui, en modifiant la cinétique de la paroi thoracique, altèrent la fonction ventilatoire[9]. Quelle que soit la technique réalisée, la cavité pleurale doit être drainée en fin d'intervention[17].
Choix du matériel prothétique
Le matériel synthétique est préféré au matériel biologique en raison de sa meilleure résistance dans le temps[9] - [14].
Lorsque la résection de paroi n'intéresse que les trois premières côtes, il n'est pas nécessaire de réaliser de reconstruction prothétique[13]. On préconise généralement une stabilisation de la paroi lorsque la pariétectomie emporte 3 arcs costaux ou plus, mais aussi en cas de résection sternale totale ou subtotale[9]. En cas d'instabilité minime, une stabilisation par plaque peut suffire[16] ; dans le cas de pariétectomies emportant l'arc postérieur de la 4e côte, il est important de mettre une plaque afin d'éviter l'incarcération de la pointe de la scapula dans le défect[16] - [14]. Lorsque l'instabilité est importante, il y a lieu de ponter le défect afin de limiter la perte de fonction ventilatoire. Certains ont décrit à cet effet la réalisation de néo-côtes en résine[16]. Les barres de titane (similaires au matériel d'ostéosynthèse utilisé pour les fractures de côtes) sont toutefois plus souvent utilisées[16]. Lorsque la perte de substance concerne toute la largeur du sternum, il est conseillé de stabiliser de principe les arcs costaux gauches et droits entre eux afin de limiter les douleurs à la mobilisation, soit par de simples barres[18], soit par des prothèses sternales en titane ou en céramique. En revanche, plus une pariétectomie est postérieure et moins l'instabilité sera importante pour un nombre de côtes réséquées identique, diminuant l'impératif de stabilisation prothétique[17].
Dans le cas des ostéoradionécroses, la stabilisation pariétale n'est souvent pas nécessaire en raison de la raideur fibreuse des tissus environnants[15] - [12]. La priorité est à l'apport de tissu bien vascularisé, par un lambeau, afin de permettre la cicatrisation[15] - [18].
Lambeaux
Si toute l'épaisseur de la paroi n'est pas concernée par la perte de substance, un recouvrement simple par greffe de peau (mince ou épaisse) peut suffire[18]. En cas de surface à couvrir importante, on peut avoir recours à des lambeaux cutanés pédiculés (thoraco-abdominaux par exemple)[18] - [19].
Lorsque du matériel est mis en place, il doit impérativement être couvert de tissus sains afin de limiter le risque infectieux[16]. C'est la place principale occupée par les lambeaux dans ce type de chirurgie. Pour les défects antérieurs ou sternaux, on utilisera des lambeaux musculaires de muscle grand pectoral, de muscle droit de l'abdomen ou de muscle transverse de l'abdomen, qui demeurent les plus utilisés[9]. Les lambeaux musculaires ou musculo-cutanés fournis par le muscle grand dorsal peuvent être utilisés aussi bien pour les défects antérieurs que latéraux[16] - [9]. Le muscle trapèze peut lui être utilisé pour les défects axillaires ou postérieurs. Il est possible de combiner les lambeaux entre eux afin de couvrir un défect large.
| Défect parasternal | Antérieur | Latéral | Postérieur | Creux axillaire | |
|---|---|---|---|---|---|
| Muscle grand pectoral | + (haut) | + | + | ||
| Muscle grand dorsal | + | + | + | + | + |
| Muscle dentelé antérieur | + | + | |||
| Muscle droit de l'abdomen | + (bas) | + | |||
| Muscle transverse de l'abdomen | + (bas) | + | |||
| Muscle trapèze | + | + | |||
| Muscles intercostaux | + | + | |||
| Épiploon | + (bas) | + | + |
L'épaisseur et la solidité fournies par les lambeaux musculaires peuvent être suffisantes à assurer la stabilité de la paroi, en particulier en cas de petit défect. Lorsque l'épiploon est utilisé, il doit le plus souvent être soutenu par du matériel en raison de sa flaccidité[9].
En cas d'antécédent de radiothérapie sur la paroi thoracique antérieure[9], les lambeaux vascularisés par l'artère thoracique interne (grand pectoral, droit de l'abdomen et transverse de l'abdomen) ne peuvent être utilisés.
Si l'on utilise le plus souvent des lambeaux pédiculés, il peut parfois être nécessaire de réaliser un lambeau libre[9] - [16]. C'est le cas lorsque les lambeaux locaux ont déjà été utilisés ou endommagés lors d'interventions précédentes, ou ont été irradiés[18]. L'utilisation de lambeaux libres entraîne en général la réalisation de l'intervention en double équipe de chirurgie thoracique et de chirurgie plastique. Les lambeaux libres peuvent être anastomosés sur l'artère thoracique interne, l'artère thoracodorsale ou une branche de l'artère thoracoacromiale[12]. Deux types de lambeaux libres sont principalement utilisés[9] :
- lambeau du muscle tenseur du fascia lata : le site donneur n'a pas d'influence sur la fonction ventilatoire, mais le lambeau peut se révéler fin chez les patients maigres ;
- lambeau musculocutané du grand droit de l'abdomen (« TRAM ») : le lambeau est en général assez charnu pour combler une cavité importante, et son volume permet de simuler un sein au besoin. Toutefois, la fermeture du site donneur tend à augmenter la taille du défect thoracique lorsqu'il est antérieur.
Chez les patients obèses, et lorsque le défect est antérieur, il est possible de réaliser un lambeau de couverture par le sein[9].
La reconstruction est généralement effectuée d'emblée[12] mais peut parfois être différée, dans le cas de plaies très sales ou très délabrantes[18]. La mise en place d'un système de VAC-thérapie entre la première intervention et la reconstruction permet alors d'assurer la propreté du site, ainsi que de réduire la taille de la perte de substance en stimulant la cicatrisation[18] - [20]. De même, lorsque la couverture obtenue est musculaire seule, sans couverture cutanée, il est possible de mettre en place un système de VAC-thérapie pour stimuler le bourgeonnement avant la réalisation d'une greffe cutanée[15]. En ce cas, le traitement peut se faire de manière ambulatoire, le patient étant à son domicile avec le système de VAC et revenant régulièrement en consultation pour la réfection du pansement[20]. Les contre-indications à la VAC-thérapie doivent cependant être respectées[20] : débridement incomplet, contact du dispositif avec des organes ou des vaisseaux, résection tumorale incomplète, et saignement actif.
Complications
La mortalité des pariétectomies est en moyenne de 6 %[13] - [16], variant de 0 à 7,8 % selon les séries[14]. Les causes de décès sont dominées par la détresse respiratoire et les pneumopathies[13] chez ces patients chez qui la fonction respiratoire est doublement altérée, de par la résection pulmonaire et l'altération de la mécanique ventilatoire[13] - [14].
Les douleurs neuropathiques atteignent jusqu'à 50 % des patients après pariétectomie et doivent être prises en charge précocement, par exemple par une analgésie péridurale[13]. L'infection du matériel prothétique mis en place est peu fréquente, touchant 8 % des patients[21]. En cas d'utilisation d'un lambeau, la nécrose de celui-ci est plus fréquente pour les lambeaux libres que pour les lambeaux pédiculés[12].
Impact fonctionnel de la reconstruction
La qualité de la mécanique ventilatoire peut s'évaluer, d'une part par la fonction ventilatoire, d'autre part par la cinétique de la paroi thoracique pendant la ventilation[21]. La fonction ventilatoire est bien reflétée par le VEMS. La cinétique de la paroi thoracique peut s'évaluer par une ciné-IRM, à la recherche de respiration paradoxale. La compliance thoracique est, elle, difficile à mesurer en pratique courante, de même que l'impact de la perte de fonction des muscles respiratoires accessoires utilisés pour les lambeaux[18]. Ces muscles participent aussi au fonctionnement de l'épaule, où la perte de mobilité après prélèvement d'un de ces muscles est connue. Les autres muscles de l'épaule mettent entre 6 et 12 mois pour compenser la fonction perdue[18]. Dans le cas de lambeaux très postérieurs, un soin particulier doit être appliqué, lors de l'intervention, à la préservation de certaines insertions musculaires afin de limiter tant la perte de fonction de l'épaule que l'altération de la statique rachidienne[19].
En cas de stabilisation de la paroi par des néo-côtes rigides, sur une série de 26 patients opérés (dont 12 ayant subi une résection pulmonaire concomitante)[21], il n'existe pas de différence entre le VEMS pré et post-opératoire. La ciné-IRM réalisée six mois après la chirurgie ne retrouvait pas de respiration paradoxale, malgré le caractère antérieur et étendu des pariétectomies réalisées. Plus globalement, la littérature médicale existante[18] ne retrouve pas de modification significative de la fonction ventilatoire après une reconstruction de la paroi thoracique.
Pronostic
Les patients opérés de tumeurs pulmonaires étendues à la paroi ont un taux de récidive locale compris entre 10 et 16 %[13]. La survie à 5 ans est de 45 à 50 % pour les patients sans atteinte ganglionnaire et se dégrade jusqu'à 10 % en cas d'envahissement N2[13]. Le pronostic est également meilleur lorsqu'une résection complète a été possible[13]. Il existe également un gain de qualité de vie lié à l'amendement des douleurs pariétales causées par l'envahissement une fois la tumeur réséquée[14].
Dans le cas des cancers du sein localement avancés lors du diagnostic, un traitement adjuvant par radiochimiothérapie est souvent réalisé[10]. La survie à 5 ans est de 49 à 82 % ; la positivité de la tumeur aux récepteurs aux œstrogènes est un facteur de bon pronostic, de même que l'absence d'envahissement ganglionnaire[10]. Lorsqu'il s'agit d'une récidive locale, la survie à 5 ans est de 40 à 60 % ; le pronostic est essentiellement lié à l'âge et à la durée de la rémission préalable[10].
Références
- M. Forgue, « À propos du traitement chirurgical de la tuberculose pulmonaire », Bulletin de la Société des sciences médicales et biologiques de Montpellier et du Languedoc méditerranéen, , p. 412 (lire en ligne, consulté le )
- Alfred Velpeau, Traité des maladies du sein et de la région mammaire, Paris, Masson, (lire en ligne)
- G. Menegaux et J. Mathey, « Cancer du sein, Traitement », Encyclopédie Médico-Chirurgicale. Mamelle, fascicule 883-890
- (en) G.H. Sakorafas et Michael Safioleas, « Breast cancer surgery: an historical narrative. Part III. From the sunset of the 19th to the dawn of the 21st century », European Journal of Cancer Care, Wiley-Blackwell, vol. 19, no 2, , p. 145-166 (ISSN 0961-5423, DOI 10.1111/j.1365-2354.2008.01061.x, lire en ligne).
- (en) Felix G. Fernandez et G. Alexander Patterson, « Extended pulmonary resections », dans G. Alexander Patterson, Joel D. Cooper, Jean Deslauriers, Antoon E. M. R Lerut, James D. Luketich, Thomas W. Rice, F. Griffith Pearson, Pearson's Thoracic & Esophageal Surgery, Elsevier, (ISBN 978-0-443-06861-4).
- Léon Bérard et M. Cordier, « De la thoracectomie dans la tuberculose pulmonaire », Lyon médical : Gazette médicale et Journal de médecine réunis, , p. 494 (lire en ligne, consulté le )
- Société de pédiatrie de Paris, « La maladie d'Hutinel et son traitement chirurgical », Archives de médecine des enfants, vol. 25, , p. 55 (lire en ligne, consulté le ).
- Pierre André Nobécourt, « Les symphyses rhumatismales du péricarde chez les enfants », La Pédiatrie pratique. Journal de clinique et de thérapeutique infantiles, no 773, , p. 211 (lire en ligne, consulté le ).[ ], 1932-08-05, p. 211
- (en) E. Tukiainen, « Chest Wall Reconstruction after Oncological Resections », Scandinavian Journal of Surgery, SAGE Publications, vol. 102, no 1, , p. 9-13 (ISSN 1457-4969, DOI 10.1177/145749691310200103, lire en ligne).
- (en) Massimiliano D’Aiuto, Marcellino Cicalese, Giuseppe D’Aiuto et Gaetano Rocco, « Surgery of the Chest Wall for Involvement by Breast Cancer », Thoracic Surgery Clinics, Elsevier BV, vol. 20, no 4, , p. 509-517 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2010.09.001, lire en ligne).
- (en) F. Cardoso, A. Costa, L. Norton, E. Senkus, M. Aapro, F. Andre, C. H. Barrios, J. Bergh, L. Biganzoli, K. L. Blackwell, M. J. Cardoso, T. Cufer, N. El Saghir, L. Fallowfield, D. Fenech, P. Francis, K. Gelmon, S. H. Giordano, J. Gligorov, A. Goldhirsch, N. Harbeck, N. Houssami, C. Hudis, B. Kaufman, I. Krop, S. Kyriakides, U. N. Lin, M. Mayer, S. D. Merjaver, E. B. Nordstrom, O. Pagani, A. Partridge, F. Penault-Llorca, M. J. Piccart, H. Rugo, G. Sledge, C. Thomssen, L. van't Veer, D. Vorobiof, C. Vrieling, N. West, B. Xu et E. Winer, « ESO-ESMO 2nd international consensus guidelines for advanced breast cancer (ABC2) », Annals of Oncology, Oxford University Press (OUP), vol. 25, no 10, , p. 1871-1888 (ISSN 0923-7534, DOI 10.1093/annonc/mdu385, lire en ligne).
- (en) Kamran Harati, Jonas Kolbenschlag, Björn Behr, Ole Goertz, Tobias Hirsch, Nicolai Kapalschinski, Andrej Ring, Marcus Lehnhardt et Adrien Daigeler, « Thoracic Wall Reconstruction after Tumor Resection », Front. Oncol., Frontiers Media SA, vol. 5, (ISSN 2234-943X, DOI 10.3389/fonc.2015.00247, lire en ligne).
- (en) Erich Stoelben et Corinna Ludwig, « Chest wall resection for lung cancer: indications and techniques », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 35, no 3, , p. 450-456 (ISSN 1010-7940, DOI 10.1016/j.ejcts.2008.11.032, lire en ligne).
- (en) Marc Riquet, Alex Arame et Françoise Le Pimpec Barthes, « Non\u2013Small Cell Lung Cancer Invading the Chest Wall », Thoracic Surgery Clinics, Elsevier BV, vol. 20, no 4, , p. 519-527 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2010.06.004, lire en ligne).
- (en) Justin D. Blasberg et Jessica S. Donington, « Infections and Radiation Injuries Involving the Chest Wall », Thoracic Surgery Clinics, Elsevier BV, vol. 20, no 4, , p. 487-494 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2010.06.003, lire en ligne).
- (en) Daine T. Bennett et Michael J. Weyant, « Extended Chest Wall Resection and Reconstruction in the Setting of Lung Cancer », Thoracic Surgery Clinics, Elsevier BV, vol. 24, no 4, , p. 383-390 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2014.07.002, lire en ligne).
- (en) A Losken, V.H Thourani, G.W Carlson, G.E Jones, J.H Culbertson, J.I Miller et K.A Mansour, « A reconstructive algorithm for plastic surgery following extensive chest wall resection », British Journal of Plastic Surgery, Elsevier BV, vol. 57, no 4, , p. 295-302 (ISSN 0007-1226, DOI 10.1016/j.bjps.2004.02.004, lire en ligne).
- (en) David T. Netscher et Michael A. Baumholtz, « Chest Reconstruction: I. Anterior and Anterolateral Chest Wall and Wounds Affecting Respiratory Function », Plastic and Reconstructive Surgery, Ovid Technologies (Wolters Kluwer Health), vol. 124, no 5, , p. 240e-252e (ISSN 0032-1052, DOI 10.1097/prs.0b013e3181b98c9c, lire en ligne).
- (en) David T. Netscher, Michael A. Baumholtz et Jamal Bullocks, « Chest Reconstruction: II. Regional Reconstruction of Chest Wall Wounds That Do Not Affect Respiratory Function (Axilla, Posterolateral Chest, and Posterior Trunk) », Plastic and Reconstructive Surgery, Ovid Technologies (Wolters Kluwer Health), vol. 124, no 6, , p. 427e-435e (ISSN 0032-1052, DOI 10.1097/prs.0b013e3181bf8323, lire en ligne).
- (en) Darius Dian, Vera Bodungen, Isabelle Himsl, Visnja Drinovac, Ioannes Mylonas, Harald Sommer et Klaus Friese, « Worldwide first experiences with vacuum-assisted closure as alternative treatment method to repair defects of an extended thoracic wall recurrence of breast cancer », Arch Gynecol Obstet, Springer Science + Business Media, vol. 281, no 5, , p. 927-932 (ISSN 0932-0067, DOI 10.1007/s00404-009-1277-8, lire en ligne).
- (en) Didier Lardinois, Markus Müller, Markus Furrer, Andrej Banic, Matthias Gugger, Thorsten Krueger et Hans-Beat Ris, « Functional assessment of chest wall integrity after methylmethacrylate reconstruction », The Annals of Thoracic Surgery, Elsevier BV, vol. 69, no 3, , p. 919-923 (ISSN 0003-4975, DOI 10.1016/s0003-4975(99)01422-8, lire en ligne).