Acide valproïque
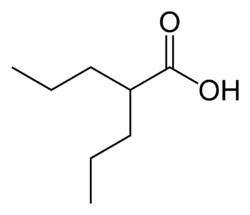
L’acide valproïque ou acide 2-propylpentanoïque (C8H16O2 ![]() ) ainsi que ses sels, les
valproates (principalement le valproate de sodium, le sel de sodium) sont des médicaments antiépileptiques (anticonvulsivant) ayant aussi des propriétés thymorégulatrices, antidépressives et anxiolytiques.
) ainsi que ses sels, les
valproates (principalement le valproate de sodium, le sel de sodium) sont des médicaments antiépileptiques (anticonvulsivant) ayant aussi des propriétés thymorégulatrices, antidépressives et anxiolytiques.
| Acide valproïque | |
 |
|
| Identification | |
|---|---|
| Nom UICPA | acide 2-propylpentanoïque |
| No CAS | |
| No ECHA | 100.002.525 |
| No CE | 202-777-3 |
| Code ATC | N03 |
| PubChem | 3121 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H16O2 [Isomères] |
| Masse molaire[1] | 144,211 4 ± 0,008 1 g/mol C 66,63 %, H 11,18 %, O 22,19 %, |
| pKa | 4.6 |
| Propriétés physiques | |
| T° ébullition | 222 °C |
| Solubilité | 2 000 mg·L-1 (eau, 20 °C) |
| Masse volumique | 0.92 |
| Point d’éclair | 111 °C |
| Propriétés optiques | |
| Indice de réfraction | 1.424-1.426 |
| Unités du SI et CNTP, sauf indication contraire. | |
Sous le nom de Dépakine, Micropakine et génériques, il est commercialisé contre l'épilepsie depuis 1967 (par le laboratoire Labaz, puis racheté en 1973[2] par Sanofi) ; sous le nom de Dépakote et Dépamide, il est commercialisé contre les troubles bipolaires (en 2e intention) depuis 1999.
Il a révolutionné la prise en charge de l'épilepsie et du trouble bipolaire. Ce médicament est interdit aux jeunes filles, adolescentes, femmes en âge de procréer ou enceintes (sauf en dernière intention, c'est-à-dire s'il n'existe pas d'autre solution), en raison de ses graves effets tératogènes sur l'embryon et le fœtus (spina bifida notamment) et de troubles neurodéveloppementaux induits chez le futur enfant et adulte.
L'acide valproïque fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[3].
Mode d'action
L'acide valproïque affecte les neurotransmetteurs GABA (en tant qu'inhibiteur de la GABA transaminase). L'acide valproïque est aussi un inhibiteur des histones désacétylases (HDAC) aux concentrations correspondant à une utilisation clinique[4]. Cette activité sur les HDAC se traduit par une activité de différenciation sur certains types cellulaires y compris cancéreux, et pourrait expliquer les effets tératogènes de ce médicament. L'acide valproïque diminue l'exicito-toxicité liée au glutamate et a une action neuroprotectrice. Elle augmenterait potentiellement la survie des patients atteints de Sclérose Latérale Amyotrophique (SLA), aussi connue sous le nom de maladie de Charcot par ce mécanisme, selon une étude de phase I[5].
Indications
L'acide valproïque est un anticonvulsivant possédant plusieurs propriétés ; il est utilisé dans des traitements divers[6] tels que :
- l'épilepsie (toutes les épilepsies sont sensibles à son action, épilepsies partielles ou généralisées, adultes et enfants) ;
- le trouble bipolaire ;
- la dépression ;
- les troubles obsessionnels compulsifs (les TOC) ;
- l'anxiété généralisée ;
- les migraines.
Cancers
Selon les instituts nationaux américains de la santé, l'acide valproïque peut être utilisé dans le traitement de divers cancers (moelle osseuse, gliome, mélanome). Le valproate est cytotoxique pour de nombreux types de cancers et a une action inhibitrice de l'histone déacétylase[7]. Elle pourrait aussi être utilisée pour traiter la leucémie chez les patients jeunes[8]. L'acide valproïque a donné des résultats encourageants dans le traitement du cancer du sein lorsqu'il est combiné à une chimiothérapie.
Contre-indications
- Hépatopathie sévère préexistante (voir foie)
- Allergie au produit
- Porphyrie (accumulation de précurseurs toxiques de l'hème)
- Anomalies héréditaires du cycle de l'urée (dont déficit en ornithine carbamyl transférase) : risque d'encéphalopathie hyperammoniémique
- Grossesse
Interactions avec d'autres traitements
L'association avec les barbituriques, la lamotrigine[9], la méfloquine est contre-indiquée et celle avec d'autres antiépileptiques doit être considérée avec précaution.
Effets secondaires connus
- Malformations congénitales chez la femme enceinte (10 à 40 % des cas)
- Troubles digestifs et dyspepsie (douleurs digestives)
- Prise de poids
- Plus rarement, vertiges ou fatigue, chute de cheveux, maux de tête, nausées, somnolence, tremblements
- Une thrombopénie, abaissement du niveau de plaquettes dans le sang
- Une cytolyse hépatique sévère avec dans de très rares cas, des troubles hépatiques, jaunisse, et ralentissement de la coagulation
- Des dysfonctionnements cognitifs et syndrome parkinsonien ont été signalés chez quelques sujets traités à long terme
- Risque de survenue d'encéphalopathie hyperammoniémique
- Diminution des folates cérébraux (5-MTHF)
Chez la femme enceinte
Le risque tératogène de développement de malformations congénitales chez les fœtus de femmes enceintes prenant du valproate est connu depuis les années 1980.
Chez environ 10 % des utilisatrices enceintes, l'acide valproïque, pris au cours du premier trimestre, est responsable de malformations congénitales[10] (exemple : non fermeture du tube neural[11], prévenue par la prise d'acide folique).
De plus, 30 à 40 % des enfants nés de mères sous valproate ont un risque de déficit cognitif (en)[12] - [13] ainsi que d'autisme ou de troubles apparentés[14].
Au Royaume-Uni, quelque 20 000 enfants sont nés avec des difformités depuis les années 1970 à cause du traitement[15].
Cet impact sur le développement a été repéré au cours des années 2000.
Marine Martin, lance l'alerte en 2011 avec son association l'APESAC[16] et obtient qu'une étude soit menée par l’Agence nationale de sécurité du médicament (ANSM) et la CNAMTS. En France, plus de 14 000 femmes enceintes ont pris du valproate de sodium entre 2007 et 2014[17] (14 322 grossesses identifiées dans ce cas, soit 1,9 pour 1 000 grossesses en France)[18] (ces femmes ont subi 4 300 IVG et sur les 8 816 accouchements documentés, il y a eu 115 enfants mort-nés. Au total 8 701 naissances d’enfants ont été exposés à l’acide valproïque in utero durant cette période[18]. Ensuite le nombre de grossesses exposées par an a diminué de 42,4 % de 2007 à 2014[18]. Entre 2010 et 2014 dans 66 cas de grossesses faisant suite à une procréation médicalement assistée (PMA avec inséminations artificielles ou transferts d'embryon) une prescription de valproate a été faite entre 60 jours avant le début de la grossesse et 15 jours après (53 naissances vivantes)[18].
Sanofi a alerté les autorités sanitaires en 2003 pour demander une modification de la notice d’information aux médecins (notice du Vidal) et aux malades (via le mode d’emploi), pour préciser que la prise de valproate de sodium est incompatible avec une grossesse. Cette notice sera effectivement modifiée en 2006.
Une étude menée par l’Agence nationale de sécurité du médicament (ANSM) et la CNAMTS rendue publique en 2017 a comparé les risques de malformations chez les enfants exposés in utero au valproate de sodium et chez les enfants non exposés[19]. Elle montre une multiplication du risque de malformation par 4 et 2 respectivement chez les enfants exposés selon que leur mère est traitée pour épilepsie ou pour bipolarité. Les auteurs estiment que « le nombre total d’enfants exposés in utero à l’acide valproïque atteints d’au moins une malformation congénitale majeure en France sur l’ensemble de la période depuis la commercialisation de l’acide valproïque (1967 à 2016) se situerait dans une fourchette entre 2 150 et 4 100 ». Une nouvelle étude par les mêmes auteurs a comparé les risques de troubles du développement et les prises en charge par des orthophonistes, orthoptistes et psychiatres chez les enfants des moins de 6 ans exposés in utero au valproate et chez les enfants non exposés (Risque de troubles neurodéveloppementaux précoces associé à l’exposition in utero à l’acide valproïque et aux autres traitements de l’épilepsie en France. 109 pages). Elle confirme l'augmentation du risque de troubles neurodévelopementaux.
On trouvera ci-dessous l'historique du résumé des caractéristiques du produit Valproate de sodium concernant la grossesse.
| 1986 | Prévenir votre médecin si vous êtes enceinte. |
| 1995 | Consulter rapidement votre médecin en cas de grossesse ou de désir de grossesse. Votre médecin jugera de l'utilité de poursuivre le traitement. |
| 2000 | En cas de grossesse ou de désir de grossesse, prévenez votre médecin. En effet, votre traitement devra éventuellement être adapté et une surveillance particulière devra être mise en route. Au moment de la naissance, une surveillance attentive du nouveau-né sera nécessaire. |
| 2004 | En cas de désir de grossesse, prévenez votre médecin, une surveillance particulière devra être mise en place. En cas de grossesse, votre traitement devra éventuellement être adapté. Il est important de ne pas arrêter le traitement car il existe un risque de réapparition de crises pouvant avoir des conséquences pour vous ou votre enfant. Au moment de la naissance, une surveillance attentive du nouveau-né sera nécessaire. |
| 2006 | En début de traitement, le médecin s’assurera que vous n’êtes pas enceinte et prescrira si besoin une méthode de contraception (cf. rubrique Grossesse et allaitement). L’utilisation de ce médicament est déconseillée, sauf avis contraire de votre médecin, pendant la grossesse. Si vous découvrez que vous êtes enceinte pendant le traitement, consultez rapidement votre médecin lui seul pourrait adapter le traitement à votre état. |
| 2009 | L’utilisation de ce médicament est déconseillée tout au long de la grossesse et chez les femmes en âge de procréer sans contraception efficace. Prévenez votre médecin de votre désir de grossesse avant d’interrompre votre contraception, afin qu’il puisse éventuellement adapter votre traitement et programmer une surveillance particulière de votre grossesse. De même, prévenez immédiatement votre médecin si vous découvrez que vous êtes enceinte. Dans tous les cas, vous ne devez pas interrompre votre traitement antiépileptique de vous-même sans l’accord de votre médecin car il existe un risque de réapparition des crises pouvant avoir des conséquences néfastes pour vous et votre enfant. |
| 2010 | L’utilisation de ce médicament est déconseillée tout au long de la grossesse et chez les femmes en âge de procréer sans contraception efficace. La prise de ce médicament au cours de la grossesse est susceptible d’entraîner des malformations du fœtus, des troubles de la coagulation chez le nouveau-né, des troubles du développement et des troubles autistiques chez l’enfant. Avant d’interrompre votre contraception, prévenez votre médecin de votre désir de grossesse afin qu’il puisse éventuellement adapter votre traitement et programmer une surveillance particulière de votre grossesse. De même, prévenez immédiatement votre médecin si vous découvrez que vous êtes enceinte. Dans tous les cas, vous ne devez pas interrompre votre traitement antiépileptique de vous-même sans l’accord de votre médecin. |
| 2011 | Vous ne devez pas prendre ce médicament si vous êtes enceinte ou en âge de procréer, sauf indication contraire de votre médecin. Si vous êtes en âge de procréer, vous devez utiliser une contraception efficace pendant le traitement. La prise de ce médicament au cours de la grossesse est susceptible d’entraîner des malformations du fœtus, des troubles de la coagulation chez le nouveau-né, des troubles du développement et des troubles autistiques chez l’enfant. Avant d’interrompre votre contraception, prévenez votre médecin de votre désir de grossesse afin qu’il puisse éventuellement adapter votre traitement et programmer une surveillance particulière de votre grossesse. De même, prévenez immédiatement votre médecin si vous découvrez que vous êtes enceinte. Dans tous les cas, vous ne devez pas arrêter votre traitement de vous-même sans l’accord de votre médecin. |
| 2014 | L'exposition in utero au valproate de sodium entraîne un risque de malformation d'environ 11 %, un risque de troubles neurodéveloppementaux pouvant atteindre jusqu'à 30 à 40 % des enfants d'âge préscolaire exposés in utero au valproate. |
| 2015 | Mise en garde. Les enfants exposés in utero au valproate présentent un risque élevé de troubles graves du développement (intellectuel et moteur) et du comportement (jusqu’à 30 à 40 % des cas) et/ou de malformations (environ 10 % des cas). Si vous êtes une fille, une adolescente, une femme en âge de procréer ou une femme enceinte, votre médecin spécialiste ne pourra vous prescrire le valproate qu’en cas d’inefficacité ou d’intolérance aux autres traitements. Si vous êtes une femme en âge de procréer, vous devez utiliser une contraception efficace pendant votre traitement. Si vous envisagez une grossesse, vous ne devez pas interrompre votre traitement sans en avoir parlé avec votre médecin et convenu d’un autre traitement si cela est possible. Votre médecin discutera de cela avec vous mais vous devez suivre les conseils donnés à la rubrique 2 de cette notice. Si vous êtes une femme en âge de procréer, votre médecin ne pourra vous prescrire le valproate qu’en cas d’échec des autres traitements. Le valproate est dangereux pour l’enfant à naître s’il est pris pendant la grossesse.
• Le valproate expose à un risque s’il est pris pendant la grossesse. Plus la dose est élevée, plus les risques sont importants ; toutefois toutes les doses exposent à ce risque. • Les enfants exposés in utero au valproate présentent des risques élevés de malformations graves et de troubles du développement (intellectuel et moteur) et du comportement. Les malformations rapportées incluent la spina bifida (malformation osseuse de la colonne vertébrale, dont un premier cas est publié en 1981[20]), des malformations de la face, de la lèvre supérieure et du palais, du crâne, du cœur, des reins, des voies urinaires et des organes génitaux ainsi que des membres. • Si vous prenez du valproate pendant la grossesse, vous avez un risque plus élevé que les autres femmes d’avoir un enfant atteint de malformations. Le valproate étant utilisé depuis de nombreuses années, il est établi que près de 10 % des enfants nés de mères traitées par valproate pendant la grossesse présentent des malformations, contre 2 à 3 % des enfants dans la population générale. • On estime que jusqu’à 30 à 40 % des enfants d’âge préscolaire dont les mères ont pris du valproate pendant la grossesse présentent des troubles du développement dans leur petite enfance. Les enfants concernés marchent plus tardivement et/ou parlent plus tardivement, et/ou ont des capacités intellectuelles plus faibles que les autres enfants et/ou ont des difficultés de langage et/ou de mémoire. • Les troubles du spectre autistique et l’autisme infantile sont plus souvent diagnostiqués chez les enfants exposés au valproate. • Des données limitées à ce jour indiquent que les enfants sont plus susceptibles de développer des symptômes du trouble du déficit de l’attention/hyperactivité (TDAH). GROSSESSE NON PRÉVUE PENDANT LA POURSUITE DU TRAITEMENT. Les enfants nés de mères traitées par le valproate ont un risque important de présenter des malformations et des troubles graves du développement qui peuvent se révéler lourdement handicapants. Si vous prenez du valproate et pensez être enceinte, consultez immédiatement votre médecin. N’arrêtez pas votre traitement sans que votre médecin vous l’ait conseillé. Interrogez votre médecin spécialiste sur la prise d’acide folique. L’acide folique peut diminuer le risque général de spina bifida et de fausse couche précoce inhérent à toute grossesse. Néanmoins, il est peu probable qu’il diminue le risque de malformations associées à l’utilisation du valproate. |
Dans son rapport publié en après une enquête de six mois, l’Inspection générale des affaires sociales (Igas), a noté un retard d’information des patientes et a dénoncé le « manque de réactivité » des autorités sanitaires et du laboratoire Sanofi sur le sujet. Selon elle, la Dépakine (nom commercial du valproate) serait responsable de 450 cas de malformations congénitales.
« Si le résumé des caractéristiques du produit (RCP) actuel de l’acide valproïque mentionne d’ores et déjà qu’il ne doit être utilisé qu’en dernière intention chez la femme enceinte et les femmes en âge de procréer, (…) le niveau de connaissance des prescripteurs est très certainement insuffisant » relevait le le groupe de travail « reproduction, grossesse et allaitement » de l’ANSM. Le , l’ANSM annonçait officiellement que la Dépakine et ses génériques ne pouvaient plus être prescrits aux femmes en âge d’avoir des enfants, « sauf en cas d’inefficacité ou d’intolérance aux alternatives médicamenteuses »[17].
Une étude rendue public le menée par des chercheurs de l'ANSM et de l'Assurance Maladie entre 2011 et 2016 montre les mères ayant été traitées avec de la Dépakine durant leur grossesse ont 5 fois plus de risques de voir leur enfant souffrir de troubles du développement dès leur petite enfance[21].
De plus la Dépakine serait à l’origine de séquelles sur plusieurs générations ; des chercheurs français, britanniques et australiens ont étudié ce risque de transmission des risques au fil des générations[22].
Saisie de la justice
En France, Marine Martin, la lanceuse d'alerte du scandale de la Dépakine a constitué une association de victimes, l’Apesac[23] (Association d'aide aux parents d'enfants souffrant du syndrome de l'anti-convulsivant). En 2012, une première plainte est déposée par Marine Martin, puis cinq autres familles la suivront dans une procédure au civil. Une quinzaine d’expertises sont en cours dans le cadre de procédures. Certaines ont montré un lien de causalité entre la prise du médicament et les malformations et les retards du développement chez les enfants. En 2015, quatre familles ont déposé une plainte contre X pour « tromperie aggravée » et « blessures et homicides involontaires ». L’enquête préliminaire ouverte par le parquet de Paris de ces mêmes chefs a été confiée aux gendarmes de l’Office central de lutte contre les atteintes à l’environnement et à la santé publique (OCLAESP), spécialistes des affaires sanitaires[17].
Le groupe pharmaceutique Sanofi est finalement mis en examen le sous les chefs d'accusation de « tromperie aggravée » et de « blessures involontaires »[24]. Suit en août une mise en examen pour « homicides involontaires »[25] - [26].
En , un homme de 20 ans souffrant d'une malformation cardiaque et d'un trouble autistique a reçu 1,3 million d’euros du fonds d’indemnisation des victimes du valproate de sodium et de ses dérivés, dont le médicament Dépakine fait partie. L'individu avait fait un recours auprès de l'Office national d'indemnisation des accidents médicaux (Oniam), un établissement public placé sous la tutelle du ministère de la Santé[27].
Le tribunal administratif de Montreuil (Seine-Saint-Denis) a condamné en l’État à indemniser à hauteur de 500 000 euros trois familles dont les enfants sont handicapés du fait de la prise du médicament pendant la grossesse. C’est la première fois que la justice reconnaît la responsabilité de l’État — partagée avec celle du laboratoire — dans ce scandale.
Le , la laboratoire Sanofi est jugé dans la première action de groupe en santé qui l'oppose à l'association de victimes l'APESAC. Le juge a estimé que le laboratoire a « commis une faute en manquant à son obligation de vigilance et à son obligation d’information » et qualifié la Dépakine (nom commercial de l'acide Valproïque) de « produit défectueux entre le et pour les malformations congénitales, et entre 2001 et pour les troubles neurodéveloppementaux »[28].
| Acide valproïque ou valproate de sodium | |
| Informations générales | |
|---|---|
| Princeps | Convulex (Belgique, Suisse) Depakene (Canada, États-Unis) Depakine (Belgique, France, Suisse) Dépakine (France) Dépakote (France) Epival (Canada, États-Unis) Merck-valproate (Belgique) Micropakine L.P. (France) Orfiril (Suisse) |
| Classe | Antiépileptique |
| Identification | |
| DCI | 3300 |
| No CAS | |
| No ECHA | 100.002.525 |
| Code ATC | N03AG01 |
| DrugBank | 00313 |
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Mirador Multinationales : Sanofi ».
- (en) WHO Model List of Essential Medicines, 18th list, WHO .
- (en) Martin Göttlicher et al., « Valproic acid defines a novel class of HDAC inhibitors inducing differentiation of transformed cells », EMBO J., vol. 20, (PMCID PMC125788, lire en ligne).
- Netgen, « Neurologie - Revue Médicale Suisse », sur Revue Médicale Suisse (consulté le ).
- (en) E.G. Hantouche et C. Demonfaucon, « [Resistant Obsessive Compulsive disorder (ROC): clinical picture, predictive factors and influence of affective tempéraments] », Encéphale, vol. 34, (résumé).
- Yolanda Smith, « Utilisations d'acide valproïque », News Medical, (lire en ligne, consulté le ).
- Les médecins américains notent qu'il est trop tôt pour faire une déclaration définitive mais que les résultats sont encourageants.
- Marta Vázquez et al., Lamotrigine-Valproic Acid Interaction Leading to Stevens–Johnson Syndrome, 2018. DOI 10.1155/2018/5371854.
- (en) Jentink J, Loane MA, Dolk H et al. for the EUROCAT Antiepileptic Study Working Group « Valproic acid monotherapy in pregnancy and major congenital malformations » N Eng J Med. 2010;362:2185-2193.
- (en) Centers for Disease Control and Prevention (CDC), « Valproate: a new cause of birth defects—report from Italy and follow-up from France » MMWR Morb Mortal Wkly Rep (en). 1983;32(33):438-9.
- (en) Meador KJ, Baker GA, Browning N et al. « Cognitive function at 3 years of age after fetal exposure to antiepileptic drugs » N Eng J Med. 2009;360:1597-605.
- (en) FDA Drug Safety Communication: « Valproate Anti-seizure Products Contraindicated for Migraine Prevention in Pregnant Women due to Decreased IQ Scores in Exposed Children »[PDF] .
- (en) Christensen J, Grønborg TK, Sørensen MJ et al. « Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism » JAMA. 2013;309:1696-1703.
- « Au Royaume-Uni, 20 000 bébés nés avec des difformités à cause d’une mauvaise information sur un médicament », Le Monde.fr, (lire en ligne)
- « Accueil - Association d’Aide aux Parents d'Enfants souffrant du Syndrome de l'Anti-Convulsivant », sur www.apesac.org (consulté le ).
- Emeline Cazi et Juliette Garnier, « Nouvelles révélations autour de la Dépakine », Le Monde.fr, (lire en ligne).
- Résultats de l’étude observationnelle sur les données du SNIIRAM (Exposition à l’acide valproïque et ses dérivés au cours de la grossesse en France de 2007 à 2014)[PDF], Paris, , 33 p.
- F Raguideau, M Zureik, R Dray-Spira, P-O Blotière, A Weill, J Coste. Exposition in utero à l’acide valproïque et aux autres traitements de l’épilepsie et des troubles bipolaires et risque de malformations congénitales majeures (MCM) en France. .
- Elisabeth Robert Gnansia, « Un exemple de détection de tératogène dans le cadre d'un registre de malformations : Dépakine et spina bifida », Revue d'épidémiologie et de santé publique, vol. 44, , p. 78-81.
- « La Dépakine multiplie par cinq le risque de troubles du développement », Le Monde.fr, (lire en ligne, consulté le ).
- https://www.ladepeche.fr/2021/12/07/valproate-de-sodium-des-sequelles-intergenerationnelles-9977221.php.
- Débat : scandale des médicaments, à qui la faute ?, France 2, (présentation en ligne, écouter en ligne) « Médiator hier, Dépakine aujourd'hui, les affaires associées à des médicaments dangereux se succèdent et ébranlent toujours plus la confiance des consommateurs dans l'industrie pharmaceutique. Qui tenir pour responsables de ces scandales sanitaires à répétition ? Julian Bugier organise le débat. L'association Apesac est évoquée au minutage 11:36. »
- « Scandale de la Dépakine : mise en examen du groupe pharmaceutique Sanofi », Le Monde.fr, (lire en ligne, consulté le ).
- « Dépakine : le laboratoire français Sanofi mis en examen pour "homicides involontaires" », sur Challenges (consulté le ).
- « Dépakine : Sanofi mis en examen pour homicides involontaires », Le Monde.fr, (lire en ligne, consulté le ).
- Brief.me, « Indemnisation d’une victime de la Dépakine | Brief.me », sur Brief.me - Le mini-journal par e-mail pour y voir plus clair dans l’actualité (consulté le ).
- https://www.lemonde.fr/societe/article/2022/01/05/depakine-sanofi-juge-responsable-d-un-manque-de-vigilance-et-d-information-sur-les-risques_6108281_3224.html.
Voir aussi
Bibliographie
- Marine Martin, Dépakine, le scandale. Je ne pouvais pas me taire, Robert Laffont, 2017, 252 p.
- Rapport d’étude Exposition à l’acide valproïque et ses dérivés au cours de la grossesse en France de 2007 à 2014 : une étude observationnelle sur les données du SNIIRAM[PDF]|Paris| | 6,2 Mo.
- Synthèse du rapport d’étude Exposition à l’acide valproïque et ses dérivés au cours de la grossesse en France de 2007 à 2014 : une étude observationnelle sur les données du SNIIRAM[PDF] |Paris| | 358,5 ko.
- Résultats de l’étude observationnelle sur les données du SNIIRAM (Exposition à l’acide valproïque et ses dérivés au cours de la grossesse en France de 2007 à 2014)[PDF]|Paris| | 33 p.