Acénaphtène
L'acénaphtène est un hydrocarbure aromatique polycyclique (HAP) constitué d'une molécule de naphtalène dont les carbones 1 et 8 sont reliés par un pont éthylénique. C'est la forme hydrogénée de l'acénaphtylène.
| Acénaphtène | |
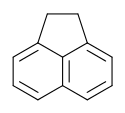  Structure de l'acénaphtène. |
|
| Identification | |
|---|---|
| Nom UICPA | 1,2-dihydroacénaphthylène |
| Synonymes |
1,8-éthylènenaphthalène |
| No CAS | |
| No ECHA | 100.001.336 |
| No CE | 201-469-6 |
| No RTECS | AB1000000 |
| PubChem | 6734 |
| SMILES | |
| InChI | |
| Apparence | Poudre cristalline blanche à jaune |
| Propriétés chimiques | |
| Formule | C12H10 [Isomères] |
| Masse molaire[1] | 154,207 8 ± 0,010 3 g/mol C 93,46 %, H 6,54 %, |
| Susceptibilité magnétique | 109,3×10-6 cm3·mol-1[2] |
| Propriétés physiques | |
| T° fusion | 93,4 °C [3] |
| T° ébullition | 279 °C [3] |
| Solubilité | 3,9 mg·l-1 (eau,25 °C)[4] 36,52 mg·g-1 (éthanol,25,05 °C) 31,10 mg·g-1 (propan-2-ol,24,92 °C) 50,40 mg·g-1 (butan-1-ol,25,1 °C) 401,70 mg·g-1 (toluène,25,08 °C)[5] |
| Masse volumique | 1,222 g·cm-3 à 20 °C [3] |
| T° d'auto-inflammation | 450 °C [6] |
| Point d’éclair | 135 °C [6] |
| Thermochimie | |
| S0solide | 188,87 J·K-1·mol-1 [7] |
| ΔfH0gaz | 156,8 kJ·mol-1 [7] |
| ΔfH0solide | 72 kJ·mol-1 [7] |
| ΔfusH° | 21,462 2 kJ·mol-1 à 93,41 °C [7] |
| ΔvapH° | 63,9 kJ·mol-1 à 25 °C [8] |
| Cp | 185,27 J·K-1·mol-1 (solide,17,15 °C) [9] 220,85 J·K-1·mol-1 (gaz,126,85 °C)[7] |
| PCI | −6 222 kJ·mol-1 [7] |
| Propriétés optiques | |
| Indice de réfraction | [3] |
| Précautions | |
| SGH[10] | |
  Attention |
|
| NFPA 704 | |
| Transport[6] | |
| Écotoxicologie | |
| CL50 | 600 mg·kg-1 (rat, i.p.) [4] |
| LogP | 3,92 [6] |
| Composés apparentés | |
| Isomère(s) | Acénaphtylène |
| Unités du SI et CNTP, sauf indication contraire. | |
C'est un constituant du goudron, et on le trouve aussi dans la houille ainsi qu'en très faible quantité dans le pétrole.
Histoire
L'acénaphthène a été découvert pour la première fois par Marcellin Berthelot dans le goudron en 1867[11], puis synthétisée ensuite avec Bardy à partir de l'α-éthylnaphthalène.
Propriétés physico-chimiques
L'acénaphtène est presque insoluble dans l'eau, mais est en revanche soluble dans le benzène, l'éther, le chloroforme et dans l'alcool à chaud.
Cet hydrocarbure réagit avec les halogènes de manière préférentielle en position 3, 5 et 6 voire 1 en fonction de l'activation. La nitration et la sulfonation ont lieu également sur ces positions.
L'hydrogénation catylique conduit à la formation du tétrahydroacénahtène et du décahydroacénahtène alors que l'oxydation donne l'acénaphtylène, l'acide naphtalique, l'anhydride naphtalique, l'acénaphtènequinone, l'acénaphténol et l'acénaphténone[11].
Utilisation
L'acénaphtène est produit en grande quantité pour la synthèse de l'anhydride naphtalique par oxydation en phase gazeuse. L'oxydation a lieu en présence d'air et d'un catalyseur à base de vanadium à 300–400 °C[11]. L'acide naphtalique est produit par oxydation en phase liquide en présence de chromate ou d'air accompagné d'acétate de manganèse voire d'acétate de cobalt aux environs de 200 °C[11].
La condensation avec le propanédinitrile donne l'acide naphtalèn-1,4,5,8-tétracarboxylique. Ces composés sont des intermédiaires pour la fabrication de pigments pérylènes et périnones[11].
D'autres intermédiaires pour la fabrication de colorants ou de produits pharmaceutiques utilisent l'acénaphtène comme réactif: le 4-bromacénaphtène pour la production d'anhydride 4-bromonaphtalique, le 5,6-dichloracénaphtène et le 3,5,6-trichloracénaphtène. Le pigment fluorescent Solvent yellow 44 est fabriqué via l'anhydride 4-nitronaphtalique qui est le résultat de la nitration et de l'oxydation de l'acénaphtène[11].
Des plastiques thermiquement stables ou non-inflammables par incorporation de dérivés de l'acénaphtène durant la polymérisation[11].
Production et synthèse
Le goudron contient environ 0,3 % d'acénaphtène et 2 % d'acénaphtylène qui peut être converti via hydrogénation. L'acénaphtène est concentrée dans la fraction du goudron ayant un point d'ébullition compris entre 230 et 290 °C jusqu'à 25 %. Une seconde distillation est effectuée pour obtenir une solution concentrée ayant un point d'ébullition entre 270 et 275 °C suivie d'une cristallisation pour l'obtention de l'acénaphtène technique (95-99 %)[11]. Une suite de distillation et recristallisation permet une meilleure purification du produit[11].
Voir aussi
Liens externes
- (en) Method for sampling and analysis (méthode d'échantillonnage et d'analyse)
- (en) Chemical land datasheet
- (en) MSDS at Oxford University Page de l'université d'Oxford)
- (en) National Pollutant Inventory - Polycyclic Aromatic Hydrocarbon Fact Sheet
- (en) Entrée « Acénaphtène » de la base d'une base de données HAP
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », Journal of the American Chemical Society, vol. 91, no 8, , p. 1991-1998
- (en) W. M Haynes, CRC Handbook of chemistry and physics, Boca Raton, CRC Press/Taylor and Francis, , 91e éd., 2610 p. (ISBN 978-143982-077-3), p. 3-4
- (en) « Acénaphtène », sur ChemIDplus, consulté le 18 janvier 2010
- (en) Fang He et Pengbiao Liu, « Solubility of Acenaphthylene in Different Solvents between (278 and 323) K », Journal of Chemical & Engineering Data, vol. 52, no 6, , p. 2536-2537
- (en) « Acenaphthene », sur NIST/WebBook, consulté le 18 janvier 2010
- (en) Ying Duan Lei, Raymond Chankalal, Anita Chan et Frank Wania, « Supercooled Liquid Vapor Pressures of the Polycyclic Aromatic Hydrocarbons », Journal of Chemical & Engineering Data, vol. 47, no 4, , p. 801-806
- (en) J. A. R. Cheda et E. F. Jr. Westrum, « Subambient-Temperature Thermophysics of Acenaphthene and Acenaphthylene: Molecular Disorder in the Latter », The Journal of Physical Chemistry, vol. 98, no 9, , p. 2482-2488
- SIGMA-ALDRICH
- (en) Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry »,