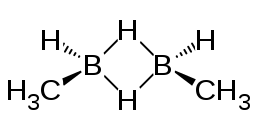
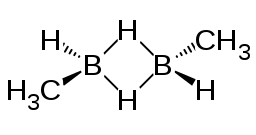
1,2-Diméthyldiborane
Le 1,2-diméthyldiborane est un composé organoboré de formule chimique CH3HB(μ-H)2BHCH3. Il existe sous la forme de deux diastéréoisomères, le cis- et le trans-1,2-diméthyldiborane[2], eux-mêmes isomères du 1,1-diméthyldiborane H2B(μ-H)2B(CH3)2, ou « diméthylborane asymétrique ». Le 1,2-diméthyldiborane est un dimère de méthylborane BH2CH3, le plus simples des organoboranes[3]. À température ambiante, il est à l'équilibre avec le méthyldiborane H2BH2BHCH3, le 1,1-diméthyldiborane H2BH2B(CH3)2, le triméthyldiborane CH3HBH2B(CH3)2, le tétraméthyldiborane (CH3)2BH2B(CH3)2 et le triméthylborane B(CH3)3, de sorte qu'il est difficile de disposer de 1,2-diméthyldiborane pur[4]. Il se présente comme un gaz pyrophorique incolore facile à condenser. Le point de fusion du cis-1,2-diméthyldiborane est de −132,5 °C tandis que celui du trans-1,2-diméthyldiborane est de −102 °C[5] ; le 1,1-diméthyldiborane fond quant à lui à −150,2 °C[6].
Histoire et préparation
Les méthylboranes ont été préparés pour la première fois dans les années 1930[7] - [8]. On les obtient en faisant réagir du diborane H2BH2BH2 et du triéthylborane B(CH3)3, ce qui donne quatre composés différents : le méthyldiborane H2BH2BHCH3, le 1,1-diméthyldiborane H2BH2B(CH3)2, 1,2-diméthyldiborane CH3HBH2BHCH3 et le tétraméthyldiborane (CH3)2BH2B(CH3)2[9].
Une voie plus moderne pour obtenir du 1,2-diméthyldiborane consiste à traiter du méthylborohydrure de lithium LiBH3CH3 avec du chlorure d'hydrogène HCl[3] :
Il est possible d'utiliser de l'iodométhane CH3I ou du chlorure de triméthylsilyle (CH3)3SiCl à la place du chlorure d'hydrogène[9]. Le méthylborohydrure de lithium peut être obtenu en traitant des esters méthylboroniques avec de l'aluminohydrure de lithium LiAlH4[9].
On peut également obtenir des méthylboranes en chauffant du triméthylborane en présence d'hydrogène sous pression entre 80 et 200 °C. Le triméthylborane réagit avec les sels métalliques de borohydrure en présence de chlorure d'hydrogène HCl, de chlorure d'aluminium AlCl3 ou de trichlorure de bore BCl3. Il y a libération de méthane avec le borohydrure de sodium NaBH4, mais pas avec le borohydrure de lithium LiBH4[8]. Le diméthylchloroborane BCl(CH3)2 et le méthyldichloroborane BCl2CH3 sont également des produits gazeux de ces réactions.
La réaction de Cp2Zr(CH3)2 avec du borane BH3 dissous dans le tétrahydrofurane (THF) conduit à l'insertion d'un groupe borohydro dans la liaison Zr–C et à la production de dérivés méthylés du diborane[10].
Le diméthylcalcium Ca(CH3)2 réagit dans l'éther avec le diborane pour produire du diméthyldiborane et du borohydrure de calcium Ca(BH4)2[11] :
- Ca(CH3)2 + 2 B2H6 ⟶ Ca(BH4)2 + B2H4(CH3)2.
Le triméthylborane B(CH3)3 se dismute partiellement à température ambiante en quelques heures pour donner du tétraméthyldiborane (CH3)2BH2B(CH3)2 et du 1,2-diméthyldiborane CH3HBH2BHCH3. Il se forme également du 1,1-diméthyldiborane H2BH2B(CH3)2 au bout de quelques semaines[12].
Une voie spécifique de synthèse du 1,2-diméthyldiborane consiste à faire réagir du méthyldiborane H2BH2BHCH3 avec une quantité suffisante d'une base de Lewis qui conduit à la formation de méthylborane BH2CH3 et à sa dimérisation en 1,2-diméthyldiborane[13].
Réactions
Le 1,2-diméthyldiborane au repos se convertit lentement en 1,1-diméthyldiborane[14].
La chromatographie en phase gazeuse peut être utilisée pour déterminer les proportions de boranes méthylés dans un mélange. La séquence d'extraction est la suivante : diborane, méthyldiborane, triméthylborane, 1,1-diméthyldiborane, 1,2-diméthyldiborane, triméthyldiborane et tétraméthyldiborane[15].
Le 1,2-diméthyldiborane s'hydrolyse en acide méthylboronique CH3B(OH)2[4] :
Le 1,2-diméthyldiborane réagit avec la triméthylamine N(CH3)3 pour donner un adduit solide triméthylamine-méthylborane (CH3)3N·BH2CH3[4].
Le chauffage d'un mélange de diméthyldiborane et d'ammoniac donne des borazines B-substituées avec un, deux ou trois groupes méthyle sur les atomes de bore[16] - [17].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) M. J. D. Low, R. Epstein et A. C. Bond, « Characteristic Infrared Frequencies of Methyldiboranes », The Journal of Chemical Physics, vol. 48, no 5, , p. 2386-2387 (DOI 10.1063/1.1669454, Bibcode 1968JChPh..48.2386L, lire en ligne)
- (en) Morris Srebnik, Thomas E. Cole et Herbert C. Brown, « Methylborane - a remarkable unhindered monoalkylborane which achieves the controlled sequential hydroboration of representative alkenes », Tetrahedron Letters, vol. 28, no 33, , p. 3771-3774 (DOI 10.1016/S0040-4039(00)96380-9, lire en ligne)
- (en) R. P. Bell et H. J. Emeléus, « The boron hydrides and related compounds », Quarterly Reviews, Chemical Society, vol. 2, no 2, , p. 132-151 (DOI 10.1039/QR9480200132, lire en ligne)
- (en) Lise Hedberg, Kenneth Hedberg, David A. Kohler, David M. Ritter et Verner Schomaker, « Electron-diffraction investigations of the molecular structures of cis- and trans-1,2-dimethyldiborane », Journal of the American Chemical Society, vol. 102, no 10, , p. 3430-3434 (DOI 10.1021/ja00530a021, lire en ligne)
- (en) Thomas Onak, F. G. A. Stone et Robert West, Advances in Organometallic Chemistry, Academic Press, janvier 1966, p. 284. (ISBN 978-0080580043)
- (en) H. I. Schlesinger et A. O. Walker, « Hydrides of Boron. IV. The Methyl Derivatives of Diborane », Journal of the American Chemical Society, vol. 57, no 4, , p. 621-625 (DOI 10.1021/ja01307a009, lire en ligne)
- (en) L. H. Long et M. G. H. Wallbridge, « 646. The chemistry of boron. Part VI. New preparative methods and decomposition studies relating to methyldiboranes », Journal of the Chemical Society (Resumed), , p. 3513-3520 (DOI 10.1039/JR9650003513, lire en ligne)
- (en) Herbert C. Brown, Thomas E. Cole, Morris Srebnik et Kee Won Kim, « Hydroboration. 79. Preparation and properties of methylborane and dimethylborane and their characteristics as hydroborating agents. Synthesis of tertiary alcohols containing methyl groups via hydroboration », The Journal of Organic Chemistry, vol. 51, no 25, , p. 4925-4930 (DOI 10.1021/jo00375a031, lire en ligne)
- (en) John A. Marsella et Kenneth G. Caulton, « Dealkylation of zirconium(IV) by borane: the intimate mechanism of an alkyl transfer reaction », Journal of the American Chemical Society, vol. 104, no 9, , p. 2361-2365 (DOI 10.1021/ja00373a005, lire en ligne)
- (en) B. D. James et M. G. H. Wallbridge, « Metal Tetrahydroborates », Stephen J. Lippard, Progress in Inorganic Chemistry, vol. 11, Wiley, 1970, p. 185. (ISBN 0471-54081-1)
- (en) Walter J. Lehmann, Charles O. Wilson Jr. et I. Shapiro, « Infrared Spectra of Alkyldiboranes. V. Tri‐ and Tetramethyl‐ and Ethyldiboranes », The Journal of Chemical Physics, vol. 34, no 3, , p. 783-792 (DOI 10.1063/1.1731675, Bibcode 1961JChPh..34..783L, lire en ligne)
- (en) Kenneth Wade, « The General Chemistry of the Boron Hydrides », Electron Deficient Compounds, Thomas Nelson, 1971, p. 91-92. (ISBN 978-1-4684-6056-8)
- (en) Walter J. Lehmann, Charles O. Wilson Jr. et I. Shapiro, « Infrared Spectra of Alkyldiboranes. III. 1,2‐Dimethyl‐ and 1,2‐Diethyldiboranes », The Journal of Chemical Physics, vol. 33, no 2, , p. 590-597 (DOI 10.1063/1.1731190, Bibcode 1960JChPh..33..590L, lire en ligne)
- (en) G. R. Seely, J. P. Oliver et D. M. Ritter, « Gas-Liquid Chromatographic Analysis of Mixtures Containing Methyldiboranes », Analytical Chemistry, vol. 31, no 12, , p. 1993-1995 (DOI 10.1021/ac60156a032, lire en ligne)
- (en) J. C. Sheldon et B. C. Smith, « The borazoles », Quarterly Reviews, Chemical Society, vol. 14, no 2, , p. 200-219 (DOI 10.1039/QR9601400200, lire en ligne)
- (en) H. I. Schlesinger, Leo Horvitz et A. B. Burg, « Hydrides of Boron. VI. The Action of Ammonia on the Methyl Diboranes », Journal of the American Chemical Society, vol. 58, no 3, , p. 409-414 (DOI 10.1021/ja01294a008, lire en ligne)