Évolution des plans d'organisation des animaux
L'évolution des plans d'organisation des animaux est l'ensemble des changements progressifs au long des générations d'espèces animales concernant leur plan d'organisation, c'est-à-dire leur architecture particulière sur le plan structurel et fonctionnel.
Les métazoaires, plus communément appelés «animaux», sont des êtres hétérotrophes, multicellulaires et mobiles. L’apparition de la multicellularité a permis l’expression de nouveaux types cellulaires par différenciation cellulaire, mettant en place une complexité anatomique jusqu’alors impossible. Les plans d'organisation sont donc souvent utilisés pour décrire les métazoaires car la diversité anatomique qu'ils présentent est tout particulièrement incroyable. Ils sont permis au niveau génétique, par une structuration des gènes régulateurs en réseau, et l'expression de gènes du développement très conservés. L'environnement permet également d'influer sur la diversité des plans d'organisation par sélection de ceux qui sont les plus adaptés au milieu.
Le concept même de plan d’organisation est plutôt controversé, car il ne décrit que l'archétype d'un embranchement, sans prendre en compte la diversité interne de celui-ci. Les caractères définis dans un plan d'organisation sont donc souvent arbitraires. Cependant, ils permettent tout de même de comprendre l'organisation d'un taxon considéré dans toute sa généralité. On peut donc identifier l’émergence de nouveaux plans d’organisation chez les animaux, et les corréler aux grands mécanismes de l'évolution.
Fondements génétiques
Durant l'Évolution, plusieurs mécanismes ont permis la mise en place des différents plans d’organisation. Parmi eux se trouvent : la sélection naturelle, les innovations génétiques liées notamment aux mutations, et la dérive génétique.
Innovation génétique
Les innovations génétiques sont induites par des mutations de l'ADN d'un individu. Ces mutations peuvent être dues à des insertions, délétions ou substitutions de nucléotides ou groupes de nucléotides par exemple. Elles peuvent être neutres au moment de leur apparition (ni bénéfiques, ni délétères pour la fitness de leur porteur) mais s'avérer avantageuses lors d'un changement de la niche écologique de l'individu. Celles-ci lui confèrent alors un avantage sélectif par rapport à ses congénères dans un contexte environnemental donné.
La dérive génétique
Elle se manifeste à la même échelle que l’innovation génétique, car elle influe de manière aléatoire sur la fréquence allélique des gènes dans la population. Elle dépend du brassage génétique lors de la méiose, de la reproduction des individus et du nombre de leurs descendants. Elle peut conduire à la fixation dans la population d’un allèle (favorable ou non) comme à sa disparition. C’est un mécanisme imprévisible.
Ce mécanisme a été à l’origine de nombreux phyla, notamment celui des Métazoaires, plus communément appelé « animaux ». Ces derniers possèdent des caractères généraux communs comme la multicellularité ou le développement embryonnaire.
Cependant, il existe des molécules extrêmement bien conservées chez l’ensemble des animaux. Elles assurent notamment la mise en place de la symétrie et du plan d’organisation. Bien que ces gènes et molécules soient conservés, leur expression et/ou régulation ont parfois été modulées, aboutissant aux nombreuses formes animales connues aujourd’hui.
Réseaux de gènes régulateurs
Chaque cellule du corps d’un organisme possède les mêmes informations génétiques. Il existe un programme génétique régulateur qui va déterminer l’activité transcriptionnelle au travers du développement spatial et temporel des cellules de l’organisme. Cet appareil de contrôle a une réalité physique[1] et comprend :
- des gènes régulateurs qui codent des facteurs de transcription requis lors de l’événement du développement ;
- des séquences cis-régulatrices qui produisent des protéines (facteurs de transcription) qui vont se fixer et influencer l’activité d’autres séquences ;
- la séquence qui contrôle chacun de ces gènes[2].
Il est donc composé d’ADN codant et non codant. La représentation des interactions entre les différents gènes est un réseaux de régulation génique qui contrôle l’ensemble des étapes du développement[1]. Il existe d’autres mécanismes qui agissent sur le devenir des différents plans d’organisation mais ils se situent après l’établissement primaire de la séquence de gènes régulateurs.
Hiérarchisation

Les GRNs qui régulent l’établissement des différents plans d’organisation ont une structure hiérarchisée dans le temps et dans l’espace, comme illustré par la figure. Il peut être représenté comme un réseau à 3 niveaux différents en fonction du stade du développement que contrôle chaque portion du GRN. Le développement d’un organisme se fait de phase en phase, et à chaque étape, une partie différente du GRN est sollicitée. Lors des premières étapes du développement embryonnaire, la fonction des modules du GRN sollicités est de partitionner l’organisme en grands domaines qui respectent les axes corporels principaux. Une fois que cette première fragmentation est établie, d’autres modules du GRN vont permettre la mise en place des pièces constituantes de chaque domaine. Enfin, et seulement une fois que ces étapes ont été réalisées, les modules terminaux du GRN qui déterminent la spécificité cellulaire sont activés. Ces derniers vont activer la transcription des batteries de gènes périphériques qui codent les protéines effectrices[1] - [2]. Les différents niveaux hiérarchiques de GRN sont reliés entre eux par des sous-circuits formés par les séquences cis-régulatrices. Ces liens permettent une connexion fonctionnelle entre des gènes qui codent des facteurs de transcription et qui se régulent entre eux, et donc la progression spatiale d’états régulateurs définis[2] - [3].
Le phénomène de canalisation
Le phénomène de canalisation est la mise en place d'un état régulateur qui réduit le choix d'états régulateurs qui peuvent s'établir dans les étapes spatiales et temporelles qui suivent. La structure d’un GRN, c’est-à-dire les éléments dont il est composé et les liens qui existent entre eux, détermine sa fonction. Une mutation dans un des éléments va altérer la fonction du GRN. Cette altération aura des conséquences différentes en fonction du niveau de la hiérarchie dans laquelle elle aura lieu. En effet, une modification au sommet de la hiérarchie peut avoir un impact sur toutes les phases de développement spatiales et temporelles qui suivent. De cette manière, les niveaux supérieurs de GRN ont tendance à être conservés alors que les mutations dans des modules périphériques de GRN sont moins susceptibles de provoquer des altérations délétères[1]. C’est la nature de la mutation et son emplacement qui vont déterminer les conséquences de ce changement[2]. L’apparition de nouveaux plans d’organisation chez les animaux est donc étroitement liée à l’évolution des GRNs.
Explosion du Cambrien
Les premiers métazoaires sont apparus plusieurs dizaines de millions d’années avant le Cambrien[4]. L’explosion du Cambrien correspond aux premières données fossiles possédant des squelettes minéralisés qui rassemblent la plupart des plans d’organisation des animaux. Cette époque vit apparaître une grande diversification des différents phyla. Tous les métazoaires partagent un ensemble de gènes originel semblable. L’information génétique des caractères partagés par les organismes à l’intérieur d’un phyla se situe dans des structures très stables du GRN. Au contraire, les informations génétiques qui permettent la spécialisation cellulaire fine sont situées dans des structures peu conservées du GRN. De manière générale, le nombre de modules régulateurs conservés diminue avec la distance phylogénétique. Cette diminution n’est pas linéaire, il y a des sauts abrupts qui correspondent le plus souvent aux distances interphyla[5]. Les modules régulateurs des plans d’organisations qui caractérisent les phyla se sont mis en place et ont donné les animaux tels que nous les connaissons aujourd’hui. L'hypothèse la plus souvent mise en avant pour expliquer cette augmentation de la diversité est l'apparition de la prédation. En effet, cette capacité trophique a ouvert les portes de nombreuses niches écologiques alors inoccupées ce qui a favorisé la diversification des organismes[6]. Il est important de garder en mémoire que l’explosion cambrienne fait référence à l’apparition d’une grande diversité génétique et de plans d’organisation. Elle ne s’est pas pour autant déroulée plus rapidement. En effet les processus qui l’ont dirigée, comme la spéciation, la diversification morphologique et l’extinction, se sont déroulés sous l’action de la sélection naturelle. Depuis, des phyla se sont donc diversifiés et d’autres se sont éteints[7] - [8].
L'explosion cambrienne reste un phénomène mal expliqué, mais des mécanismes écologiques ont été mis en avant comme les modifications climatiques (augmentation du taux d’oxygène dans l’atmosphère et les océans), l'activité accrue de prédateurs ou encore les sels marins favorisant l'absorption de substances chimiques et le dépôt de couches dures sur la peau. Mais le développement de squelettes externes (exosquelettes) peut avoir été une réaction adaptative à l'apparition de nouvelles niches écologiques. Le rôle de facteurs environnementaux (oxygène, chimie de l’eau ou climat par exemple) a sans doute été important dans les stades plus précoces de l’évolution des métazoaires, mais semble moins déterminant dans la « révolution écologique » qui s’opère au début du Cambrien.
Après l'explosion cambrienne correspondant à l'éclosion de la plupart des phyla animaux, la radiation ordovicienne s'achève sur une remarquable diversité des niveaux inférieurs de la classification des taxons : ordres, familles, genres et espèces. Cette période est liée à de nombreuses extinctions de masses qui ont impliqué la modification des écosystèmes. En effet, des organismes qui étaient dominés dans un écosystème donné deviennent dominants et inversement. Les trilobites étaient en effet dominants dans l’environnement marin pendant le Cambrien. Or, lors de la radiation ordovicienne les brachiopodes et les échinodermes sont devenus les dominants écologiques de l’écosystème marin[9].
Pressions de sélection environnementales et écologiques
Les scientifiques ont longtemps pensé que le milieu ambiant n’avait pas d’influence sur le développement de l’animal car toute l’ontogenèse était écrite dans les gènes, et que les rares organismes dont le développement était modifié par l’environnement constituaient des exceptions. Or, des études récentes ont démontré le contraire. Les génomes se seraient individualisés en réponse à des facteurs extérieurs[10]. Ce phénomène d'évolution soumis à des contraintes environnementales est appelé Pression de sélection.
Facteurs environnementaux et facteurs écologiques
Les individus sont en effet en interaction constante avec leur milieu où ils sont soumis à la fois aux interactions avec d’autres êtres vivants (facteurs biotiques) mais également aux variables physico-chimiques de l’écosystème (facteurs abiotiques). Ces interactions variables soumettent les animaux à des pressions de sélection. Ces adaptations peuvent être phénotypiques, génétiques et peuvent impliquer une modification de leurs plans d’organisations dans certains cas.
Ainsi, différents facteurs environnementaux et écologiques peuvent avoir été les causes de certains développements des animaux et donc de modification des plans d’organisations.
On peut citer des facteurs environnementaux tels que le taux d’oxygène et la pesanteur; et des facteurs écologiques tels que la prédation et la compétition.
L'azote
D’une manière générale, les différentes formes d'azote dans l’environnement ont affecté l’évolution des animaux. En effet, tout être vivant a besoin d'azote fixé, et parce que c’est si important physiologiquement parlant, les organismes ont développé différents mécanismes pour son absorption et son excrétion. Les mécanismes qui ont évolué pour excréter les déchets azotés diffèrent considérablement selon les organismes et les environnements[11].
Le taux d'oxygène
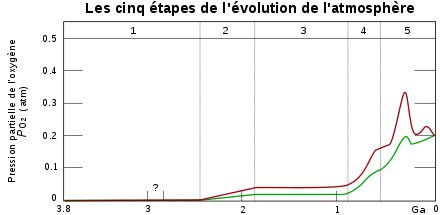
Un niveau bas d’oxygène dans l’atmosphère au Précambrien induit la présence d’organismes métazoaires au développement rapide avec des priorités physiologiques du tissu conjonctif résultant de la demande importante en oxygène dans la biosynthèse d’hydroxyproline de collagène. Coquilles, cuticules et carapaces qui ne sont pas des caractères métazoaires obligatoires mais qui demandent directement ou indirectement du tissu conjonctif collagène substantiel sont coûteux en oxygène et n’étaient donc pas présents au Précambrien. Une importante augmentation dans les niveaux d’oxygène atmosphérique au début du Paléozoïque aurait éliminé les priorités oxygène-collagène induisant des pressions évolutives sur l’élargissement des musculatures et des concrétions (coquilles, carapaces, cuticules) associées. Cela pourrait expliquer la présence soudaine dans les enregistrements fossiles du début du Cambrien de métazoaires avancés et diversifiés, dont les précédentes formes n’étaient peu ou pas du tout conservables[12].
Les fortes teneurs en oxygène dans l’atmosphère auraient également encouragé l’évolution des poumons et l’arrivée des premiers êtres vivants sur le continent (passage de l’eau à la terre) entraînant ainsi différentes évolutions des plans d’organisations des animaux en créant de nouveaux phyla. Une hypothèse supposerait également que l’origine des êtres volants serait liée aux changements de concentration en oxygène dans l’atmosphère[11].
Évolution de la complexité et de la diversité morphologique : le cas de la symétrie
Les différents types de symétrie
Le monde vivant connaît différents types de symétries et de polarité, qui représentent les propriétés géométriques des organismes. Il existe, tout particulièrement chez les métazoaires, une grande variabilité de ces deux paramètres, qui sont impliqués dans le fonctionnement et le développement de l’animal.
Chez les métazoaires à l’état adulte, on retrouve principalement les symétries :
- Cylindrique
- Radiaire
- Bilatérale
Ces symétries peuvent se superposer les unes aux autres, au niveau de la structure interne/externe, comme c’est le cas chez les anthozoaires (cnidaires). En effet, bien que les anthozoaires arborent une symétrie radiaire de manière générale, la présence de deux siphonoglyphes (gouttières longitudinales opposées de la cavité pharyngienne permettant le contrôle de la canalisation du courant d'eau) crée un axe longitudinal, qui ajouté à l'axe oral-aboral de l'animal, forme un plan de symétrie bilatérale non visible de l'extérieur.
Scénario conventionnel de la symétrie des métazoaires

Le scénario conventionnel[13] expliquant le développement de la symétrie chez les métazoaires indique une augmentation graduelle de la complexité dans la symétrie (en) des organismes. Ainsi, la forme adulte des organismes se serait complexifiée à partir d’un état plésiomorphe asymétrique, puis l'apparition d'autres symétries, telles que cylindrique, radiaire, et enfin bilatérale au cours de l’évolution.
Ce scénario est celui qui a été le plus communément admis dans la littérature scientifique. Or, on ne peut pas catégoriser un organisme comme étant plus évolué qu’un autre.
Effet de l’environnement
La symétrie radiaire impliquerait que l’ensemble des structures de l’animal soient fonctionnellement interchangeables, ce qui pourrait être avantageux dans les milieux marins, permettant ainsi de piéger sa nourriture en dérivant dans n'importe quelle direction, de sentir et répondre au danger venant de n'importe laquelle de ces directions. Cette symétrie est une adaptation pour les animaux sessiles (anémones de mer, coraux, benthiques (échinodermes adultes) et pour ceux qui dérivent dans les courants (méduses)[14].
La symétrie bilatérale est acquise il y a 560 millions d'années, comme l'atteste Kimberella, fossile de la faune de l'Édiacarien[15]. Elle est présente chez les bilatériens, au moins à une étape de leur développement dans leur cycle biologique. En effet, cette symétrie implique une locomotion directionnelle due à l’axe antéro-postérieur, et une orientation préférentielle par rapport à la gravité, grâce à l’axe dorso-ventral. Les gènes de développement HOX des bilatériens régulent le développement différencié des organes d'avant en arrière, et leur coordination avec le système nerveux. Ce système permet l'apparition d'une anatomie différenciée, et la coordination opérationnelle de son activité par le traitement de flux d'informations, qui ouvre la voie à une céphalisation évolutive. Les bilatériens seraient ainsi particulièrement adaptés à la vie terrestre, où la gravité est plus fortement ressentie. Certains bilatériens ont cependant perdu secondairement leur capacité à se mouvoir, tout en conservant leur bilatéralité (moules, balanes…)[13].
La céphalisation (réunion d'organes sensoriels dans la région céphalique) est souvent considérée comme une conséquence du développement de la symétrie bilatérale[16]
Effet des gènes
L’ancêtre commun des métazoaires, que l’on pense asymétrique (ou à symétrie cylindrique, selon les théories[13]) avait probablement la majorité des gènes et des voies de signalisation nécessaires à la mise en place des symétries plus complexes que l’on trouve chez les métazoaires actuels. En effet, on retrouve chez les spongiaires (groupe-frère des métazoaires) des voies de signalisation (Wnt, EGF, IGF, Notch/Delta, et Jak/Stat) présents chez de nombreux métazoaires à symétrie complexe.
On les retrouve par exemple chez les bilatériens, lors de la mise en place des axes de symétrie[17]. En effet, dans ce phylum, l’axe dorso-ventral se met en place via la voie Wnt/B-caténine[18], et se termine lors de l’induction du mésoderme par l’endoderme, grâce aux protéines nodal (en)-related. L’axe antéro-postérieur se forme plus tard après la gastrulation grâce à l’organisateur de Spemann. Ce dernier va permettre la régionalisation du mésoderme de manière progressive par des molécules de la famille de BMP. Leur inhibition par des molécules telles que noggin permettent la formation de tissus neuraux, allant de la structure la plus antérieure à la plus postérieure.
Acteurs moléculaires : les gènes homéotiques

Les gènes Hox sont des gènes homéotiques. Ils permettent l’expression d’un facteur de transcription possédant un homéodomaine, pouvant reconnaître spécifiquement la région régulatrice d’un gène. Ils régulent donc la différenciation cellulaire le long de l’axe antéro-postérieur de l’animal. Ils sont très conservés chez les animaux[19], cela explicite donc leur importance particulière dans le bon développement des animaux. En effet, on arrive à retrouver une organisation des gènes Hox très similaire chez des organismes d’apparence très diversifiée, tels que la drosophile (arthropodes), et la souris (vertébrés). De plus, on retrouve également des gènes Hox semblables aux vertébrés chez les cnidaires à symétrie radiale, et non pas uniquement chez les bilatériens[20].
Les gènes Hox impactent l’identité de chaque segment via des gradients d’expression, notamment en fonction de leur position sur le chromosome. L’expression du gène le plus postérieur sur le chromosome prévaut ainsi sur le précédent : c'est la colinéarité. Les gènes Hox sont l’un des principaux acteurs de la mise en place du plan d’organisation et des processus d'organogenèse[21] - [19], de telle façon qu’une grande part des mutations de ces gènes sont létales. Une très grande variabilité de la modulation du niveau d’expression de ces gènes, et des mises en relation des GRN pourraient expliquer les différences structurelles observées, et justifier une telle conservation des gènes du développement au sein du règne animal.
Rôle des gènes homéotiques dans la mise en place d'une structure répétée
La diversité des plans d’organisation ne se limite pas qu’à la symétrie. Les gènes homéotiques interviennent également au niveau des structures répétées, aussi appelées constructions modulaires, ou métamères, chez les bilatériens. Ainsi elles permettent d’attribuer une identité à des segments et à les régionaliser. On peut observer ces métamères de façon particulièrement évidente chez certains arthropodes et les annélides, où chaque anneau correspond à un métamère.
Des mutations ponctuelles telles que la duplication de certains de ces gènes, pourrait expliquer notamment l’élongation et l’augmentation du nombre de métamères et se traduire par l’augmentation de la diversité chez les arthropodes.
La régionalisation des métamères permettrait l’évolution d’un tissu indépendamment des autres. De plus, la modularité autoriserait une variabilité des compartiments dans les limites physiques de l’organisme, au sein des espèces. Cette capacité à générer de la diversité pourrait ainsi conférer un avantage sélectif aux organismes possédant des structures répétées.
Un exemple intégré : le squelette
Le squelette est une structure permettant le maintien de la forme du corps d’un animal. Il peut être interne (endosquelette) comme chez les vertébrés par exemple, ou externe (exosquelette) comme chez les insectes et plus généralement les arthropodes.
D’autres types de squelettes existent également (hydrosquelette).
Afin d’illustrer quelques mécanismes ayant permis l’évolution des plans d’organisation, nous prendrons l’exemple :
- De l’exosquelette pour quelques mécanismes environnementaux
- De l’endosquelette pour un mécanisme génétique
Exosquelette des arthropodes

De récentes découvertes paléontologiques ont permis une avancée dans la compréhension de l’apparition de l’exosquelette. En effet, Diania cactiformis, découverte dans le Cambrien du Yunnan (sud-ouest de la Chine), aurait non seulement des caractéristiques partagées avec le groupe éteint des Lobopodia (son tronc « mou ») ainsi qu'avec celui des arthropodes (ses appendices articulés et probablement sclérifiés)[22]. Des analyses phylogénétiques suggèrent que cette espèce ne peut être catégorisée ni comme un Lobopodien, ni comme un arthropode même si elle se rapprocherait plutôt de la dernière catégorie. L’apparition des appendices articulés de D. cactiformis serait due à la pression exercée par la prédation sur son ancêtre : des appendices protégés auraient conféré un avantage sélectif à son porteur et cette caractéristique se serait ainsi transmise de génération en génération[22]. Chez certains taxons, la sclérification se serait également étendue jusqu’au tronc. L’exosquelette, en plus de conférer un avantage face à la prédation, maintient les organes dans une structure relativement étanche grâce à une cuticule épaisse recouverte de cire et permet ainsi de lutter efficacement contre la dessication[23]. Étant donné que les conditions abiotiques du milieu terrestre (notamment la quantité d’eau) sont très différentes de celles du milieu marin, cette propriété aurait été cruciale pour la sortie des eaux de l’ancêtre des arthropodes terrestres. Une fois sur terre, l’exosquelette aurait également soutenu les différentes structures de l’animal, l’air étant moins porteur que l’eau. L’étanchéité de l'exosquelette aurait également impliqué le passage d’une respiration tégumentaire (directement à travers le tégument) à une respiration trachéenne.
L’exosquelette aurait donc été sélectionné dans un premier temps pour l’avantage sélectif qu’il conférait face à la prédation, puis aurait été conservé chez les arthropodes terrestres pour l’avantage qu’il conférait vis-à-vis des diverses contraintes abiotiques (lutte contre la dessication, maintien des tissus dans un milieu peu porteur)
Chez les insectes, l’exosquelette aurait favorisé l’apparition des ailes, protégées ou non par les élytres. L’apparition de structures permettant le vol auraient permis un accès plus aisé aux ressources ainsi qu’un moyen d’échapper aux prédateurs, conférant ainsi un gain de fitness pour l’individu qui en était pourvu, sélectionnant ainsi ce trait. Les ailes auraient également permis une colonisation rapide du milieu terrestre et seraient également à l’origine de nombreux effets fondateurs (spéciation allopatrique). Cette invention aurait donc facilité l’apparition de nouvelles espèces établies, à long terme, selon des plans d’organisation différents. Cependant, tous les arthropodes ne sont pas pourvus d’ailes. En effet, ces structures étant très gourmandes en énergie et le métabolisme des arthropodes étant faible, on observe un compromis évolutif (trade-off) entre les coûts métaboliques et la réelle utilité des ailes en fonction du mode de vie de l’animal (les chélicérates par exemple sont dépourvus d’ailes mais sont néanmoins munis de chélicères et souvent de venin).
La période du Cambrien a vu naitre des arthropodes bien plus imposants que ceux que l’on connaît aujourd’hui. Deux théories existent afin d’expliquer ce phénomène :
- Au Paléozoïque, l’espace aérien n’était occupé que par les arthropodes, les premiers vertébrés ailés n’ayant pas encore émergé. Ainsi, la prédation était quasiment inexistante dans les airs, ce qui a permis un accroissement de la taille des arthropodes volants par rapport aux arthropodes uniquement terrestres. Cependant, avec l’avènement des premiers vertébrés ailés au Trias (-230Ma), une pression due à la prédation aurait été exercée sur les plus gros arthropodes, proies de choix de par leur taille[24]. Les plus petits individus auraient donc été sélectionnés et un équilibre se serait finalement établi entre la taille des arthropodes non aériens, soumis de tout temps à la prédation, et les arthropodes ailés plus récemment soumis à la prédation[24].
Selon cette théorie, l’effet de la prédation expliquerait l’émergence de nouveaux plans d’organisation.
- L’accroissement de la teneur en oxygène au Carbonifère aurait permis un plus fort métabolisme qui aurait conduit à l’apparition d’individus de tailles plus importantes. La chute de la quantité d’oxygène dans l’atmosphère au Permien/Trias expliquerait la relative petite taille des arthropodes que l’on connaît aujourd’hui. Selon cette théorie, les conditions abiotiques seraient responsables de l’émergence de nouveaux plans d’organisation.
Endosquelette des vertébrés
Au-delà du façonnement des plans d’organisation en fonction des contraintes environnementales vues précédemment à travers l’exemple de l’exosquelette, des contraintes développementales sont également à prendre en compte. Chez la quasi-totalité des mammifères, indépendamment de la taille du cou, on retrouve exactement 7 vertèbres cervicales, alors que le nombre de vertèbres thoraciques et lombaires est variable selon les plans d’organisation. Cette conservation du nombre de vertèbres cervicales n’est pas observée chez les vertébrés non mammaliens (oiseaux et reptiles par exemple)[25]. Une mutation des gènes HOX sur la région codant le nombre de vertèbres cervicales favoriserait le développement de cancers pouvant survenir avant la maturité sexuelle[25]. Ainsi, les individus naissant avec plus ou moins de sept vertèbres cervicales sont contre-sélectionnés et ne transmettront probablement pas cette mutation aux générations suivantes. Cette contrainte historique négative est donc un mécanisme non environnemental qui permettrait d’expliquer le maintien de certains caractères au cours de l’évolution des plans d’organisation.
Notes et références
- (en) Isabelle S. Peter et Eric H. Davidson, « Evolution of Gene Regulatory Networks that Control Embryonic Development of the Body Plan », Cell, vol. 144, 2011 march 18, p. 970-985 (ISSN 0092-8674)
- (en) Douglas H. Erwin et Eric H. Davidson, « The evolution of hierarchical gene regulatory networks », Nature Reviews Genetics 10, , p. 141-148 (ISSN 1471-0056, DOI 10.1038/nrg2499)
- (en) Jiankui He et Michael W. Deem, « Hierarchical evolution of animal body plans », Developmental Biology 337, , p. 157-161 (ISSN 0012-1606, DOI 10.1016/j.ydbio.2009.09.038)
- Neil Campbell (trad. de l'anglais), Biologie, Montréal/Toronto/Paris etc., Pearson, (ISBN 978-2-7613-5065-5), p. 1480
- (en) Ignacio Maeso, Manuel Irimia, Juan J. Tena, Fernando Casares et José Luis Gómez-Skarmeta, « Deep conservation of cis-regulatory elements in metazoans », Philosophical transactions of the Royal Society of London Series B Biological sciences, (ISSN 1471-2970, DOI 10.1098/rstb.2013.0020)
- (en) Charles R. Mashall, « Explaining the Cambrian "Explosion" of animals », Annual Review of Earth Science and Planetary Science,
- (en) Douglas Erwin, James Valentine et David Jablonski, « The Origin of Animal Body Plans », American Scientist,
- (en) Jerry A. Coyne, « Comment on ‘‘Gene Regulatory Networks and the Evolution of Animal Body Plans’’ », Science, vol. 313, no 5788, , p. 761 (ISSN 1095-9203, DOI 10.1126/science.1126454, lire en ligne)
- (en) Mary L. Droser et Seth Finnegan, « The Ordovician Radiation: A Follow-up to the Cambrian Explosion? », Integrative and Comparative Biology, vol. 43, , p. 178–184 (ISSN 1540-7063 et 1557-7023, DOI 10.1093/icb/43.1.178, lire en ligne, consulté le )
- Scott F. Gilbert (trad. de l'anglais), Biologie du développement, Bruxelles/Paris, De Boeck, , 836 p. (ISBN 2-8041-4534-4), p. 721
- (en) Lynn J. Rothschild, Evolution on Planet Earth : Impact of the Physical Environment, Amsterdam/Boston, Academic Press, , 456 p. (ISBN 978-0-12-598655-7)
- (en) Kenneth M. Towe, « Oxygen-Collagen Priority and the Early Metazoan Fossil Record », Proceedings of the National Academy of Sciences of the United States of America, (PMCID PMC282983)
- (en) Michaël Manuel, « Early evolution of symmetry and polarity in metazoan body plans », Comptes Rendus Biologies, vol. 332, no 2, , p. 184-209 (ISSN 1768-3238, PMID 19281951, DOI 10.1016/j.crvi.2008.07.009)
- Anu Singh Cundy et Gary Shin, Découvrir la biologie, De Boeck Superieur, , p. 436.
- (en) M. A. Fedonkin, B. M. Waggoner, « The Late Precambrian fossil Kimberella is a mollusc-like bilaterian organism », Nature, vol. 388, no 6645, , p. 868–871 (DOI 10.1038/42242).
- Peter H Raven, Kenneth A Mason, Georges B Johnson, Jonathan B Losos, Susan R Singer, Biologie, De Boeck Superieur, , p. 641.
- Sylvie Schneider-Maunoury et Patrick Charnay, « La mise en place des axes embryonnaires des vertébrés : un problème fascinant en passe d'être résolu ? », Med Sci, vol. 17, , p. 539–542 (DOI 10.4267/10608/1965, lire en ligne, consulté le )
- (en) Arthur Wallace, Evolution : a developmental approach, Wiley-Blackwell, , 418 p. (ISBN 978-1-4443-9225-8, lire en ligne)
- (en) S. B. Carroll, « Chance and necessity: the evolution of morphological complexity and diversity », Nature, vol. 409, , p. 1102–1109 (ISSN 0028-0836, PMID 11234024, DOI 10.1038/35059227)
- (en) Nicholas H. Putnam, Mansi Srivastava, Uffe Hellsten et Bill Dirks, « Sea anemone genome reveals ancestral eumetazoan gene repertoire and genomic organization », Science (New York, N.Y.), vol. 317, , p. 86–94 (ISSN 1095-9203, PMID 17615350, DOI 10.1126/science.1139158)
- Terence RJ H. Lappin, David G Grier, Alexander Thompson et Henry L Halliday, « HOX GENES : Seductive Science, Mysterious Mechanisms », Ulster Med, vol. 75, (PMCID PMC1891803)
- (en) Jianni Liu, Michael Steiner, Jason A. Dunlop et Helmut Keupp, « An armoured Cambrian lobopodian from China with arthropod-like appendages », Nature, vol. 470, , p. 526–530 (ISSN 0028-0836, DOI 10.1038/nature09704, lire en ligne, consulté le )
- William A. Shear et Jarmila Kukalová-Peck, « The ecology of Paleozoic terrestrial arthropods: the fossil evidence », Canadian Journal of Zoology, vol. 68, , p. 1807–1834 (ISSN 0008-4301, DOI 10.1139/z90-262)
- (en) Delyle Polet, « The Biggest Bugs : An Investigation Into The Factors Controlling The Maximum Size Of Insects », Eureka,
- Yuichi Narita et Shigeru Kuratani, « Evolution of the vertebral formulae in mammals: a perspective on developmental constraints », Journal of Experimental Zoology. Part B, Molecular and Developmental Evolution, vol. 304, , p. 91–106 (ISSN 1552-5007, PMID 15660398, DOI 10.1002/jez.b.21029)