Trifluorure de lanthane
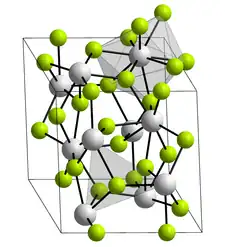
Le trifluorure de lanthane, ou simplement fluorure de lanthane, est un composé chimique de formule LaF3. Il se présente sous la forme d'un solide blanc cristallisé dans le système trigonal selon le groupe d'espace P3c1 (no 165) avec pour paramètres cristallins a = 719 pm, c = 735 pm et Z = 6[4]. Chaque atome de lanthane est entouré de neuf ions fluorure selon une géométrie prismatique trigonale tandis que chaque atome de fluor est coordonné à trois atomes de lanthane selon une géométrie plane trigonale[5]. Il est insoluble dans l'eau, l'acide chlorhydrique et l'acide nitrique, mais se dissout dans l'acide sulfurique concentré avec formation de fluorure d'hydrogène. Sa structure cristalline rhomboédrique sert de référence en cristallographie.
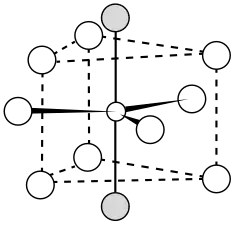 Coordination du lanthane dans LaF3.
Coordination du lanthane dans LaF3.
| Trifluorure de lanthane | |
| |
| __ La3+ __ F− Structure cristalline du fluorure de lanthane(III) |
|
| Identification | |
|---|---|
| Nom UICPA | trifluorolanthane |
| Synonymes |
fluorure de lanthane(III) |
| No CAS | |
| No ECHA | 100.033.851 |
| No CE | 237-252-8 |
| PubChem | 83675 |
| SMILES | |
| InChI | |
| Apparence | solide blanc inodore[1] |
| Propriétés chimiques | |
| Formule | LaF3 |
| Masse molaire[2] | 195,900 68 ± 7,0E−5 g/mol F 29,09 %, La 70,91 %, |
| Propriétés physiques | |
| T° fusion | 1 493 °C[3] |
| Masse volumique | 5,9 g/cm3[3] |
| Cristallographie | |
| Système cristallin | trigonal[4] |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | P3c1 (no 165) [4] |
| Notation Schönflies | S6 (rhomboédrique) |
| Paramètres de maille | a = 719 pm, c = 735 pm, Z = 6[4] |
| Précautions | |
| SGH[1] | |
 Attention |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le fluorure de lanthane peut être obtenu en faisant réagir du nitrate de lanthane La(NO3)3 ou du chlorure de lanthane(III) LaCl3 avec du fluorure d'hydrogène HF :
Il est également possible de faire réagir de l'oxyde de lanthane La2O3 avec du bifluorure d'ammonium NH4HF2 :
Les ions fluorure confèrent au composé une conductivité ionique élevée à haute température car ils sont mobiles dans le cristal à travers les lacunes provenant de défauts de Schottky[6]. Par dopage à l'aide d'un fluorure de métal divalent avec par exemple un contre-ion calcium Ca2+, baryum Ba2+ ou europium Eu2+, la conductivité ionique peut atteindre des valeurs très élevées même à température ambiante.
Le fluorure de lanthane est un précurseur du lanthane pur. À cette fin, l'oxyde de lanthane La2O3 présent dans les minerais de lanthane est converti en fluorure de lanthane par le fluorure d'hydrogène, qui est ensuite réduit sous forme de lanthane métallique à l'aide de calcium ou de magnésium. Il est parfois employé comme composant à indice de réfraction élevé pour éléments optiques multicouches tels que les miroirs ultraviolets dichroïques à bande étroite. Les fluorures sont parmi les composés les plus couramment utilisés pour les revêtements optiques ultraviolets en raison de leur relative inertie et de leur transparence dans l'ultraviolet lointain (FUV), pour les longueurs d'onde comprises entre 100 et 200 nm. Les réflecteurs multicouches et les revêtements antireflet sont généralement composés de paires de matériaux transparents, l'un à faible indice de réfraction, l'autre à indice élevé ; le fluorure de lanthane est l'un des très rares matériaux présentant un indice de réfraction élevé dans l'ultraviolet lointain, d'où son intérêt[7]. C'est également l'un des constituants des verres fluorés (en) ZBLAN (en) contenant des fluorures de zirconium, de baryum, de lanthane, d'aluminium et de sodium. Dopé à l'europium, le fluorure de lanthane est utilisé dans les électrodes sélectives au fluor (en).
Notes et références
- « Fiche du composé Lanthanum(III) fluoride, 99% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, 92e éd., CRC Press, 2011, p. 4.69. (ISBN 1-4398-5511-0)
- (en) A. Zalkin et D. H. Templeton, « Refinement of the trigonal crystal structure of lanthanum trifluoride with neutron diffraction data », Acta Crystallographica Section B, vol. B41, , p. 91-93 (DOI 10.1107/S0108768185001689, lire en ligne)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 87e éd. CRC Press/Taylor and Francis, 2006-2007, p. 6-113. (ISBN 0-8493-0487-3)
- (en) W. L. Fielder, « Ionic conductivity of lanthanum fluoride » [PDF], sur https://ntrs.nasa.gov/, NASA, (consulté le ).
- (en) Luis Rodríguez-de Marcos, Juan I. Larruquert, José A. Méndez et José A. Aznárez, « Multilayers and optical constants of various fluorides in the far UV », Proceedings of the SPIE, vol. 9627, , article no 96270B (DOI 10.1117/12.2191309, Bibcode 2015SPIE.9627E..0BR, S2CID 138737136, lire en ligne)




