Thyroperoxydase
La thyroperoxydase (TPO), également appelée peroxydase thyroïdienne ou thyroïde peroxydase, est une oxydoréductase qui catalyse la première étape de la biosynthèse des hormones thyroïdiennes à partir de la tyrosine, un acide aminé protéinogène[2]. Chez l'Homme, elle est codée par le gène TPO[3]. Son activité est accrue par la thyréostimuline, ou TSH, une hormone sécrétée par l'anté-hypophyse qui stimule l'expression des gènes codant cette enzyme ; elle est inhibée par les thioamides, tels que le propylthiouracile ou le méthimazole[4].
| Thyroperoxydase | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | TPO | |
| Synonymes | TPX | |
| N° EC | 1.11.1.8 | |
| Classification | ||
| Homo sapiens | ||
| Locus | 2p25.3 | |
| Masse moléculaire | 102 963 Da[1] | |
| Nombre de résidus | 933 acides aminés[1] | |
| Entrez | 7173 | |
| HUGO | 12015 | |
| OMIM | 606765 | |
| UniProt | P07202 | |
| RefSeq (ARNm) | NM_000547.5, NM_001206744.1, NM_001206745.1, NM_175719.3, NM_175721.3, NM_175722.3, XM_011510381.2 | |
| RefSeq (protéine) | NP_000538.3, NP_001193673.1, NP_001193674.1, NP_783650.1, NP_783652.1, NP_783653.1, XP_011508683.1 | |
| Ensembl | ENSG00000115705 | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
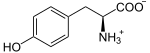
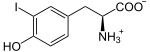
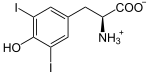
Présente chez tous les chordés, cette enzyme se trouve dans la thyroïde, où elle a pour fonction d'ioder des résidus de tyrosine sur une protéine spécifique, la thyroglobuline, pour y former des résidus de monoiodotyrosine (MIT) et de diiodotyrosine (DIT) :
Plus précisément, les anions iodure I− passent dans la colloïde à travers la membrane apicale des cellules du follicule thyroïdien à l'aide de la pendrine, puis sont oxydés en diiode I2 par la thyroperoxydase, et c'est la molécule I2 qui réagit spontanément avec les résidus tyrosine de la thyroglobuline, sans intervention directe de l'enzyme[5].
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Hème |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Pathologie
La thyroperoxydase est assez souvent identifiée comme cible des auto-anticorps caractéristiques de maladies auto-immunes thyroïdiennes. Ainsi, les anticorps anti-TPO sont impliqués dans la thyroïdite d'Hashimoto.
Usage diagnostique
En immunohistochimie, l'expression de la TPO est éteinte dans le carcinome papillaire de la thyroïde[6].
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Jean Ruf et Pierre Carayon, « Structural and functional aspects of thyroid peroxidase », Archives of Biochemistry and Biophysics, vol. 445, no 2, , p. 269–277 (PMID 16098474, DOI 10.1016/j.abb.2005.06.023, résumé)
- (en) S. Kimura, T. Kotani, O.W. McBride, K. Umeki, K. Hirai, T. Nakayama et S. Ohtaki, « Human thyroid peroxidase: complete cDNA and protein sequence, chromosome mapping, and identification of two alternately spliced mRNAs », PNAS, vol. 84, no 16, , p. 5555-5559 (PMID 3475693, DOI 10.1073/pnas.84.16.5555, lire en ligne)
- (en) Akio Nagasaka et Hiroyoshi Hidaka, « Effect of Antithyroid Agents 6-Propyl-2-Thiouracil and l-Methyl-2-Mercaptoimidazole on Human Thyroid Iodide Peroxidase », Journal of Clinical Endocrinology and Metabolism, vol. 43, no 1, , p. 152-158 (DOI 10.1210/jcem-43-1-152, résumé)
- (en) Jack Kessler, Christian Obinger et Geoff Eales, « Factors Influencing the Study of Peroxidase-Generated Iodine Species and Implications for Thyroglobulin Synthesis », Thyroid, vol. 18, no 7, , p. 769-774 (PMID 18631006, DOI 10.1089/thy.2007.0310, lire en ligne)
- (en) Tanaka T, Umeki K, Yamamoto I, Sugiyama S, Noguchi S, Ohtaki S, « Immunohistochemical loss of thyroid peroxidase in papillary thyroid carcinoma: strong suppression of peroxidase gene expression », J Pathol, vol. 179, no 1, , p. 89-94. (PMID 8691351)