Tétra aveugle
Astyanax mexicanus
_(2687270083).jpg.webp)
Astyanax fasciatus mexicanus
Le tétra aveugle, tétra cavernicole ou tétra mexicain (Astyanax mexicanus) est une espèce de poissons d'eau douce de la famille des Characidés originaire de l'Amérique centrale. Ce poisson, en particulier la forme aveugle, est assez populaire chez les aquariophiles et ses adaptations troglodytiques font l'objet d'études scientifiques.
Description

Atteignant jusqu'à 12 cm de longueur, le tétra mexicain est de type characin tétra, sans particularité et d'une coloration terne. Cependant, sa forme cavernicole est remarquable par l'absence d'yeux et de pigmentation, sans être albinos, sa livrée est juste rose, mais certains individus présentent des reflets violets ou verts. Sa ligne latérale est bien marquée par de petits points noirs.
Comportement
Le tétra mexicain est une espèce grégaire, qui passe le plus clair de son temps à la mi-niveau de l'eau au-dessus des fonds rocheux et sablonneux des rivières et des ruisseaux de son milieu d'origine.
Les populations cavernicoles ont un comportement très différents des populations de surface. Par exemple, une mutation dans une enzyme rend les poissons cavernicoles beaucoup moins agressifs que les poissons de surface[1]. Les poissons cavernicoles ne nagent pas en banc contrairement aux poissons de surface.
Répartition géographique
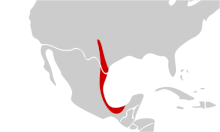
Comme les espèces de son genre Astyanax, il est natif de l'écozone néarctique, originaire du Rio Grande et du Neueces et Pecos, au Texas, ainsi que le centre et l'est du Mexique. Mais la forme aveugle est originaire des grottes et des eaux souterraines de Cueva Chica, dans la province de San Luis Potosi au Mexique.
Écologie et habitat
Venant d'un climat subtropical, la forme de surface préfère l'eau à 6.0-7.8 de pH, d'une dureté jusqu'à 30 DGH, et une température de 20 à 25 °C. En hiver, il migre vers les eaux plus chaudes.
La forme aveugle vit dans des eaux plutôt fraîches et calmes (18-23 °C), dans un milieu dépourvu de lumière, donc de végétation.
Alimentation
Son régime alimentaire naturel se compose de crustacés, d'insectes et d'annélides, mais en captivité, il est omnivore. La forme aveugle possède une dentition bien développée, probablement utilisée afin de dévorer de petits crustacés et insectes à l'exosquelette résistant, très fréquents dans les grottes. Elle se nourrit également de fientes de chauve-souris.
Histoire du Tétra aveugle
Pour certains spécialistes, une souche d'Astyanax mexicanus s'est retrouvée, voilà 500 000 ans, enfermée dans une grotte à la suite d'un glissement de terrain ou un éboulement. Malgré l'absence de lumière, les poissons ont survécu, se sont multipliés et se sont peu à peu adaptés à leurs nouvelles conditions de vie. Ainsi, au fil du temps, leurs yeux inutiles se sont atrophiés, puis ont totalement disparu sans altérer la survie de l'espèce.
La date où la souche qui allait devenir aveugle a été isolée du reste de la population est sujette à discussion chez les spécialistes. Certains évoquent plus d’un million d’années. Une étude récente montre qu'il s'agirait plutôt de moins de 30000 ans[2] - [3].
Caractéristiques associées à la vie en caverne

Plusieurs changements morphologiques et comportementaux sont observés quand on compare les poissons de surface et les poissons qui sont adaptés à la vie en caverne :
- Régression des yeux
- Perte de la pigmentation
- Changement dans la façon de se nourrir. Les poissons qui vivent à la surface se nourrissent en se servant de leur vision pour trouver leurs proies. De plus, ils ont une position de 90° quand ils nourrissent près du sol ce qui les empêche de nager et manger en même temps. Les poissons des cavernes quant à eux, se nourrissent près du sol avec un angle de 75°, ce qui leur permet de nager en même temps que de se nourrir. De plus, cette position leur permet de visualiser une plus grande surface à la fois[4]. Dans la grotte de Tinaja ils se nourrissent de boue contenant des bactéries et à forte teneur en carbone[5].
- Diminution de la partie du cerveau responsable pour interpréter les informations visuelles
- Changement au niveau du crâne
- Augmentations de la grosseur des mâchoires et du nombre de dents
- Augmentation du nombre de papilles gustatives
- Meilleur odorat
- Diminution de la durée du sommeil
- Plus de réserve de gras et une plus grande résistance à la faim
- Augmentation des neuroblastes qui sont des récepteurs sensoriels dans la ligne latéral qui permettent à l'organisme de percevoir la pression et la vitesse de l'eau[6].
- des adaptations métaboliques inhabituelles non présentes chez les individus riverains de leur espèce sont un stock accru de lipides les rendant plus résistants face à des épisodes de famine[7]. Ils consomment aussi moins d'oxygène et ont un taux métabolique plus faible. La déconnexion de leur métabolisme des rythmes circadiens leur permet d'économiser 27% de leur énergie (par rapport à leurs cousins de surface).
L’augmentation de certains caractères comme le nombre de papilles gustatives ou l’odorat peut être un exemple d’hétérométrie compensatoire. Dans ce sens, des caractères sont diminués comme la perte des yeux tandis que d’autres sont augmentés pour compenser ces pertes et améliorer les capacités de survie des poissons. Et in fine les poissons cavernicoles vivent plus de 14 ans, soit autant que leurs cousins de surface (avec en outre moins de signes de dégénérescence des tissus liés à l'âge[7].
Rythme circadien
Astyanax mexicanus, est un modèle évolutionnaire important pour l’étude des processus biologiques, dont le rythme circadien dans la mesure où sa forme ancestral habite la surface de l’eau et coexiste avec des formes isolés habitant les caves. Ceci permet donc une comparaison sur le plan physiologique et moléculaire entre les deux formes de cette espèce de poisson. Le tétra aveugle, étant un poisson de cave, possède des cycles jour/nuit totalement inexistants d’où des rythmes locomoteurs, normalement induits par l’horloge circadienne, absents. Ceci suggère un dysfonctionnement ou une diminution de leur rythme comportemental[8]. L’absence de lumière amène plusieurs difficultés que ce soit au niveau visuel, spatialement ou bien, afin de se reproduire[9]. De plus, les animaux vivants dans un environnement apériodique, comme Astyanax mexicanus, n’ont aucun avantage sélectif à posséder une horloge circadienne fonctionnelle[10]. Il en est de même pour certains mammifères vivant dans les régions polaires, comme le renne arctique dont l'horloge circadienne montre une certaine arythmicité[11]. Le lien entre l’organisme et son environnement n’est important que dans le cas où les cycles environnementaux vont être présents et réguliers. Leur mode de vie amène donc un phénotype portant des caractères dégénératifs comme la perte des yeux et de la pigmentation. En contrepartie, d’autres traits vont être mieux développés comme la sensibilité accrue de l’olfaction et la mécano sensibilité[12]. Jusqu'à maintenant, deux processus évolutifs justifient le phénotype du poisson de cave: Premièrement la sélection naturelle disant que les pertes au niveau du phénotype sont bénéfiques pour l’animal et deuxièmement : la dérive génétique qui amène la régression d’un caractère par l’accumulation de mutations obtenues à travers le temps[13] . Finalement, après plusieurs nouvelles analyses moléculaires, il a été découvert que le poisson de cave portait une activité légèrement plus importante durant la journée. Ceci soulève donc l’hypothèse que le rythme circadien moléculaire du tétra aveugle fonctionne différemment et est indépendant de l’activité motrice ainsi que d’autres output de l’horloge comme le métabolisme[14].
Patron d'expression de Per1
Le répresseur per1 est un élément d'étude important des poissons téléostéens pour le rythme circadien[15], car il fluctue beaucoup et constitue donc un bon marqueur du fonctionnement du rythme circadien. L'activité de per1 chez l'Astyanax mexicanus habitant en profondeur, est partiellement réprimée contrairement aux poissons de surface de la même espèce qui observent une activité normale de per1. Le pic d'activité de ce gène chez le tétra aveugle est plus faible que les poissons de la même espèce vivants en surface et se déclenche même six heures après celui des populations vivant en surface[16]. Ce dysfonctionnement vient notamment de la surexploitation de per2 et Cry1a qui sont des répresseurs transcriptionnels de CLOCK-BMAL1 et qui vont donc réduire l’expression de per1[17]. Une des raisons de la sur-expression de per2 serait que les poissons perçoivent une activité importante de la voie entrée de la lumière ce qui pourrait signifier que le tétra aveugle perçoit des signaux de lumière intense. Or dans les caves, il y a une absence totale de lumière. Une des hypothèses est qu'ils perçoivent l'obscurité comme de la lumière constante et donc cela peut être l'un des facteurs qui pourraient exprimer des niveaux si bas de per1[18]. Il a été prouvé que per2 et Cry1a à-eux deux, ne peuvent pas être les seuls responsables de la faible activité de per1[18], d'autres facteurs doivent jouer, mais sont alors inconnus à ce jour. Le niveau faible d’expression de per1 montre bien un dysfonctionnement de l'horloge circadienne chez Astyanax mexicanus et que dans l’environnement des caves l'oscillation circadienne peut difficilement marcher. De plus l'activation importante anormale de la voie d'entrée de la lumière contribue à l’absence de rythme.
Patron d'expression de Per2
Chez les Astyanax mexicanus vivant en surface tout comme les Astyanax mexicanus vivant dans les caves, le rythme circadien est basé sur l’interaction de boucle de rétroaction. Le gène per2 est notamment impliqué dans une boucle de rétroaction dans laquelle un complexe de gène BMAL1/CLOCK active l’expression des gènes cry et ses isoformes ainsi que per1, per2 et per3. Per2 et cry1a viennent ensuite inhiber le complexe BMAL1/CLOCK, ce qui finit par réprimer leur propre transcription et notamment celle de per1[17]. La différence majeure entre les deux formes de poissons est leur réponse à la lumière. Certains gènes, comme cry1a ou les isoformes per2a et per2b, sont régulés et rythmés par la lumière[19]. Leur niveau d’expression augmente en réponse à la lumière. Néanmoins, le niveau basal d’expression de per2a est clairement plus fort dans l’obscurité complète plutôt que chez les Astyanax mexicanus vivant en surface[20]. Il en est de même pour per2b, chez qui les taux d’expression sont significativement plus élevés chez le tétra aveugle que les poissons en surface malgré l’absence de lumière[18] . Il est ainsi clair que le mécanisme au cœur du rythme circadien est toniquement inhibé en raison de l’activation basale de la voie d’input de la lumière et des isoformes per2b et per2a. L’augmentation du niveau de per2b serait à l’origine de la faible amplitude observée dans le patron d’expression du gène per1. Dès lors, chez le Astyanax mexicanus vivants dans les caves, la voie d’input de la lumière est anormalement suractivée et suggèrent que ces individus vivent dans un état similaire à la luminosité constante plutôt que dans l’obscurité complète.
Rythme circadien chez l'embryon d'Astyanax Mexicanus
D'après certaines manipulations effectuées en laboratoire, Astyanax mexicanus, garde l’habilité de détecter la lumière bien qu’ils évoluent, depuis des millions d’années, dans des conditions d’obscurité constante. Ceci est dû au fait que les embryons portent la capacité de détecter la lumière 1 jour et demi après leur fertilisation grâce à la glande pinéale [21]. Normalement, l’horloge circadienne se met en place lorsque le poisson s’expose à la lumière pour la première fois durant son développement. Or, Astyanax mexicanus ne sera jamais exposé à la lumière, donc on s’attend à ce que les mécanismes initiant leur horloge soient différents de ceux des poissons de surface. En ce qui concerne le rythme du gène per1 chez l’embryon, celui-ci porte une faible amplitude identique à celui chez adulte de cette même espèce et même plus faible comparativement à l’embryon du poisson vivant en surface. En ce qui est de per2b, son expression est la même chez l’embryon que chez l’adulte chez le tétra aveugle. Or, l’expression de per2b sera beaucoup plus importante chez l'embryon l'Astyanax mexicanus que chez l’embryon du poisson en surface malgré le fait que ce gène soit exprimé en réponse à la lumière. Le niveau d’expression de per2b est non seulement fort mais presque maximal ce qui est bizarre puisque normalement celui-ci est exprimé quand il y a présence de lumière. Or, ce phénomène serait dû grâce à une rétroaction négative d’un inhibiteur s’exprimant dans le noir. Une relation antagoniste existe donc entre les activateurs et inhibiteurs qui modulent l’expression des gènes vis-à-vis de la lumière chez Astyanax mexicanus[18].
Adaptations évolutives
La lumière n’active pas seulement des gènes du rythme circadien mais également des gènes impliqués dans la réparation de l’ADN. Le lien très intime entre la lumière, le rythme circadien et la réparation de l’ADN fait l’objet de nombreuses études. Ces systèmes semblent être inter-reliés et indissociables dans la mesure où l’horloge circadienne a évolué de manière à éviter les dégâts d’ADN causé par les rayons UV[22]. La photolyase CPD (CPDphr) et ddb2 (DNA damage binding protein 2), sont tous les deux impliqué dans des mécanismes de réparation de l’ADN et activés par la lumière[17]. Néanmoins, leur niveau d’expression basal est plus fort chez l'Astyanax mexicanus que ceux habitant la surface et ce, pendant tout leur cycle de vie. La situation est similaire aux autres gènes régulés par la lumière, confirmant ainsi que la voie d’activation par la lumière chez ces organismes est largement altérée. L’augmentation de l’expression de ces gènes réparateurs de l’ADN se traduit par ailleurs par l’augmentation du taux d’activité de réparation de l’ADN et un faible niveau de dommage causé à l'ADN[18]. Cette forte capacité à atténuer les dégâts à l’ADN offre des avantages sélectifs à ces organismes vivant dans de telles conditions. Les conditions des caves sont souvent hypoxiques : une absence d’oxygène, ce qui peut représenter un stress pour les poissons[23] peut entraîner des dommages à l’ADN. Or, il a été mis en évidence que la réparation de l’ADN est plus efficace chez Astyanax mexicanus présent dans les caves que les poissons de la même espèce en surface[24]. Dès lors, la voie d’activation constante à la lumière aurait un avantage : en augmentant le potentiel d’activation des gènes réparateurs de l’ADN ce qui aurait pour conséquences de réduire les mutations délétère, cette faculté leur permettrait d’avoir un avantage évolutif malgré leur absence de rythme circadien. Il est a noter également que certaines études soutiennent l’élaboration d'une stratégie qui permettrait à ces poissons de conserver leur énergie. En effet, en éliminant le rythme circadien des processus métaboliques, le tétra aveugle conserve 27% de son énergie comparé au poisson vivant en surface[25].
Tétra aveugle, insuline et diabète
Dans les cavernes ce tétra présente des glycémies anormales et plus élevés que celles ses cousins des rivières de la même espèce, et ils se montrent résistants à l'insuline en raison semble-t-il d'une version mutante du récepteur de l'insuline, codée par le gène insra[7]. Or cette mutation est identique à celle qui chez l'humain cause le diabète et de graves problèmes de santé. Ce poisson est donc utilisé depuis peu comme nouveau modèle animal pour mieux comprendre le diabète[7].
On a déjà montré que chez cette espèce si la copie héréditaire maternelle et paternelle de l'insra présente la mutation, le poisson est insulino-résistant. La résistance à l'insuline est logique, compte tenu de ce que l'on sait de cette mutation chez l'homme, mais le gain de poids est déroutant et inattendu, car l'insuline est aussi une hormone de croissance (Chez l'humains comme chez les rongeurs, le manque d'un récepteur de l'insuline fonctionnel est toujours associée à un retard de croissance et à la maigreur[26].
Des niveaux élevés de glucose sanguin devraient endommager les tissus (si le glucose se lie aux protéines lors d'un processus dit glycation (source de divers troubles ces les diabétiques ; ce n'est pas le cas chez les tétras cavernicoles, grâce à un mécanisme compensatoire non encore élucidé (en )[7]. Comprendre ce mécanisme permettrait peut-être de lutter contre certains effets délétères du diabète[7].
Étude de l'évolution
Les formes de surface et de grotte du Tétra mexicain sont devenues populaires en devenant l'un des principaux sujets pour étudier l'évolution.
Une étude récente suggère qu'il existe au moins deux lignées génétiques entre les populations aveugle, en faisant valoir que ces cas représentent une évolution convergente. Il y aurait au moins 30 populations de Astyanax.
Les populations de tétra de surfaces et de cavernes sont considérées comme étant de la même espèce, car ils peuvent tous se reproduire ensemble. Il y a aussi de la migration entre les populations de surface et des cavernes naturellement dans l’environnement[27].
Hypothèses
Il y a deux hypothèses principales sur la perte des yeux chez les populations d’Astyanax mexicanus qui vivent dans les cavernes :
- L’hypothèse de la mutation neutre dit que la régression des yeux pourrait avoir été causée par une accumulation de mutations dans les gènes qui sont impliqués dans le développement des yeux. Ces mutations seraient apparues à un moment dans la population. En l’absence de pression de sélection purificatrice importante pour garder les yeux, ces mutations auraient pu s’accumuler dans la population et se transmettre de génération en génération par dérive génétique. En effet, dans un environnement sombre avec un taux de mutation assez élevé, les yeux ne sont plus nécessaires et seraient dans ce cas destinés à disparaître[28] - [29].
- L’hypothèse de l’adaptation dit qu’en raison du coût énergétique important que représentent le développement et le maintien des yeux, il pourrait être plus avantageux de ne pas en avoir. Selon cette hypothèse, les individus aveugles auraient de meilleures chances de survie et de se reproduire. Les embryons qui ne produisent pas les yeux seraient aussi favorisés. La régression des yeux peut aussi être causée par pléiotropie (un gène qui contrôle plusieurs traits phénotypiques), ce qui veut dire qu’un autre trait plus bénéfique dans un environnement sombre serait sélectionné et causerait ainsi la réduction du développement des yeux[29].
Les deux hypothèses sont encore sujettes à débat, mais l’hypothèse de l’adaptation semble plus acceptée.
Il a été proposé que les poissons qui naissent en cavernes et peuvent voir finiraient par toujours sortir de la grotte en étant attirés par la lumière. Ceci aurait pour effet d’augmenter la sélection pour la régression des yeux, car les poissons ayant les allèles pour la vision ne participent pas au pool génétique de la prochaine génération[29].
Régression des yeux
Il a été montré que les yeux chez les poissons de cavernes commencent à se développer dans l’embryon, mais le développement est arrêté et ils dégénèrent par apoptose pour finir par n’avoir plus aucune croissance de l’œil chez l’adulte. Dans l’embryon du poisson cavernicole, les parties en développement de l’œil sont plus petites que chez le poisson de surface. Les vésicules optiques et des renflements latéraux sur les deux côtés du cerveau apparaissent de la même façon dans les deux types de Astyanax, ce sont les premiers signes de développement des yeux[28]. La plupart des différences phénotypiques entre l’Astyanax de surface et son dérivé des cavernes apparaissent dans les premières 96 heures de développement[27].
Il y a trois parties de l’œil qui sont d’abord formées. Ces parties sont le cristallin, la rétine et l’épithélium pigmentaire rétinien. Le cristallin provient de la placode cristalline et la rétine et l’épithélium des vésicules optiques. Les vésicules optiques, elles, proviennent de la plaque neurale antérieure et forment la cupule optique. La cupule optique a un côté concave et convexe, car la vésicule optique fait une rotation et un de ses côtés se replie. Le côté concave de la cupule devient la rétine et le côté convexe l’épithélium pigmentaire rétinien. La cupule va s’attacher au cerveau avec le nerf optique. Par la suite, le cristallin va aller se mettre sur le côté concave de la cupule avec la rétine. Il y a ensuite des cellules de la crête neurale qui migrent jusqu'au cristallin et vont former d’autres parties de l’œil comme la cornée et l’iris. La rétine se différencie en trois couches différentes. La première couche est une couche de cellule ganglionnaire qui sert à transmettre les informations au cerveau, la deuxième est composée d’interneurones et de cellules gliales et la dernière est formée de photorécepteurs. Le cristallin se différencie en cellules fibreuses. Jusqu'à ce moment, il n’y a pas de différences majeures entre les poissons de surfaces et de cavernes. Par contre, le cristallin est plus petit et la cupule optique n’a pas sa partie ventrale. La cornée et l’iris ne se forment pas, même si des cellules de la crête neurale migrent vers ses endroits[28] - [30].
La mort cellulaire programmée ou apoptose joue un rôle important dans la dégénération des yeux dans le sens où elle est si importante qu’elle fait disparaître certaines parties de l’œil comme le cristallin, même si la prolifération cellulaire continue. La première partie de l’œil où de l’apoptose est perçue, est le cristallin et elle se voit environ une demi-journée après le début de son développement. On ne voit pas de mort cellulaire chez les poissons de surface. Le cristallin serait le précurseur de la dégénération de l’œil. Un peu de temps plus tard, la rétine aussi commence à subir de l’apoptose surtout dans sa deuxième couche et finalement l’épithélium pigmentaire rétinien est également touché. Ce processus d’apoptose se continue tout au long des stades larvaire et adulte du poisson. À la fin, quand l’apoptose finit par devenir beaucoup plus important que la division cellulaire, le cristallin disparaît totalement et la rétine reste, mais très réduite et finit par ne plus avoir de nouvelles cellules qui s’y forment. Du tissu conjonctif et épithélial envahit et recouvre l’œil dans le stade adulte[28] - [30].
Expérience de la transplantation du cristallin
Lors d'une étude du développement des yeux, de l'Université du Maryland, les scientifiques ont transplanté les cristallins des yeux d'un embryon de la forme de surface dans un embryon de la forme aveugle, et vice versa. Chez la forme aveugle, le développement du cristallin commence dans les 24 premières heures du développement embryonnaire, mais s'arrête rapidement, les cellules du cristallin meurent, la plupart des autres structures de l'œil ne se développent pas. la forme de surface qui a reçu le cristallin de la forme aveugle n'a pas réussi à développer ses yeux, tandis que la forme aveugle qui a reçu le cristallin de la forme de surface a développé des yeux dotés d'une pupille, d'une cornée et d'un iris. (Mais Il n'est pas dit qu'ils possèdent la vue.)
L’expérience de la transplantation du cristallin montre que celui-ci joue un rôle important dans la formation de l’œil. Quand il subit de l’apoptose, il ne peut plus organiser le développement normal de l’œil et la rétine et d’autres structures comme la cornée et l’iris en subissent les conséquences. De plus, la cupule optique conserve sa capacité à répondre aux signaux du cristallin, car elle se développe normalement lorsqu'un cristallin de surface et transplanté dans un œil de caverne. Ces deux structures ont un rôle indirect dans la morphologie du crâne[30].
Au niveau des gènes
Au niveau des gènes, la plupart ne montrent pas de changement en termes de séquence quand les deux types de poissons sont comparés. Les protéines non plus ne semblent pas avoir de changements importants pour ce qui est de l’embryon. Par contre, la différence est que certains gènes chez le poisson cavernicole sont soit sur-exprimés ou sous exprimés quand on les compare aux poissons de surface. Un exemple de gène sur-exprimé est le gène hsp90α dans le cristallin particulièrement. Ce gène favorise la mort cellulaire. Quand il est inhibé en laboratoire le cristallin se différencie normalement. Le gène αA-crystallin quant à lui, est sous exprimé dans le cristallin et il code une protéine qui a comme rôle d’empêcher l’apoptose[30].
Hedgehog
La signalisation Hedgehog a aussi un rôle important dans la dégénération des yeux. Les poissons de cavernes montrent une sur-expression des gènes Hedgehog dans la ligne médiane ventrale des embryons tout au long de leur développement. Ces gènes ont pour fonction dans le développement d’un individu la prolifération cellulaire et la différentiation. Dans une expérience, l’expression des gènes Hedgehog chez les poissons de surface a été augmentée. Les résultats montrent que les poissons avaient des rétines plus petites et des cristallins très réduits ou même absents chez l’adulte. Cette sur-expression n’avait aucun effet sur les autres traits comme la pigmentation et le nombre de dents, mais il y avait plus de papilles gustatives. Dans l’expérience contraire, où les poissons des cavernes étaient traités avec un inhibiteur de la voie Hedgehog (la Cyclopamine), une augmentation de la taille
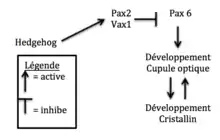
de la rétine et du cristallin comparé au témoin était observée. L’œil n’était tout de fois pas développé complètement comme les poissons de surface. Les gènes Hedgehog ne sont donc pas les seuls responsables pour la perte des yeux[31]. Ce qui se passe, c’est que les gènes Hedgehog produisent des protéines comme Pax2 et Vax1 qui inhibent l’expression de la protéine Pax6. Cette protéine est importante dans le développement des yeux et permet un développement normal. Quand Hedgehog est sur-exprimé dans l’embryon, Pax6 ne peut pas faire le développement normal de l’œil. C’est pour cette raison que la cupule optique perd sa partie ventrale et que d’autres parties de l’œil sont plus petites chez l’embryon du poisson des cavernes. De plus, les gènes Hedgehog ont aussi des effets sur le développement du cerveau. Des parties comme l’hypothalamus et le prosencéphale sont plus gros dans le poisson adapté aux cavernes. Ceci serait causé par une augmentation de la prolifération cellulaire. C’est l’augmentation de l’hypothalamus qui serait en cause pour l’augmentation des papilles gustatives[32].
Perte des pigments
Chez Astyanax mexicanus, il y a trois types de chromatophores (cellules pigmentaires) différents qui sont des cellules dérivées de la crête neurale. Il y a les iridophores qui reflètent la lumière, les xantophores qui sont orange ou jaunes et les mélanophores qui produisent la mélanine qui donne la couleur noire. Ces pigments ont plusieurs rôles. Ils peuvent servir de protection contre les rayons du soleil, de camouflage ou pour la sélection sexuelle. Dans un environnement sombre, ces pigments sont moins nécessaires et la sélection pour les garder est moins importante[30]. Chez les différentes populations de poissons habitant les cavernes, il y a une grande différence de quantité de pigments. Les mélanophores par exemple, sont encore présents chez certaines populations et d’autres n’en ont plus du tout. Certaines populations voient leur production de mélanine très diminuée même si les mélanophores sont encore présents. Leur disparition serait causée elle aussi par la mort cellulaire. Les embryons ont de cellules qui proviennent de la crête neurale qui présente une activité tyrosinase qui est propre aux mélanophores, mais celles-ci ne se différencient pas dans le développement[33]. Un peu comme les yeux le développement des pigments commence normalement, mais il est arrêté et ne se termine pas.
Différences dans le crâne
Le développement du crâne chez le tétra commence par l’apparition d’un chondrocrâne fait de cartilage. C’est lors que cette phase que les os se mettent en place et que la mâchoire se forme. Le chondrocrâne reste symétrique et il n’y a pas de différences majeures qui sont observées quand on le compare avec celui du poisson de surface. Après quatre mois de développement, l’ostéocrâne finalise son développement. C’est dans le poisson adulte avec un ostéocrâne qu’on voit des différences et des asymétries. Ces différences se retrouvent dans les os près des yeux, ce sont des fragmentations et des fusions d’os. Il pourrait y avoir une intrusion des os dans l’orbite du poisson en raison de sa perte d’œil. Certaines différences dans le crâne seraient donc directement liées à la perte des yeux.
Le crâne des poissons de cavernes ne montrait pas seulement des différences au niveau des yeux. Par exemple, ils présentent une courbure sur la face dorsale du crâne. Ce genre de différence n’est pas directement causé par la perte des yeux. Elles sont causées par des changements dans la position pour se nourrir ou l’augmentation et la diminution de certaines parties du cerveau. Les bases et la façon dont ces changements se produisent chez le poisson restent à étudier, mais les neuromastes joueraient un grand rôle dans ce processus. En effet, ces organes sensoriels sont beaucoup plus nombreux dans le crâne des tétras cavernicoles[6].
Différents gènes responsables dans différentes populations
Il existe plusieurs populations de poissons cavernicoles dérivées indépendamment du type de surface. L’évolution des traits adaptés aux cavernes qui sont semblables entre ces populations résulte d’une évolution convergente. L’adaptation aux cavernes résulte de changements convergents et indépendants chez les différentes populations. La perte des yeux a évolué au moins trois fois indépendamment. Il a été trouvé que ces changements n’affectent pas les mêmes gènes ou le même nombre de gènes dans les différentes populations de poissons de caverne[27]. Lors d’une expérience, trois populations différentes de poissons aveugles ont été reproduites ensemble. Il y avait, donc trois types d’hybridation différente. Pour chacune des hybridations, il y avait un certain pourcentage de poissons avec des yeux développés qui pouvait voir. Ceci permet de voir que ce ne sont pas tous les mêmes locus qui sont responsables de la perte des yeux dans les différentes populations[34]. Il y aurait 12 locus différents pour le phénotype des yeux[29]
Plusieurs populations ont été comparées entre elles et des différences dans l’expression des gènes ont été observées. Certaines populations ont plus de gènes sur-exprimés et d’autres, plus de gènes sous exprimés. D'autres gènes avaient été modifiés dans leur expression sensiblement de la même façon dans les différentes populations. Certains gènes sont probablement directement liés et essentiels pour obtenir un phénotype adapté aux cavernes. Finalement, l’adaptation aux environnements sombres se fait par un nombre de gènes restreint. De plus, les poissons ne sont pas tous également adaptés aux cavernes, on dit qu’ils sont plus ou moins troglomophiques. Il y a des populations plus récentes et moins isolées que d’autres. Les populations plus récentes gagnent leurs adaptations plus en régulant leurs gènes à la hausse ou à la baisse, tandis que les populations isolées depuis plus longtemps ont tendance à avoir des mutations qui leur font perdre des fonctions[27]. En évaluant les différentes populations, on voit que les mécanismes pour la perte des yeux dans les populations indépendantes sont sensiblement les mêmes[28].
Le Tétra aveugle et le créationnisme
Le Tétra aveugle du Mexique est différent de sa forme de surface sous beaucoup d'aspects, à part la peau non pigmentée, il possède un meilleur sens olfactif grâce au développement de ses papilles, il est également capable de stocker quatre fois plus d'énergie, ses matières grasses lui permettent de faire face à l'approvisionnement alimentaire irrégulier de manière plus efficace.
Toutefois, l'absence d'yeux a été au centre des discussions entre créationnistes.
Darwin a dit :
"Avec le temps, cet animal est parvenu, après d'innombrables générations, dans les plus profonds recoins, à parfaitement effacer ses yeux devenus inutiles, et la sélection naturelle a souvent touché d'autres changements, tels que l'augmentation de la longueur des antennes ou papilles, en compensation de la cécité. "
-Charles Darwin, L'Origine des espèces (1859)
La génétique moderne a clairement indiqué que l'absence d'utilisation, en elle-même, nécessite une disparition. Les avantages évolutifs possibles obtenus par le Tétra cavernicole en perdant ses yeux comprennent :
- Le non-développement des yeux permet à l'individu de consacrer plus d'énergie à la croissance et la reproduction.
- Moins de chances d'infection et de dommages accidentels, car précédemment exposés, l'organe inutile est scellé avec un rabat de peau le protégeant.
D'après les créationnistes, le Tétra aveugle est considéré comme une preuve contre l'évolution. Un argument affirme qu'il s'agit d'une instance de "dévolution" - montrant que l'évolution se contredit. Mais l'évolution est un processus non-directionnel, et tout augmentation de la complexité est commune, il n'y a aucune raison que l'évolution ne puisse tendre vers la simplicité, si finalement, un organisme s'adapte à son environnement.
Maintenance en aquarium

Ce Tétra atteint jusqu'à 12 cm de longueur, il est donc conseillé de ne pas le maintenir dans un aquarium de moins de 100 litres. C'est toutefois une espèce assez robuste. Ce n'est pas un poisson exigeant maintenu dans de bonnes conditions, il peut vivre très longtemps, atteignant pour certains l'âge de onze ans en aquarium.
Il est possible de trouver les deux formes en magasin, par conséquent, ils pourront sans aucun problème être maintenus en banc et mélangés créant ainsi un aquarium régional.
Forme aveugle
La forme aveugle peut vivre en aquarium communautaire, bien que certains l'estiment trop fragile ou exigeant par rapport à la lumière et préfèrent le maintenir en bac spécifique. En effet, en présence d'un lumière trop vive, sa livrée a tendance à s'assombrir. Ils ne sont pas pointilleux sur la nourriture, ils s'accommodent de la nourriture aquariophile standard (flocons, paillettes). Mais afin d'équilibrer son régime, un apport de nourriture végétale comme de la salade pochée est bienvenu. Le Tétra aveugle n'a aucun problème pour détecter la nourriture avant qu'elle ne touche le fond. Ils préfèrent un aquarium à la lumière tamisée, avec un substrat rocheux (gravier, roches...) et très peu de végétation. Il est recommandé que l'aquarium imite leur environnement naturel, de façon artificielle ou naturelle. Il est conseillé de maintenir la forme aveugle en groupe de 8 individus, ce qui facilite la prise de nourriture. En effet lors de l'alimentation le banc entier de poissons se déplace, guidés par leurs lignes latérales, les uns entraînés par les autres. Ils sont incroyablement rapides, les attraper avec l'épuisette n'est pas évident.
Vous pourrez l'associer à d'autres tétras, ainsi qu'avec des cichlidés nains, comme des ramirezi ou des Apistogramma. D'autres mélanges sont possibles comme avec des platys, des danios ou des barbus, mais évitez les poissons trop calmes comme les scalaires.
| Origine | Amérique centrale | Eau | Eau douce |
|---|---|---|---|
| Dureté de l'eau | 10-20 °GH | pH | 6,0-7,0 |
| Température | Entre 18 et 23 °C | Volume mini. | 100 L |
| Alimentation | Omnivore | Taille adulte | De 9 à 12 cm |
| Reproduction | ovipare | Zone occupée | Milieu & Inférieure |
| Sociabilité | Bonne | Difficulté | facile |
Forme de surface
| Origine | Amérique centrale | Eau | Eau douce |
|---|---|---|---|
| Dureté de l'eau | 10-30 °GH | pH | 6.0-7.8 |
| Température | Entre 23 et 26 °C | Volume mini. | 100 L |
| Alimentation | Omnivore | Taille adulte | De 9 à 12 cm |
| Reproduction | ovipare | Zone occupée | Milieu |
| Sociabilité | Bonne | Difficulté | facile |
Reproduction
Comme le Tétra aveugle et le Tétra mexicain sont issus de la même souche, la reproduction est possible. Mais des cas malheureux de reproduction ont été observés: la progéniture obtenue sera un mélange dégénérescent des deux groupes. Ces poissons auront, s'il survivent au stade d'alvins, une vie très courte, avec différents problèmes de malformations et de non-alimentation.
Ovipare. La reproduction est assez délicate à réaliser car elle nécessite des conditions particulières. Il faut une température de 18 à 20 °C. Les jeunes éclosent au bout de 2 à 3 jours et nagent librement à partir du sixième jour. Le dimorphisme sexuel se caractérise par le ventre plus rebondi chez la femelle.
Annexes
Articles connexes
Liens externes
Espèce Astyanax mexicanus
- (fr) Référence Aquabase : Astyanax mexicanus
- (en) Référence Catalogue of Life : Astyanax mexicanus (De Filippi, 1853) (consulté le )
- (fr+en) Référence FishBase :
- (fr+en) Référence ITIS : Astyanax mexicanus (De Filippi, 1853)
- (en) Référence Animal Diversity Web : Astyanax mexicanus
- (en) Référence UICN : espèce Astyanax mexicanus De Filippi, 1853 (consulté le )
- (en) Référence NCBI : Astyanax mexicanus (taxons inclus)
- (en) Référence Fonds documentaire ARKive : Astyanax mexicanus
Sous-espèce Astyanax fasciatus mexicanus
- (fr) Référence Catalogue of Life : Astyanax fasciatus mexicanus (non Filippi, 1853) Non Valide
- (en) Référence Catalogue of Life : Astyanax jordani (Hubbs & Innes, 1936) (consulté le )
- (fr+en) Référence ITIS : Astyanax fasciatus mexicanus (De Filippi, 1853) Non valide
- (fr+en) Référence ITIS : Astyanax mexicanus (De Filippi, 1853)
- (en) Référence Animal Diversity Web : Astyanax fasciatus mexicanus
Références
- Yannick Elipot, Hélène Hinaux, Jacques Callebert et Jean-Marie Launay, « A mutation in the enzyme monoamine oxidase explains part of the Astyanax cavefish behavioural syndrome », Nature Communications, vol. 5, (DOI 10.1038/ncomms4647, lire en ligne)
- « Poissons mexicains : une fenêtre sur l'évolution », sur CNRS Le journal (consulté le ).
- Julien Fumey, Hélène Hinaux, Céline Noirot et Claude Thermes, « Evidence for late Pleistocene origin of Astyanax mexicanus cavefish », BMC Evolutionary Biology, vol. 18, , p. 43 (ISSN 1471-2148, PMID 29665771, PMCID PMC5905186, DOI 10.1186/s12862-018-1156-7, lire en ligne, consulté le )
- (en) Wilkens Horst, « Genetics and hybridization in surface and cave Astyanax (Teleostei): a comparison of regressive and constructive traits », Biological Journal of the Linnean Society, , p. 911-928
- Simon, V., Elleboode, R., Mahé, K., Legendre, L., Ornelas-Garcia, P., Espinasa, L., & Rétaux, S. (2017). https://evodevojournal.biomedcentral.com/articles/10.1186/s13227-017-0086-6 Comparing growth in surface and cave morphs of the species Astyanax mexicanus: insights from scales. EvoDevo, 8(1), 23.
- (en) Amanda K. Powers, « Cranial asymmetry arises later in the life history of the blind Mexican cavefish, Astyanax mexicanus », PLOS ONE,
- Rétaux Sylvie (2018) " The healthy diabetic cavefish conundrum", Nature, 21 mars ; Nature 555, 595-597
- (en) T. L. Poulson et W. B. White, « The Cave Environment », Science, vol. 165, no 3897, , p. 971–981 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.165.3897.971, lire en ligne, consulté le )
- (en) Culver, David C., 1944- et White, William B. (William Blaine), 1934-, Encyclopedia of caves, Waltham, MA, Elsevier/Academic Press, (ISBN 978-0-12-383832-2, 0-12-383832-0 et 978-0-12-383833-9, OCLC 776633368, lire en ligne)
- (en) Saurabh Sharma, Sheryl Coombs, Paul Patton et Theresa Burt de Perera, « The function of wall-following behaviors in the Mexican blind cavefish and a sighted relative, the Mexican tetra (Astyanax) », Journal of Comparative Physiology A, vol. 195, no 3, , p. 225–240 (ISSN 0340-7594 et 1432-1351, DOI 10.1007/s00359-008-0400-9, lire en ligne, consulté le )
- (en) Matthew J. Paul et William J. Schwartz, « Circadian Rhythms: How Does a Reindeer Tell Time? », Current Biology, vol. 20, no 6, , R280–R282 (ISSN 0960-9822, PMID 20334837, DOI 10.1016/j.cub.2010.02.008, lire en ligne, consulté le )
- Joshua B. Gross, « The complex origin of Astyanax cavefish », BMC Evolutionary Biology, vol. 12, no 1, , p. 105 (ISSN 1471-2148, PMID 22747496, PMCID PMC3464594, DOI 10.1186/1471-2148-12-105, lire en ligne, consulté le )
- (en) William R. Jeffery, « Regressive Evolution in Astyanax Cavefish », Annual Review of Genetics, vol. 43, no 1, , p. 25–47 (ISSN 0066-4197 et 1545-2948, DOI 10.1146/annurev-genet-102108-134216, lire en ligne, consulté le )
- (en) H Wilkens, « Genes, modules and the evolution of cave fish », Heredity, vol. 105, no 5, , p. 413–422 (ISSN 0018-067X et 1365-2540, DOI 10.1038/hdy.2009.184, lire en ligne, consulté le )
- Ji-Gweon Park, Yong-Ju Park, Nozomi Sugama et Se-Jae Kim, « Molecular cloning and daily variations of the Period gene in a reef fish Siganus guttatus », Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology, vol. 193, no 4, , p. 403–411 (ISSN 0340-7594, PMID 17393198, DOI 10.1007/s00359-006-0194-6, lire en ligne, consulté le )
- Inga A. Frøland Steindal, Andrew D. Beale, Yoshiyuki Yamamoto et David Whitmore, « Development of the Astyanax mexicanus circadian clock and non-visual light responses », Developmental Biology, vol. 441, no 2, 09 15, 2018, p. 345–354 (ISSN 1095-564X, PMID 29909064, PMCID 6141809, DOI 10.1016/j.ydbio.2018.06.008, lire en ligne, consulté le )
- T. Katherine Tamai, Lucy C. Young et David Whitmore, « Light signaling to the zebrafish circadian clock by Cryptochrome 1a », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 37, , p. 14712–14717 (ISSN 0027-8424, PMID 17785416, PMCID 1976231, DOI 10.1073/pnas.0704588104, lire en ligne, consulté le )
- Andrew Beale, Christophe Guibal, T. Katherine Tamai et Linda Klotz, « Circadian rhythms in Mexican blind cavefish Astyanax mexicanus in the lab and in the field », Nature Communications, vol. 4, , p. 2769 (ISSN 2041-1723, PMID 24225650, DOI 10.1038/ncomms3769, lire en ligne, consulté le )
- (en) Philipp Mracek, Cristina Santoriello, M. Laura Idda et Cristina Pagano, « Regulation of per and cry Genes Reveals a Central Role for the D-Box Enhancer in Light-Dependent Gene Expression », PLOS ONE, vol. 7, no 12, , e51278 (ISSN 1932-6203, PMID 23236462, PMCID PMC3516543, DOI 10.1371/journal.pone.0051278, lire en ligne, consulté le )
- Inga A. Frøland Steindal, Andrew D. Beale, Yoshiyuki Yamamoto et David Whitmore, « Development of the Astyanax mexicanus circadian clock and non-visual light responses », Developmental Biology, cavefish Development, vol. 441, no 2, , p. 345–354 (ISSN 0012-1606, PMID 29909064, PMCID PMC6141809, DOI 10.1016/j.ydbio.2018.06.008, lire en ligne, consulté le )
- (en) M. Yoshizawa et W. R. Jeffery, « Shadow response in the blind cavefish Astyanax reveals conservation of a functional pineal eye », Journal of Experimental Biology, vol. 211, no 3, , p. 292–299 (ISSN 0022-0949 et 1477-9145, PMID 18203983, PMCID PMC3584714, DOI 10.1242/jeb.012864, lire en ligne, consulté le )
- (en) Kevin J. Emerson, William E. Bradshaw et Christina M. Holzapfel, « Concordance of the Circadian Clock with the Environment Is Necessary to Maximize Fitness in Natural Populations », Evolution, vol. 62, no 4, , p. 979–983 (ISSN 1558-5646, PMID 18194469, PMCID PMC4288752, DOI 10.1111/j.1558-5646.2008.00324.x, lire en ligne, consulté le )
- Mohsen Abdel-Tawwab, Mohamed N. Monier, Seyed Hossein Hoseinifar et Caterina Faggio, « Fish response to hypoxia stress: growth, physiological, and immunological biomarkers », Fish Physiology and Biochemistry, vol. 45, no 3, , p. 997–1013 (ISSN 1573-5168, PMID 30715663, DOI 10.1007/s10695-019-00614-9, lire en ligne, consulté le )
- Sanaa A. Mustafa, Sherain N. Al-Subiai, Simon J. Davies et Awadhesh N. Jha, « Hypoxia-induced oxidative DNA damage links with higher level biological effects including specific growth rate in common carp, Cyprinus carpio L », Ecotoxicology (London, England), vol. 20, no 6, , p. 1455–1466 (ISSN 1573-3017, PMID 21656038, DOI 10.1007/s10646-011-0702-5, lire en ligne, consulté le )
- (en) Damian Moran, Rowan Softley et Eric J. Warrant, « Eyeless Mexican Cavefish Save Energy by Eliminating the Circadian Rhythm in Metabolism », PLOS ONE, vol. 9, no 9, , e107877 (ISSN 1932-6203, PMID 25251018, PMCID PMC4176717, DOI 10.1371/journal.pone.0107877, lire en ligne, consulté le )
- Savage D.B & Semple R.K (2010) Recent insights into fatty liver, metabolic dyslipidaemia and their links to insulin resistance. Current opinion in lipidology, 21(4), 329-336|résumé ;
- (en) Bethany A. Stahl, « Comparative Transcriptomic Analysis of Development in Two Astyanax Cavefish Populations », Journal of Experimental Zoology (Mol. Dev. Evol.), , p. 515-532
- (en) William R. Jeffery, « Adaptative evolution of eye degeneration in the Mexican blind cavefish », Journal of Heredity, , p. 185-196
- (en) Reed A. Cartwright, « The importance of selection in the evolution of blindness in cavefish », BMC Evolutionary Biology,
- (en) William R. Jeffery, « Evolution and developpement in the cavefish Astyanax », Current topic in developpemental biology, , p. 191-221
- (en) Yoshiyuki Yamamoto, « Hedgehog signaling controls eye degeneration in blind cavefish », Nature, , p. 844-847
- (en) Arnaud Menuet, « Expanded expression of Sonic Hedgehog in Astyanax cavefish: multiple consequences on forebrain developpement and evolution », Developpement, , p. 845-855
- (en) David W. McCauley, « Evolution of pigment cell régression in the cavefish Astyanax: a late step in melanogenesis », Evolution et Development, , p. 209-218
- (en) Richard Borowsky, « Restoring sight in blind cavefish », Current Biology,