Picoline
La picoline ou méthylpyridine est un composé aromatique hétérocyclique de formule brute C6H7N. Elle est constituée d'un noyau pyridique substitué par un groupe méthyle, et existe sous la forme de trois isomères en fonction de la position relative du groupe méthyle sur le cycle par rapport à l'atome d'azote.
Propriétés
| Picoline | |||
| Nom | 2-Méthylpyridine | 3-Méthylpyridine | 4-Méthylpyridine |
| Autres noms | 2-picoline α-picoline o-picoline orthopicoline |
3-picoline β-picoline m-picoline métapicoline |
4-picoline γ-picoline p-picoline parapicoline |
| Formule structurelle | 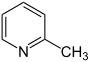 |
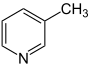 |
|
| Numéro CAS | |||
| (mélange) | |||
| PubChem | 7975 | 7970 | 7962 |
| Formule brute | C6H7N | ||
| Masse molaire | 93,13 g mol−1 | ||
| État (CNTP) | liquide | ||
| Apparence | liquide incolore odeur désagréable et âcre[1] |
liquide incolore à jaunâtre[2] |
liquide jaunâtre odeur de pyridine[3] |
| Point de fusion | −70 °C[1] | −18 °C[2] | 3 °C[3] |
| Point d'ébullition | 128 °C[1] | 144 °C[2] | 145 °C[3] |
| Masse volumique (20 °C) | 0,94 g·cm-3[1] | 0,96 g·cm-3[2] | 0,96 g·cm-3[3] |
| Pression de vapeur saturante (20 °C) |
12 hPa[1] | 5,9 hPa[2] | 5,8 hPa[3] |
| Point d'éclair | 27 °C (coupelle fermée)[1] | 36 °C (coupelle fermée)[2] | 39 °C (coupelle fermée)[3] |
| Point d'auto-inflammation | 535 °C[1] | >500 °C[3] | |
| Limites d'explosivité | 1,4-8,6 vol.% 54-330 g/m³[1] |
1,3-8,7 vol.% 55-335 g/m³[2] |
1,3-8,7 vol.% 50-335 g/m³[3] |
| Solubilité dans l'eau | soluble[1] - [2] - [3] | ||
| pKA[4] (de l'acide conjugué BH+) |
5,94 | 5,63 | 6,03 |
| LogP | 1,11[1] | 1,2[2] | 1,22[3] |
| SGH |   Danger[1] - [2] - [3] | ||
| Phrases H et P[1] - [2] - [3] | H226, H302 et H311 H319, H332 et H335 |
H226, H302 et H311 H314 et H332 |
H226, H311 et H302+H332 H315, H319 et H335 |
| P261 et P280.3 P312 et P305+P351+P338 |
– | P210, P280 et P302+P352 P305+P351+P338 et P308+P310 | |
Les picolines sont des liquides incolores qui ont une odeur similaire à celle de la pyridine. Elles sont miscibles avec l'eau, l'éthanol et l'éther diéthylique[5]. Les trois isomères ont des points de fusion très éloignés, respectivement -70, -18, et 3 °C, mais de points d'ébullition relativement proches.
Comme dans la 2- et la 4-picoline, les groupes méthyle sont directement conjugués à l'atome d'azote électroattracteur, les groupes méthyle de ces deux isomères peuvent être relativement facilement déprotonés par des bases fortes comme le diisopropylamidure de lithium ou le butyllithium, puis substitués[6].
Synthèse
De nos jours, la 2-picoline est produite principalement par deux voies synthétiques : la condensation de l'acétaldéhyde ou du formaldéhyde et de l'ammoniac[7], ou bien par cyclisation de nitriles et de l'acétylène (cyclisation de Bönnemann)[8]. Ci-dessous l'exemple de la réaction entre l'acétaldéhyde et l'ammoniac :
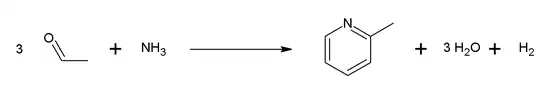
Environ 8 000 tones ont été produites dans le monde en 1989[7].
La 3-méthylpyridine peut elle être préparée en faisant réagir l'acroléine avec de l'ammoniac[7] :
mais méthode plus efficace utilise l'acroléine, du propanal et de l'ammoniac :
Environ 9 000 tones en ont été produites dans le monde en 1989[9].
Utilisation
Les trois isomères ont des propriétés assez similaires à celle de la pyridine dans leurs propriétés et peuvent facilement la remplacer dans des applications où la structure moléculaire exacte n'est pas importante, par exemple comme solvants. Ils servent sinon de base de synthèse pour les produits pharmaceutiques et agrochimiques et la production de colorants[5].
On peut citer par exemple la 2-vinylpyridine et la nitrapyrine, un produit agrochimique, qui peuvent être produites à partir de la 2-picoline[7]. La 3-picoline peut elle être utilisée comme matière première pour la synthèse du chlorpyrifos et de la niacine[7], et la 4-picoline est utilisée pour produire l'agent antituberculeux isoniazide[7].
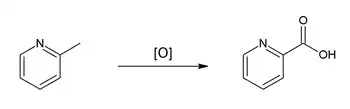
L'oxydation des picolines, par exemple au moyen de permanganate de potassium (KMnO4)[7] - [10], produit les équivalents acides carboxyliques, respectivement l'acide picolinique, l'acide nicotinique et l'acide isonicotinique.
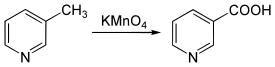
Environnement
Les picolines sont plus volatiles et se dégradent plus lentement que leurs homologues acides carboxyliques. La volatilisation est beaucoup moins importante dans le sol que dans l'eau, en raison de la sorption des composés sur les argiles du sol et la matière organique[11]. La dégradation des picolines semble être principalement médiée par des bactéries, la majorité des isolats appartenant aux actinobactéries. La 3-méthylpyridine se dégrade plus lentement que les deux autres isomères, probablement en raison de l'impact de la résonance dans le noyau hétérocyclique. Comme la plupart des dérivés simples de la pyridine, les picolines contiennent plus d'azote que nécessaire pour la croissance des micro-organismes, et l'excès d'azote est généralement excrété dans l'environnement sous forme d'ammonium au cours du processus de dégradation[12].
Histoire
La picoline est isolée pour la première, sous forme impure, en 1826 par le chimiste allemand Otto Unverdorben (1806 – 1873), qui l'obtient par pyrolyse d'os[13] et la nomme « Odorin » du fait de son odeur désagréable[14]. En 1849, le chimiste écossais Thomas Anderson (1819 – 1874) prépare de la picoline pure à partir du goudron de houille et par pyrolyse d'os[15] - [16]. Anderson la nomme alors « picoline » par combinaison des mots latins pix (goudron) et oleum (huile), l'huile de goudron de houille étant la matière dont il l'avait extraite[17] - [18]. Vers 1870, le chimiste allemand Adolf von Baeyer synthétise la picoline de deux façons : par distillation sèche de l'« acroleïnammoniak » (CH2=CH-CH=N-CHOH-CH=CH2)[19], et par chauffage du « tribromallyl » (1,2,3-tribromopropane) avec de l'ammoniac dans l'éthanol[20].
En 1871, le chimiste et physicien anglais James Dewar pose l'hypothèse que la picoline est la méthylpyridine[21]. Or, si la structure de la pyridine proposée par le chimiste garmano-italien Wilhelm Körner en 1869 est correcte, c'est-à-dire que la pyridine est un analogue du benzène (un cycle hexagonal avec alternance de liaisons simples et doubles)[22], cela signifie qu'il existe trois isomères de la methylpyridine. Vers 1879, le chimiste autrichien Hugo Weidel parvient à isoler et caractériser trois isomères de la picoline, qu'il nomme α–, β–, and γ–picoline[23], l'α–picoline étant le principal composant de la picoline impure, accompagnée de petites quantités de β–picoline, et la γ–picoline pouvant être obtenue par la distillation sèche de Baeyer de l'acroleïnammoniak.
Weidel fait ensuite subir à chaque isomère de la picoline une oxydation par le permanganate de potassium, les transformant chacun en acide carboxylique. Il appelle alors la forme acide de l' α–picoline Picolinsäure (acide picolinique)[24]. Il reconnait dans la fome acide de la β–picoline la Nicotinsäure (la niacine ou acide nicotinique)[25], composé qu'il avait découvert en 1873[26].
Lorsque Weidel decarboxyle la forme acide carboxylique de chaque isomère – par distillation sèche de leur sel de calcium avec de l'oxyde de calcium –, il obtient de la pyridine, montrant ainsi que la picoline était un mélange des trois isomères de la méthylpyridine, comme il l'espérait[27]. Cependant, Weidel n'a jamais détreminé pour aucun des isomères la position du groupe méthyle par rapport à l'atome d'azote du noyau pyridique[28] La structure de la niacine, et ainsi celle de la β–picoline, fut déterminée en 1883 lorsque le chimiste tchéquo-autichien Zdenko Skraup et Albert Cobenzl oxydèrent de façon répétée la β–naphtoquinoline et trouvèrent de la niacine parmi les produits, prouvant ainsi que la β–picoline était la 3-méthylpyridine[29].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Picoline » (voir la liste des auteurs) et en allemand « Picoline » (voir la liste des auteurs).
- Entrée « 2-Picoline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-01-02 (JavaScript nécessaire).
- Entrée « 2-Picoline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-01-02 (JavaScript nécessaire).
- Entrée « 4-Picoline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-01-02 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- (de) « Methylpyridine », sur Römpp Online, Georg Thieme Verlag (consulté le )
- M. Sainsbury, M. Berry, J. D. Hepworth, C. Drayton, E. W. Abel, D Phillips, J. D. Woollins, A. G. Davies, Heterocyclic Chemistry, Royal Society of Chemistry, , 1re éd. (ISBN 0-85404-652-6), p. 30
- (en) Shinkichi Shimizu, Nanao Watanabe, Toshiaki Kataoka, Takayuki Shoji, Nobuyuki Abe, Sinji Morishita et Hisao Ichimura, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a22_399), « Pyridine and Pyridine Derivatives ».
- (de) A. Behr, Angewandte homogene Katalyse, Weinheim, Wiley-VCH, (ISBN 3-527-31666-3), p. 722
- (en) Eric F. V. Scriven et Ramiah Murugan, Kirk-Othmer Encyclopedia of Chemical Technology, XLI, (DOI 10.1002/0471238961.1625180919031809.a01.pub2), « Pyridine and Pyridine Derivatives ».
- (de) Harold Hart, Leslie E. Craine, David J. Hart, Christopher M. Hadad et al., Organische Chemie, Weinheim, Wiley-VCH, , 3e éd. (ISBN 978-3-527-31801-8), p. 494
- G. K. Sims et L.E. Sommers, « Degradation of pyridine derivatives in soil », J. Environmental Quality, vol. 14, no 4, , p. 580–584 (DOI 10.2134/jeq1985.00472425001400040022x)
- G. K. Sims et L.E. Sommers, « Biodegradation of pyridine derivatives in soil suspensions », Environmental Toxicology and Chemistry, vol. 5, no 6, , p. 503–509 (DOI 10.1002/etc.5620050601)
- Pour l'histoire des premières recherches sur la picoline, voir :
- Handbook of Chemistry, vol. vol. 11, London, England, Cavendish Society, , 263–272 p. (lire en ligne)
- (de) Neues Handwörterbuch der Chemie [« New Dictionary of Chemistry »], vol. vol. 5, Braunschweig, Germany, Friedrich Vieweg und Sohn, , 575–584 p. (lire en ligne)
- (de) Arthur Calm et Karl Buchka, Die Chemie des Pyridins und seiner Derivate [« The Chemistry of Pyridine and its Derivatives »], Braunschweig, Germany, Friedrich Wieweg und Sohn, 1889–1891, 62–68 p. (lire en ligne)
- (de) Richard Wolffenstein, Die Pflanzenalkaloide [« The plant alkaloids »], Berlin, Germany, Julius Springer, , 40–42 p. (ISBN 9783642924491, lire en ligne)
- (de) Otto Unverdorben, « Ueber das Verhalten der organischen Körper in höheren Temperaturen » [« On the behavior of organic substances at high temperatures »], Annalen der Physik und Chemie, vol. 8, , p. 253–265 ; 477–487 (lire en ligne) Unverdorben named picoline Odorin on p. 255.
- Thomas Anderson, « On the constitution and properties of picoline, a new organic base from coal-tar », Transactions of the Royal Society of Edinburgh, vol. 16, no 2, , p. 123–136 (DOI 10.1017/S0080456800024984, lire en ligne)
- Thomas Anderson, « On the products of the destructive distillation of animal substances. Part I. », Transactions of the Royal Society of Edinburgh, vol. 16, no 4, , p. 463–474 (DOI 10.1017/s0080456800022432, lire en ligne)
- (Anderson,1849), p. 124.
- (Fehling & Hell, 1890), p. 575.
- (Wolffenstein, 1922), p. 42.
- (de) Adolf Baeyer, « Untersuchungen über die Basen der Pyridin- und Chinolinreihe. I. Ueber die Synthese des Picolins » [« Investigations into the bases of the pyridine and quinoline series. I. On the synthesis of picoline »], Annalen der Chemie und Pharmacie, vol. 155, no 3, , p. 281–294 (DOI 10.1002/jlac.18701550304, lire en ligne)
- James Dewar, « On the oxidation products of picoline », Chemical News, vol. 23, , p. 38–41 (lire en ligne) From p. 40: "If we consider picoline as in all likelihood methylpyridine, … "
- W. Koerner, « Synthèse d'une base isomère à la toluidine », Giornale di Scienze Naturali ed Economiche (Journal of Natural Science and Economics (Palermo, Italy)), vol. 5, , p. 111–114 (lire en ligne)
- (de) H. Weidel, « Studien über Verbindungen aus dem animalischen Theer » [« Sur l'étude des composés du goudron animal »], Berichte der Deutschen Chemischen Gesellschaft, vol. 12, no 2, , p. 1989–2012 (DOI 10.1002/cber.187901202207, lire en ligne) p. 2008: « Eine vollständige Trennung gelingt nur durch die Platindoppelsalze. Das des α-Picolins (wie ich es nennen will) ist schwerer löslich als jenes des β-Picolins. » (Une complète séparation [des deux isomères] n'est possible que via leurs sels doubles salts de platine. Ce [sel double] d'α-picoline (comme je l'appelle) est moins soluble que la β-picoline.) P. 2011: "Es kann daher Baeyer's aus Acroleïnammoniak gewonnene Base vielleicht als das dritte, nach Koerner's Auffassungsweise mögliche γ-Picolin betrachtet werden." (Ainsi, la base de Baeyer qui fut obtenue à partir d'acroleïnammoniak peut peut-être être considéré, selon l'interprétation de Körner, comme le troisième [isomère] possible, la γ-picoline.)
- (Weidel, 1879), p. 1994.
- (Weidel, 1879), p. 2004.
- H Weidel, « Zur Kenntniss des Nicotins » [« [Contribution] to our knowledge of nicotine »], Annalen der Chemie und Pharmacie, vol. 165, no 2, , p. 328–349 (DOI 10.1002/jlac.18731650212, lire en ligne)
- Voir :
- dans (Weidel, 1879), pp. 2000–2001, Weidel montre que la décarboxylation de l'acide picolinique produit la pyridine ;
- dans (Weidel, 1873), p. 343, Weidel montre que la décarboxylation de la niacine produit la pyridine ;
- dans (Weidel, 1879), p. 2000, Weidel décrit la picoline comme la pyridine avec un groupe méthyle (CH3 –), C5H5N---CH3 ;
- dans (Weidel, 1879), p. 2008, Weidelécrit que son échantillon de picoline contient au moins deux isomères de la picoline : « … ein Gemisch von zwei Isomeren … » ( … un mélange de deux isomères … ).
- Dans (Weidel, 1879), p. 2011: « Die mitgetheilten Thatsachen reichen noch nicht aus, um endgültige theoretische Erklärungen namentlich der Isomerien, die offenbar in der relativen Stellung der CH3 –, resp. COOH-Gruppe zum Stickstoff ihren Grund haben, zu geben. » (Les faits rapportés ne sont pas encore suffisants pour donner des explications théoriques définitives, en particulier sur l'isomérie, qui s'explique évidemment par la position relative du groupe CH3 – respectivement COOH – par rapport à l'azote.))
- (de) Zd. H. Skraup et A. Cobenzl, « Über α– and β–Naphthochinolin » [« On α– and β–naphthoquinoline »], Monatshefte für Chemie, vol. 4, , p. 436–479 (DOI 10.1007/BF01517985, S2CID 96180283, lire en ligne) Voir l'illustration de la Nicotinsäure (acide nicotinique ou niacine) p. 455.

