Oxyde de phosphine
Les oxydes de phosphine sont des composés phosphorés de formule OPX3. Lorsque X est un alkyle ou un aryle, on parle alors d'oxydes d'organophosphine, avec l'oxyde de triphénylphosphine comme exemple ; le trichlorure de phosphoryle (Cl3PO) est un oxyde de phosphine inorganique.
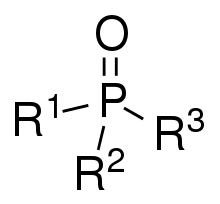
Les oxydes de phosphine sont des composés thermostables, ne se décomposant qu'au-dessus de 450 °C[1].
Le terme « phosphoryle » réfère au groupe fonctionnel avec une liaison double phosphore-oxygène.
Composé parent
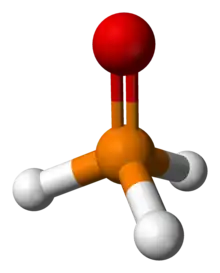
Le composé parent de cette famille est l'oxyde de phosphine (H3PO), un composé instable. Il a été détecté par spectrométrie de masse comme produit de la réaction entre le dioxygène et la phosphine[2], par spectroscopie infrarouge à transformée de Fourier dans la réaction entre la phosphine et l'ozone[3] et par isolement de matrice dans la réaction entre la phosphine, l'oxytrichlorure de vanadium et le chlorure de chromyle[4]. Sa présence a aussi été rapportée, dans un état relativement stable, dans une solution d'eau-éthanol par oxydation électrochimique du phosphore blanc, où il se dismute lentement en phosphine et acide hypophosphoreux[5].
L'oxyde de phosphine est un tautomère de l'acide phosphineux (H2POH).
L'oxyde de phosphine a été rapporté comme intermédiaire réactionnel à température ambiante dans la polymérisation de la phosphine et de l'oxyde nitrique en PxHy solide[6].
Liaisons
Selon la théorie de l'orbitale moléculaire, la liaison courte P-O s'explique par le don d'une paire d'électrons non liante de l'orbitale p de l'oxygène vers l'orbitale anti-liante phosphore-carbone ; cette hypothèse, qui résultait de calculs ab initio, fait à présent consensus dans la communauté des chimistes[7].
La nature de la liaison phosphore-oxygène a longuement été débattue, car l'implication des orbitales d liantes du phosphore n'est pas étayée par les analyses computationnelles. En termes de structure simple de Lewis, cette liaison est représentée de façon plus précise comme une liaison covalente de coordination (« liaison dative »), comme c'est le cas pour les « oxydes d'amine ».
Synthèse
Les oxydes de phosphine sont en général des sous-produits de la réaction de Wittig :
- R3PCR'2 + R"2CO → R3PO + R'2C=CR"2.
Une autre voie commune de synthèse des oxydes de phosphine est la thermolyse des hydroxydes de phosphonium. En laboratoire, les oxydes de phosphine sont en général produits par oxydation, souvent accidentelle, de phosphines tertiaires :
- R3P + 1/2 O2 → R3PO.
Utilisations
Les oxydes de phosphine sont des ligands utilisés dans diverses catalyses homogènes.
- En chimie de coordination, ils sont connus pour avoir des effets de labilité envers les ligands CO cis par rapport à eux, dans les réactions organométalliques. Ce procédé est décrit par l'effet cis.
- Typiquement, les oxydes de phosphine sont perçus comme des sous-produits inutiles de la réaction de Wittig. Ils peuvent cependant être utilisés dans des réactions de type Wittig. Par exemple, le benzaldéhyde peut être converti en β-méthoxystyrène en utilisant l'oxyde de méthoxyméthyldiphénylphosphine, dans une procédure à deux étapes. Dans un premier temps, l'oxyde de phosphine est déprotoné à −90 °C dans le THF/éther par le diisopropylamidure de lithium, puis l'aldéhyde est ajouté au mélange réactionnel. Après traitement aqueux, les adduits sont isolés. Ils sont ensuite convertis en styrènes à température ambiante par le t-butoxyde de potassium. Comme les adduits existent sous la forme d'un mélange de composés D/L séparables sous forme méso, les styrènes finaux obtenus peuvent l'être sous forme pure E ou Z[8].
- En 2019, Ross Denton et ses collègues (Université de Nottingham) ont montré que l'oxyde de phosphine peut être utilisée comme catalyseur pour verdir la réaction de Mitsunobu, une réaction chimique très utilisée par l'industrie pour produire des médicaments, pesticides et explosif, en supprimant la production de déchets toxiques et en régénérant le seul sous-produit de la réaction, ne laissant in fine que la molécule d'intérêt et de l'eau[9].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phosphine oxid » (voir la liste des auteurs).
- D. E. C. Corbridge, Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology, 5e éd., Elsevier, Amsterdam, 1995. (ISBN 0-444-89307-5).
- Peter A. Hamilton et Timothy P. Murrells, Kinetics and mechanism of the reactions of PH3 with O(3P) and N(4S) atoms, J. Chem. Soc., Faraday Trans. 2, 1985, 81, 1531-1541 DOI 10.1039/F29858101531
- Robert. Withnall, Lester. Andrews, FTIR spectra of the photolysis products of the phosphine-ozone complex in solid argon, J. Phys. Chem., 1987, 91 (4), p. 784-797, DOI 10.1021/j100288a008
- David A. Kayser et Bruce S. Ault, Matrix Isolation and Theoretical Study of the Photochemical Reaction of PH3 with OVCl3 and CrCl2O2, J. Phys. Chem. A., 2003, 107 (33), p. 6500-6505, DOI 10.1021/jp022692e
- Yakhvarov, D., Caporali, M., Gonsalvi, L., Latypov, S., Mirabello, V., Rizvanov, I., Sinyashin, O., Stoppioni, P. et Peruzzini, M. (2011), Experimental Evidence of Phosphine Oxide Generation in Solution and Trapping by Ruthenium Complexes, Angewandte Chemie, International Edition, 50: 5370–5373. DOI 10.1002/anie.201100822
- Yi-Lei Zhao, Jason W. Flora, William David Thweatt, Stephen L. Garrison, Carlos Gonzalez, K. N. Houk et Manuel Marquez, Phosphine Polymerization by Nitric Oxide: Experimental Characterization and Theoretical Predictions of Mechanism, Inorg. Chem., 2009, 48 (3), p. 1223–1231, DOI 10.1021/ic801917a
- D. B. Chesnut, « The Electron Localization Function (ELF) Description of the PO Bond in Phosphine Oxide », Journal of the American Chemical Society, vol. 121, no 10, , p. 2335–2336 (DOI 10.1021/ja984314m)
- T. A. M. van Schaik et A. van der Gen, Synthesis of 3-(1-alkenyloxy)-1,2-propanediols, enol ethers of glycerol, by the horner-wittig reaction, Recueil des Travaux Chimiques des Pays-Bas, vol. 102, issue 10, 1983, p. 465–466, DOI 10.1002/recl.19831021009
- A reaction used by chemists worldwide goes green ;Thanks to a catalyst, a crucial chemical process no longer requires an explosive ingredient., Nature, publié le 13 sept 2019