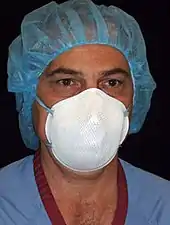
Masque de protection
Un masque de protection est un dispositif destiné à protéger l'utilisateur de l'inhalation de poussières nocives, d'agents pathogènes, fumées, vapeurs, ou de gaz. Les masques existent dans une large gamme de types et de tailles utilisées par les militaires, le secteur privé et le public. Ils vont du moins cher, à usage unique, aux masques jetables réutilisables à des modèles à cartouches remplaçables.
Il existe deux catégories d'appareils respiratoires, à savoir les appareils « filtrants », qui peuvent être soit passifs soit actifs et qui forcent l'air contaminé à passer par un élément filtrant, et les appareils « isolants », dans lesquelles de l'air frais est délivré à partir d'une réserve. Dans chaque catégorie, différentes techniques sont utilisées pour réduire ou éliminer les matières nocives en suspension dans l'air.
Malheureusement, la concentration de dioxyde de carbone dans l'air respirable peut être bien supérieure à la concentration maximale autorisée (La concentration peut dépasser 3 %[1] - [2] - [3] - [4] - [5] - [6]; Valeur d'exposition moyenne pondérée = 0,5 % (8 heures) 1,4 % (quinze minutes)[7]). Si les travailleurs utilisent des respirateurs pendant de nombreuses heures, ils peuvent avoir des maux de tête et tomber malades[8]. Ils peuvent développer des dermatites, acné[9].
Histoire



Les masques ayant pour fonction de protéger de l'inhalation de particules existent sans doute depuis longtemps pour les travaux miniers ou sources de poussière. Durant les épidémies de peste, les médecins se faisaient faire des masques en bec d'oiseaux emplis de plantes médicinales supposées tuer les miasmes responsables de la contagion. Au milieu du XIXe siècle, les masques médicaux apparaissent.
Le chirurgien britannique Julius Jeffreys (en) est souvent considéré comme l'inventeur du masque de protection sanitaire, avec le « respirator of Jeffreys » un modèle de masque mis au point contre les maladies respiratoires et les changements de températures, responsables des rhumes[11].
À la fin du XIXe siècle, l'ingénieur français Charles-Urbain Bricogne fait mettre au point un masque contre les poussières nocives pour les employés des chemins de fer[12]. Au début du XXe siècle, lors des débuts des chars d'assauts, leurs occupants étaient obligés de porter un masque pour se protéger des éclats de peinture et de métal éjectés des parois par les impacts de projectiles à l'extérieur. Mais les premières campagnes pour inciter des populations à porter un masque de protection, et les mesures de port obligatoire de ces masques, pour des raisons sanitaires, semblent dater toutefois de la grippe espagnole, au XXe siècle[11]. La mairie de San Francisco décrète une obligation de « porter le masque de gaze comme moyen de prévenir la propagation de la grippe ». S'en inspirant, le Japon conseille dès février 1919 à sa population, ainsi qu'à celle de ses colonies taïwanaise et coréenne, de faire de même[11]. Quelques années auparavant, l'usage de masque aurait été aussi une protection utilisée par les populations chinoises contre la peste mandchoue[13].
Après la Seconde Guerre mondiale, au Japon puis en Chine et en Corée du Sud, le masque de protection est utilisé également lors des périodes de pollution[14](par contre, à l'inverse, l'usage de masques de protection, en particulier à usage unique, durant la pandémie de Covid-19 a induit une pollution du fait des masques jetés dans l'espace public et se retrouvant parmi les déchets[15]). Au printemps, le masque protège désormais des allergies au pollen. Le masque de protection est utilisé également en Asie de l'Est avec l'épidémie de SRAS de 2002-2004, un coronavirus, puis contre des épidémies de grippe, telle la grippe A (H1N1) de 2009[14] - [13].
Durant la pandémie de Covid-19, en particulier en 2020-2022, le port du masque a été rendu obligatoire dans plusieurs pays :
Les casques/masques de protection métalliques comportant une fenêtre pour la vision ne sont actuellement plus utilisés qu'en métallurgie et pour la soudure, et tendent à être remplacés par des masques en matériaux composites plus légers. Pour les utilisations sans source de chaleur, le plexiglas en feuille épaisse (1 à 5 mm) est transparent et résistant aux chocs. Parfois, une simple visière en matière plastique souple et transparente protège le visage de l'opérateur des projections de liquide corrosif ou à risques toxiques, biologiques ou médicaux (projections de gouttelettes, de sang, etc.).
Appareil respiratoire filtrant
Des masques filtrants en laine furent utilisés par les premiers inventeurs comme Haslett et Tyndall. La laine est encore utilisée comme filtre aujourd'hui, avec d'autres substances comme le plastique, le verre, la cellulose, et des combinaisons de deux ou plusieurs de ces matériaux. Étant donné que les filtres ne peuvent pas être nettoyés et réutilisés et ont donc une durée de vie limitée, le coût et la disponibilité sont des facteurs clés. Il existe des modèles à usage unique jetables ainsi que des modèles à cartouche.
La norme européenne EN 143 définit les catégories suivantes de filtres qui peuvent être attachés à un masque[16]:
| Classe | Efficacité de la filtration (avec un débit d'air de 95 l/min) |
|---|---|
| P1 | Filtration d'au moins 80 % des particules en suspension |
| P2 | Filtration d'au moins 94 % des particules en suspension |
| P3 | Filtration d'au moins 99,95 % des particules en suspension |
La norme européenne EN 149 définit les catégories suivantes de « demi-masques filtrants »[17]:
| Désignation | Efficacité de la filtration (avec un débit d'air de 95 l/min) | Fuite vers l'intérieur | Illustration |
|---|---|---|---|
| FFP1 | Filtration d'au moins 80 % des particules en suspension | <22 % | .jpg.webp) |
| FFP2 | Filtration d'au moins 94 % des particules en suspension | <8 % | .jpg.webp) |
| FFP3 | Filtration d'au moins 99 % des particules en suspension | <2 % |  |
Les deux normes européennes imposent d'effectuer des tests de pénétration des filtres avec des aérosols de chlorure de sodium et d'huile de paraffine, après stockage des filtres à 70 °C et −30 °C pendant chaque fois 24 heures. Les normes comprennent également des tests sur la résistance mécanique, la résistance respiratoire et le colmatage. La norme EN 149 teste également les fuites vers l'intérieur entre le masque et le visage (dix sujets humains effectuent cinq exercices chacun et pour au moins huit de ces personnes la moyenne mesurée des fuites vers l'intérieur énumérées ci-dessus ne doit pas être dépassée).
| Résistance à l'huile | Désignation | Description |
|---|---|---|
| Aucune | N95 | Filtration d'au moins 95 % des particules en suspension |
| N99 | Filtration d'au moins 99 % des particules en suspension | |
| N100 | Filtration d'au moins 99,97 % des particules en suspension | |
| Jusqu'à 8 h | R95 | Filtration d'au moins 95 % des particules en suspension |
| R99* | Filtration d'au moins 99 % des particules en suspension | |
| R100* | Filtration d'au moins 99,97 % des particules en suspension | |
| Résistant | P95 | Filtres au moins 95 % des particules en suspension |
| P99* | Filtration d'au moins 99 % des particules en suspension | |
| P100 | Filtration d'au moins 99,97 % des particules en suspension | |
| * aucun masque de ce type n'a été certifié par le NIOSH. | ||
En 2020, selon les CDC américains, environ trois millions d'agents de santé américains doivent régulièrement porter l'une de ces protection respiratoire[19]

Avec cartouche
Les masques filtrants à cartouche utilisent une cartouche pour retenir, en plus des particules, les gaz, les composés organiques volatils (COV) et autres vapeurs par absorption ou chimisorption.
Masques de protection actifs ou masques par surpression
Les masques de protection actifs combinent la technologie traditionnelle d'un masque filtrant et un système à air pulsé mettant en surpression le masque. C'est une technique qui est utilisée depuis longtemps dans les laboratoires travaillant sur des bactéries ou des virus ainsi que dans les salles blanches pour l'industrie spatiale. Il y a trois principaux avantages aux masques actifs :
- Une barrière protectrice : la différence de pression crée une véritable barrière protectrice empêchant les particules, gaz ou bactéries de pénétrer à l'intérieur de la zone. Même avec une micro fuite, l'air ne peut que s'échapper. C'est une des techniques les plus efficaces connues à ce jour. L'avoir intégré dans un masque de protection portatif est innovant.
- Une filtration généralement plus épaisse mais plus efficace : par l'augmentation du débit d'air, les masques de protections actifs permettent d'améliorer la filtration de l'air en y ajoutant plus d'épaisseur. Plusieurs couches de filtres sont alors superposées pour augmenter le niveau de filtration. Il est tout à fait possible de trouver des masques de sports grand public avec des caractéristiques de filtration de particules fines de 2.5µm supérieure à 98 %.
- Plus de débit d'air : les masques actifs permettent aussi d'améliorer le confort d'utilisation en amenant plus d'air dans la cavité du masque. La pression engendrée par la ventilation facilite le passage de l'air à travers les filtres et rend donc la respiration plus agréable qu'avec un masque traditionnel qui généralement n'est pas très agréable à porter.
Les masques actifs sont utilisés aujourd'hui principalement pour les activités sportives comme le vélo ou l'endurance. C'est une technologie encore peu répandue mais dans le contexte actuel elle connait un véritable essor du fait des caractéristiques efficaces et de ses prix généralement accessibles.
Appareil respiratoire isolant
Un appareil respiratoire isolant ou autonome a généralement trois principaux éléments : un réservoir à haute pression, un régulateur de pression, et une connexion d'inhalation (un élément à insérer dans la bouche ; dans le masque ou le demi-masque), reliés entre eux. Il existe deux types d'appareils respiratoires autonomes : en circuit ouvert et circuit fermé.
Masques barrière en tissus non tissés
Après la découverte des microbes par Pasteur, des masques médicaux ont été introduits dans le milieu hospitalier et des soins médicaux vers le milieu du XIXe siècle.
Leur vocation est surtout de protéger autrui des microbes expirés par le porteur, mais des preuves historiques montrent que des masques en tissu ont aussi été portés pour protéger les agents de santé contre les miasmes et infections respiratoires[20].
La fabrication de divers types de masques jetables en fibre synthétique, en non-tissé ou en papier filtrant s'est industrialisée au XXe siècle. Ces masques sont désormais produits par centaines de millions chaque année. Il est démontré que dans un environnement à haut-risque le FFP2 (N95) et le FFP3 (N99) sont plus protecteur pour les agents de santé que le masque chirurgical, mais à condition d'être porté en continu dans cet environnement[21] - [22]. Ils sont aussi plus coûteux.
Mais depuis le début du XXIe siècle plusieurs crises sanitaires (grippe à H1N1 de 2009, SRAS, MERS et Covid-19, avec entre-temps émergence de plusieurs variants préoccupants de grippe aviaire, et des épisodes récurrents d'Ebola)...) on montré que les masques chirurgicaux ou FFP pouvaient brutalement manquer. Historiquement les agents de santé ont utilisé plusieurs types de masques en tissu de coton[20] dont l'efficacité peut varier selon la forme, le type de tissu, l'adaptation à la face du porteur, etc. ; Aujourd'hui en Asie (Chine et Viêt Nam notamment) les masques faciaux sont volontiers portés dans la population générale et des masques en tissus sont très couramment portés par les professionnels de santé. Par ailleurs, de nombreuses version de masque protégeant plus ou moins efficacement de la pollution de l'air ont été mises sur le marché ; malgré cette large utilisation, la plupart des directives sur les équipements de protection individuelle (EPI) ne mentionnaient même pas les masques en tissu. En 2020, face à la pénurie de masque induite par la pandémie de Covid-19, l'intérêt du grand public et de certains professionnels pour les masques de tissus, éventuellement « faits maison » est brutalement remontée.
Avant 2015, des études descriptives ont porté sur les masques en tissu (très utilisés dans les pays pauvres ou émergents), mais toujours testés in vitro. Ces études ont montré que plus le tissu est fin et plus les couches sont nombreuses, mieux le masque filtre l'air[23]. La présence d'humidité, la distance parcourue par les gouttelettes et la conception du masque se sont montrés être des facteurs importants pour l'efficacité de filtration (in vitro). Les masques en tissu offrent une certaine protection, réduisent l'exposition aux aérosols respiratoires mais ils n'avaient pas été comparé aux masques FFP ou chirurgicaux en hôpital[23].
En 2015, C. Raina MacIntyre & al. publient la première étude sur l'efficacité des masques en tissu, en usage professionnel réel[23]. L'étude, randomisée, a comparé dans quatorze hôpitaux d'Hanoï (Viêt Nam) l'efficacité d'un modèle d'un masque en tissu (double couche de coton tissé), et d'un masque médical en non-tissé (triple couche), tous deux fabriqués au Viêt Nam et couramment utilisés dans les hôpitaux du pays ; les 1 607 participants étaient tous des professionnels de santé (médecins ou infirmières volontaires), âgés de plus de 18 ans, et travaillant à plein temps dans des services à haut-risque (aucun ne portait de barbe, de moustache importante ou de cheveux longs devant le visage, ni n'étaient sujets à une maladie respiratoire chronique, rhinites ou allergies)[23]. Une partie des participants a porté des masques médicaux jetables, l'autre des masques en tissu, et le groupe témoin conservait sa pratique habituelle (incluant le port du masque). Les deux premiers groupes devaient utiliser leur masque à chaque quart de travail, pendant 70 % ou plus de leurs heures de travail et durant quatre semaines consécutives ; Ceux qui portaient des masques médicaux en recevaient deux par jour pour chaque quart de huit heures, alors que le autres disposaient de cinq masques en tissus pour toute la durée de l'étude, à laver après chaque quart de travail au savon et à l'eau en suivant des instructions écrites sur le lavage. Dans les trois groupes le port du masque était vérifié[23]. Trois critères d'efficacité étaient le risque de contracter une maladie respiratoire clinique, un syndrome pseudo-grippal (SG) ou une infection virale respiratoire confirmée en laboratoire.
Résultats : les masques en tissu étaient statistiquement significativement moins protecteurs ; en outre près de 97 % des particules les pénétraient contre 44 % pour les masques médicaux[23]. On sait que sur les deux types de masque des virus peuvent rester infectieux à leur surface[24] (des études de modélisation ont quantifié les niveaux de contamination des masques)[25] ; la moindre efficacité des masques en tissu peut en partie être due à une autocontamination facilitée par l'utilisation répétée et un enlèvement mal exécuté ; on sait aussi qu'avec le SRAS le double masquage et d'autres pratiques augmentant l'humidité dans le masque ont accru le risque d'infection et de diffusion de liquide ou de rétention des agents pathogènes[26], effets peut-être valables pour les masques en tissu. Les auteurs ont appelé à des recherches supplémentaires sur l'efficacité clinique, la durée d'utilisation, les méthodes de décontamination et les tests à utiliser, afin d'éclairer l'utilisation des masques en tissu, très utilisés à l'échelle mondiale, mais mal pris en compte par les directives et guides de bonnes pratiques. Mais ils considèrent que « par mesure de précaution, les masques en tissu ne devraient pas être recommandés pour les travailleurs à risque et plus encore en situations de haut risque »[23]. Ils ont aussi appelé à mettre à jour les directives relatives au contrôle des infections, car des masques en tissu sont très utilisés dans le monde[23].
En 2020, en Europe, puis aux États-Unis, pour faire face à des pénuries critiques d'équipements de protection individuelle (EPI) un nombre croissant de soignants et de membres du public utilisent des masques fabriqués « maison » avec le soutien d'hôpitaux et des Centres pour le contrôle et la prévention des maladies (CDC) (le CDC a pour la circonstance diminué ses niveaux de recommandations pour les agents de santé), et des entreprises se lancent dans une production complémentaire de masques en tissu, sur la base de cahiers des charges hospitaliers (exemple en France de la mise à disposition d'entreprises par le CHU de Lille, mais pas du grand public afin de garantir que le bon tissu soit utilisé ; les bénévoles volontaires pour coudre des masques sont aidés à s'organiser pour le faire)[27].
Les auteurs de l'étude résumée ci-dessus, dont les alertes et suggestions n'ont pas été suivies d'effets, constatent l'échec des gouvernements et des hôpitaux en termes de planification et gestion des stocks de masques nécessaires à la santé et sécurité au travail des agents de santé, y compris les pays riches. Très sollicités pour des conseils, ils répètent cinq ans après leur étude de 2015, que « la barrière physique fournie par un masque en tissu peut offrir une certaine protection, mais probablement beaucoup moins qu'un masque chirurgical ou un masque de type FFP2 ou FFP3 ». Ils évoquent aussi le fait que dans leur étude « Les masques en tissu ont peut-être été pires [...] car ils n'étaient pas assez bien lavés - ils peuvent alors être humides et contaminés »[28]. Il soulignent que depuis 2015, l'efficacité de différents types de tissu (monocouche ou multi-couches) a été testée en laboratoire, mais pas encore lors d'un essai clinique[28]. Dans le contexte pandémique et de pénurie de masque, ils recommandent (pragmatiquement plutôt que factuellement) aux agents de santé choisissant de travailler avec des masques en tissu, d'en avoir toujours au moins deux et de les utiliser en cycle, afin que chacun puisse être lavé et bien séché après usage quotidien[28]. Un spray désinfectant ou une boîte de désinfection UV peuvent être utilisés lors des pauses en journée. Ils rappellent aussi que face à la Covid-19 le masque ne suffit pas pour les agents de santé ; gants et lunettes de protection sont au minimum requis en respectant les bonnes pratiques et en prenant garde à l'auto-contamination et aux fomites[28].
À la suite des différentes crises sanitaires mondiales et faute de matériel ou d'argent, le masques en tissu s'est généralisé dans les pays en voie de développement principalement en Asie. C'est devenu une véritable alternative aux masques de protection respiratoire. Dans une phase de pénurie, ces masques à usage non sanitaire lavables permettraient une certaine protection, inférieure aux masques chirurgicaux[29].
En mars 2020 en France, deux nouvelles catégories de masques à usage non sanitaire sont créées par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) et l'Agence nationale d'accréditation et d'évaluation en santé (ANAES) pour les professionnels en contact ou non avec le public[30].
Usage prolongé ou réutilisation de masques de protection
Cas du masque FFP2, FFP3 ou N95
Dans le domaine médical, les masques de type FFP2 (N95 aux États-Unis, parfois dits « respirateurs ») sont normalement prévus ou utilisés pour un usage unique (certains modèles sont exclusivement à usage unique). Mais leur pénurie lors de certaines crises sanitaires peut faire évoluer les recommandations officielles.
Ainsi à partir du les CDC américains ont admis et même encouragé :
- l'usage prolongé du masque, « lorsque plusieurs patients sont infectés par le même pathogène respiratoire et que les patients sont placés ensemble dans des salles d'attente ou des salles d'hôpital dédiées »[31] ; recommandation déjà faite comme option pour conserver des masques lors de précédentes crises sanitaires[32] - [33].
- une « réutilisation limitée » : en 2020, les CDC l'ont « recommandée », arguant qu'elle a été « largement utilisée comme option pour conserver les masques lors de précédentes épidémies ou pandémies » et ajoutant que pour les pathogènes peu transmissibles par contact via les fomites, la réutilisation non-urgente est pratiquée depuis des décennies, dans le cas de la tuberculose par exemple[34], tant que le masque reste fonctionnel[35] - [31].
Conditions pour un usage prolongé et/ou une réutilisation
Selon les CDC américains :
- le masque doit rester fonctionnel (ou être jeté)[31] ;
- son utilisation doit rester conforme aux procédures locales de contrôle des infections[35] - [36] - [37] - [32] - [38] ;
- l'hygiène des mains, et de la technique de pose et de retraits doivent être strictement respectés[39], ce qui implique de bien se laver les mains à l'eau et au savon ou avec un désinfectant adéquat, avant et après avoir touché ou réglé le masque (par exemple pour le confort, l'ajustement au visage ou pour en maintenir la forme)[31].
- éviter de toucher l'intérieur du masque ; en cas de contact accidentel avec l'intérieur du masque, ce dernier doit être jeté, et le porteur doit se laver ou se désinfecter les mains[31] ;
- un FFP2 ou N95 déjà porté doit être réinstallé sur le visage avec des gants propres (non stériles), puis son étanchéité est à vérifier (soi-même ou par un tiers ; le masque doit partout coller au visage) avant de jeter les gants [31] ;
- si le masque a été directement contaminé par des gouttelettes/aérosols, du sang ou des sécrétions respiratoires ou nasales ou d'autres fluides corporels de patients malades ou susceptibles de l'être (c'est souvent le cas lors de bronchoscopies et d'intubations endotrachéale ou lors certaines observations ou opérations ORL) , alors le masque doit être jeté ; de même après contact étroit avec un patient atteint d'une maladie infectieuse nécessitant des précautions de contact[31]. Ce risque peut être réduit par le port d'un écran facial nettoyable au-dessus du masque[36], et/ou par le masquage des patients... deux mesures barrière recommandées si une réutilisation du masque est envisagée [31] ;
- sans précision du fabricant sur le nombre de réusages possibles, les CDC recommandent de ne pas dépasser cinq réutilisations (certains masques n'ont pas été approuvés par la FDA pour être réutilisés[40]) ; l'étiquetage doit alors préciser « à usage unique uniquement » alors que d'autres masques autorisent la réutilisation « si la politique de contrôle des infections de l'établissement le permet »[41] ;
- entre deux utilisations, les masques sont à ranger dans un sac en papier, avec le nom du porteur, en veillant à ce qu'il ne soit pas déformé lors du stockage, dans un lieu sécurisé et régulièrement désinfecté[31].
Pour éviter toute contamination par partage accidentel d'un masque, un moyen d'identification peut être apposée sur l'un des élastiques[31]. Les utilisateurs devraient avoir des formations et rappels par affiches par exemple sur les bonnes pratiques pour la réutilisation [31].
Risques/avantages
En mars 2020, l'ECRI Institute (anciennement « Emergency Care Research Institute », autorité indépendante sur les pratiques médicales aux États-Unis) a dans un rapport rappelé que « les risques et avantages potentiels de ces pratiques peuvent varier considérablement d'un endroit à l'autre et peuvent évoluer rapidement pendant une crise ». L'ECRI rappelle que les tests de laboratoire sont souvent des études non répétées, aux protocoles différents et ne reflétant pas les risques existants en situation réelle. Leurs résultats (non-généralisables à tous les modèles de masque N95 variant en outre « considérablement selon les méthodes de nettoyage et les modèles N95 et nécessitent donc plus de validation »[19].
- en cas de réutilisation « La décontamination de masques N95 à la vapeur ou par des désinfectants (par exemple, eau de javel, vapeur de peroxyde d'hydrogène) ou l'irradiation germicide ultraviolette (UVGI) peut être sûre et efficace dans certains contextes, mais chaque méthode doit être testée sur chaque modèle car les matériaux du modèle varient » ; la désinfection peut induire une perte de performance du filtre[19] ;
- Une étude clinique a porté sur l'efficacité des masques chirurgicaux en situation réelle (en 2015), mais aucune étude publiée n'a évalué les risques posés en situation de travail par la réutilisation ou l'utilisation prolongée du FFP2 (N95) ; ceci s'explique selon l'ECRI par des raisons éthiques (pour ne pas exposer des soignants et malades) et logistiques (les réutilisation / utilisation prolongée du N95 ne se font que sporadiquement, lors de crises impromptues)[19] ;
- Dans tous les cas le risque le plus important pour les soignants semble être celui d'« auto-inoculation » (auto-transmission par contact, en touchant la surface du masque contaminé) ; Une étude a par exemple montré que lors d'un usage prolongé, lors d'un quart de travail, une infirmière touche involontairement en moyenne 25 fois son visage, ses yeux ou son respirateur N95[42].
Résultats des études pour le FFP2/N95 (usage prolongé ou réutilisation)
- Durée de vie microbienne sur le masque : 4 % à 18 % des particules du virus H1N1 et plus de 10 % des virus bactériophages M2 sont encore infectieux après quatre à six jours sur des filtres 3M 8210 à température ambiante[43]. Et selon Brady et al. (2017) 2 % à 15 % des particules de bactériophages M2 étaient ensuite transférées, par simple toucher, aux utilisateurs portant des N95 contaminés[44]. Selon Fisher et al. en 2012, le réenvol et transfert par aérosolisation de particule virales M2 est très faible (<0,2 %) mais possible si l'on tousse dans un N95 contaminé[45]. De 2000 à mars 2020, cinq études ont porté sur la charge microbienne du filtre[46] - [47] - [48] - [45] - [49] - [50] - [19].
- Désinfection du N95 ou FFP2 ou équivalents : entre 2000 et mars 2020, treize études de laboratoires ont porté sur ce sujet. Parmi elles trois ont testé l'autoclave, la vapeur d'eau, la chaleur humide, l'eau de Javel, le chlorure de benzalkonium et les ultraviolets-C (UV-C) (1 à 2 J/cm2) qui sur les N95 contaminés ont réduit de plus de 10 000 fois la charge en H5N1[51], en H1N1 (Heimbuch et al. 2011) et en Staphilococcus aureus[47] - Heinbuch et al. (2011) ont cependant trouvé les UVGI inefficaces sur certains modèles N95[52], et l'une des études a rapporté que les profils d'inoculation affectaient les UCGI (Woo et al. 2012)[50].
- Salter et al., en 2010, n'ont pas détecté de résidus chimiques toxiques dans les N95 décontaminés avec de l'eau de Javel, du peroxyde d'hydrogène ou des UVGI, mais le traitement à l'oxyde d'éthylène a laissé des résidus toxiques détectables[53].
- Performance et intégrité du filtre : deux études ont testé l'ajustement du N95 après jusqu'à vingt poses successives sur le visage, par dix utilisateurs expérimentés[54], Bergman et al.2012) ont rapporté que le masque perd de sa rigidité après désinfection et/ou lors du réussie : 7 % à 8 % des N95 ont échoué à un bon ajustement après deux utilisations et >20 % ont échoué après cinq réutilisations. Lin et al. en 2017 ont en outre estimé que la filtration d'un N95 était dégradée par le nettoyage à l'eau de Javel, à l'éthanol à 70 %, à la vapeur ou à l'autoclave ; Mais toujours selon Bergman et al. (2010) six modèles filtraient encore plus de 95 % des particules de 300 nm après trois nettoyages à l'eau de Javel, au peroxyde d'hydrogène, à la vapeur, à la chaleur humide (65 °C pendant 20 minutes) ou aux UVGI (1 à 2 J/cm2)[55]. Viscusi et al. 2011 concluent que les N95 nettoyés convenaient[56], mais 1 étude (Lindsey et al. 2015) a signalé que les filtres et les sangles étaient endommagés par des doses d'UVGI > 120 J/cm2[57].
- Double protection ? : En présence de microbes hautement pathogènes, certains soignants utilisent parfois une double protection. Plus de trente modèles de masque N95 ont été testés avec une couverture supplémentaire par un masques chirurgical pour notamment étudier un éventuel effet de la réinhalation d'un peu plus du CO2 expiré (ou d'effort respiratoire ; le « sur-masque » n'avait aucun effet cliniquement significatif sur l'échange de gaz, mais selon Sinkule et al. en 2013[58], l'effort respiratoire est légèrement augmenté selon un tests fait sur simulateur de respiration, ce qu'ont ressenti dix sujets humains testés par Roberge et al. (2010)[59].
- Risque d'auto-inoculation ou de transfert microbien par aérosols ou du toucher à partir du masque : des chercheurs ont montré que plusieurs pathogènes respiratoires[60] - [61] - [62] peuvent longtemps persister, infectieux, en surface du masque sur le filtre[63] - [64] - [65] et la réérosolisation est possible[66] - [67] - [68] - [69] - [70], mais selon les CDC (mars 2020) : « plus de ~ 99,8 % sont restés piégés sur le respirateur après manipulation ou après une toux ou un éternuement simulé»[19].
Porter un masque plus longtemps vs. le réutiliser
En mars 2020, l'ECRI a publié la synthèse de vingt-et-une études de laboratoires publiées de 2000 au , dont quatre ont explicitement porté sur une réutilisation, simulée, du N95, et/ou sur une utilisation prolongée. Selon l'ECRI il ressort de ces études des preuves limitées en faveur de l'usage prolongé plutôt que de la réutilisation, car le N95 propage plus facilement l'infection quand on le touche ou le manipule que quand on l'utilise plus longuement (le risque de défaillance telle que la casse de sangles ou une mauvaise étanchéité avec le visage est plus élevé en cas de réutilisation)[19].
Lignes directrices et recommandations cliniques pour la réutilisation et/ou un usage prolongé
Elles sont mises à jour en fonction du contexte et des avancées de la science, par exemple par les autorités sanitaires suivantes :
- OMS (Organisation mondiale de la santé - instance mondiale) ;
- Commission européenne (qui a par exemple, dans le contexte de la pandémie de Covid-19, adopté le une recommandation UE no 2020/403 relative aux procédures d'évaluation de la conformité et de surveillance du marché concernant certains équipements de protection individuelle tels que masques, gants, lunettes et blouses de protection, qui relevaient de la directive CEE no 93/42 du 14 juin 1993 relative aux dispositifs médicaux abrogée et remplacée par le règlement UE no 2017/745 du . La commission a fixé des procédures harmonisées d'évaluation de la conformité de ces EPI. Les organismes notifiés en vertu du règlement (UE) no 2016/425 devraient définir des priorités et réaliser rapidement les activités d'évaluation de la conformité dans le cadre de toute nouvelle demande déposée par un opérateur économique en ce qui concerne les EPI nécessaires pour assurer la protection dans le contexte de l'épidémie de COVID-19.)[71] ; les EPI fabriqués avec des techniques autres que celles des normes harmonisées, doivent respecter les recommandations de l'OMS sur la sélection appropriée d'EPI peuvent être utilisées comme source de référence possible concernant de telles solutions techniques, à condition d'aussi garantir « un niveau adéquat de protection correspondant aux exigences essentielles de santé et de sécurité applicables énoncées dans le règlement UE no 2016/425 ».
- Les organismes notifiés délivrant des attestations pour des EPI innovants ou fabriqués hors des normes harmonisées sont invités à informer immédiatement l'autorité notifiante concernée et les autres organismes notifiés en vertu du règlement UE no 2016/425 des attestations délivrées et de la solution technique spécifique retenue. Les organismes notifiés devraient échanger de telles informations par l'intermédiaire du groupe de coordination des organismes notifiés mis en place conformément à l'article 36 du règlement UE no 2016/425[71].
- Quand les autorités de surveillance du marché constatent que des EPI ou des dispositifs médicaux garantissent un niveau adéquat de santé et de sécurité conformément aux exigences essentielles énoncées dans le règlement UE no 2016/425 ou aux exigences de la directive CEE nno 93/42 ou du règlement UE no 2017/745, même lorsque les procédures d'évaluation de la conformité, y compris l'apposition du marquage CE n'ont pas été menées à leur terme dans le respect des règles harmonisées, elles peuvent autoriser la mise à disposition de ces produits sur le marché de l'Union pendant une période limitée et pendant que les procédures nécessaires sont effectuées[71].
- Les États membres peuvent provisoirement acheter des produits non marqués « CE » « à condition qu'il soit garanti que de tels produits seront exclusivement mis à la disposition des professionnels de la santé pendant la durée de la crise sanitaire actuelle, n'entreront pas dans les filières habituelles de distribution et ne seront pas à la disposition des autres utilisateurs »[71].
- CDC (Centers for Disease Control and Prevention - États-Unis) : ils ont mis à jour leurs recommandations dans le cadre du plan pandémie fin mars 2020, l'utilisation prolongée et la réutilisation sont maintenant recommandées[31] ;
- NIOSH (National Institute for Occupational Safety and Health - États-Unis) ;
- OSHA (Occupational Safety and Health Administration - États-Unis).
Utilisation contre la pandémie de Covid-19
L'OMS considère que trois types de masques sont utilisés dans la pandémie de Covid-2019 :
- les masques médicaux également dits masques chirurgicaux
- les masques de protection respiratoire (filtrants) de différents niveaux de performance, comme les FFP2, FFP3, N95 ou N99
- les masques non médicaux (aussi appelés masques en tissu, masques faits maison, masques artisanaux). L’OMS emploie l’expression « masques en tissu »[72].
Dans son avis intitulé Coronavirus disease 2019 (COVID-19) in the EU/EEA and the UK – eleventh update, 10 August 2020", l'ECDC estime que:
- les masques ont un effet préventif sur la transmission de SARS-CoV-2;
- les masques réduisent le risque de transmission directe d'un cinquième, c'est-à-dire qu'ils sont divisés par cinq, passant de 17,4 % à 3,1 % que ce soit pour des masques 95, des masques chirurgicaux ou des masques en corton-couche-16-12 (en anglais 12-16 layer cotton mask);
- des mesures montrent l'efficacité des masques médicaux et non médicaux, à la fois pour éviter que le porteur ne transmette la maladie mais aussi pour réduire le risque de contamination du porteur;
- sur la base de ces faits, l'ECDC considère que le port de masque dans la communauté doit être fortement considéré à la fois en intérieur (supermarché, boutiques, transport public) et en extérieurs bondés dans les zones où le virus est présent;
- la clé du succès de l'utilisation des masques est une bonne compliance et de recommandations rationnelles;
- l'utilisation du masque ne suffit pas à remplacer les mesures essentielles: ainsi, une seconde vague s'est produite à Hong-Kong en raison du manque des mesures essentielles[73].
Cet usage du masque connait un mouvement d'opposition.
Plusieurs modèles de masques de protection (notamment utilisés contre la pandémie de Covid-19) seraient confectionnés par les Ouïghours dans les camps d'internement. Ce serait également le cas de nombreux produits de marques occidentales[74] - [75]
Notes et références
- (en) Edward James Sinkule, Jeffrey Bryon Powell et Fredric Lee Goss, « Evaluation of N95 respirator use with a surgical mask cover: effects on breathing resistance and inhaled carbon dioxide », The Annals of Occupational Hygiene, vol. 57, no 3, , p. 384-398 (ISSN 0003-4878, PMID 23108786, DOI 10.1093/annhyg/mes068, lire en ligne, consulté le )
- (en) Gunner O. Dahlbäck et Lars-Goran Fallhagen, « A Novel Method for Measuring Dead Space in Respiratory Protective Equipment », The Journal of the International Society for Respiratory Protection, vol. 5, no 1, , p. 12-17 (ISSN 0892-6298, lire en ligne, consulté le ).
- (en) Carmen L. Smith, Jane L. Whitelaw et Brian Davies, « Carbon dioxide rebreathing in respiratory protective devices: influence of speech and work rate in full-face masks », Ergonomics, vol. 56, no 5, , p. 781-790 (ISSN 0014-0139, PMID 23514282, DOI 10.1080/00140139.2013.777128, lire en ligne, consulté le ).
- (en) Shai Luria et Shlomo Shlomo Givoni, « Evaluation of CO2 Accumulation in Respiratory Protective Devices », Military Medicine, vol. 169, no 2, , p. 121-124 (ISSN 0026-4075, PMID 15040632, DOI 10.7205/MILMED.169.2.121, lire en ligne, consulté le ).
- (en) R.J. Roberge, A. Coca, W.J. Williams, J.B. Powell et A.J. Palmiero, « Physiological Impact of the N95 Filtering Facepiece Respirator on Healthcare Workers », Respiratory Care, vol. 55, no 5, , p. 569-577 (ISSN 0020-1324, PMID 20420727, lire en ligne, consulté le ).
- (en) Edward James Sinkule, Automated breathing and metabolic simulator (ABMS) evaluation of N95 respirator use with surgical masks, Centers for Disease Control and Prevention, Atlanta, GA, United States, David Hostler et al., , 68 p. (lire en ligne).
- (ru) « Normes d'hygiène 2.2.5.3532-18 "Concentrations maximales admissibles (VLCT) de substances nocives dans l'air de la zone de travail : № 2138. Dioxyde de carbone », Rospotrebnadzor (Agence de protection des consommateurs, Fédération de Russie), .
- (en) E.C.H. Lim, R.C.S. Seet, K.‐H. Lee, E.P.V. Wilder‐Smith, B.Y.S. Chuah et B.K.C. Ong, « Headaches and the N95 face-mask amongst healthcare providers », Acta Neurologica Scandinavica, vol. 113, no 3, , p. 199-202 (ISSN 0001-6314, PMID 16441251, PMCID PMC7159726, DOI 10.1111/j.1600-0404.2005.00560.x, lire en ligne, consulté le ).
- (en) Chris CI Foo, Anthony TJ Goon, Yung-Hian Leow et Chee-Leok Goh, « Adverse skin reactions to personal protective equipment against severe acute respiratory syndrome – a descriptive study in Singapore », Contact Dermatitis, vol. 55, no 5, , p. 170-179 (ISSN 0105-1873, PMID 17026695, PMCID PMC7162267, DOI 10.1111/j.1600-0536.2006.00953.x., lire en ligne, consulté le ).
- Image du United States Women's Bureau (en), par le fond historique de la NARA.
- Philippe Mesmer, « Covid-19 : porter le masque, une pratique ancrée en Asie de l’Est. Et chez nous demain ? », Le Monde, (lire en ligne)
- Charles-Urbain Bricogne, Masques respirateurs contre les poussières, mise en pratique d'un bon type de masque au chemin de fer du Nord, Paris, publications du Génie civil, 1895.
- « Geste de protection quotidien, d'où vient l'habitude de porter un masque en Asie de l'Est ? », France Info, (lire en ligne)
- « Le port du masque en Asie de l'Est : d'où vient cette habitude ? », Brut, (lire en ligne)
- Margaux Lacroux et Coralie Schaub, « Pollution plastique liée au Covid : masque la menace », Libération, (lire en ligne)
- « NF EN 143/A1 Septembre 2006 : Appareils de protection respiratoire - Filtres à particules - Exigences, essais, marquage », Association française de normalisation (Afnor), .
- « NF EN 149+A1 Septembre 2009 : Appareils de protection respiratoire - Demi-masques filtrants contre les particules - Exigences, essais, marquage », Association française de normalisation (Afnor), .
- (en) « NIOSH-Approved Particulate Filtering Facepiece Respirators », Centres pour le contrôle et la prévention des maladies (CDC), .
- (en) « Clinical Evidence Assessment : Safety of Extended Use and Reuse of N95 Respirators » [PDF], ECRI Institute, .
- Abrar Ahmad Chughtai, Holly Seale et Chandini Raina MacIntyre, « Use of cloth masks in the practice of infection control – evidence and policy gaps », International Journal of Infection Control, vol. 9, no 3, (ISSN 1996-9783, DOI 10.3396/IJIC.v9i3.020.13, lire en ligne, consulté le ).
- (en) Chandini Raina MacIntyre, Quanyi Wang, Simon Cauchemez et Holly Seale, « A cluster randomized clinical trial comparing fit-tested and non-fit-tested N95 respirators to medical masks to prevent respiratory virus infection in health care workers: RCT of face masks in health workers », Influenza and Other Respiratory Viruses, vol. 5, no 3, , p. 170-179 (PMID 21477136, PMCID PMC4941587, DOI 10.1111/j.1750-2659.2011.00198.x, lire en ligne, consulté le ).
- (en) C. Raina MacIntyre, Quanyi Wang, Holly Seale et Peng Yang, « A Randomized Clinical Trial of Three Options for N95 Respirators and Medical Masks in Health Workers », American Journal of Respiratory and Critical Care Medicine, vol. 187, no 9, , p. 960-966 (ISSN 1073-449X et 1535-4970, DOI 10.1164/rccm.201207-1164OC, lire en ligne, consulté le ).
- (en) C. Raina MacIntyre, Holly Seale, Tham Chi Dung et Nguyen Tran Hien, « A cluster randomised trial of cloth masks compared with medical masks in healthcare workers », BMJ Open, vol. 5, no 4, , e006577 (ISSN 2044-6055 et 2044-6055, PMID 25903751, PMCID PMC4420971, DOI 10.1136/bmjopen-2014-006577, lire en ligne, consulté le ).
- (en) Michael T. Osterholm, Kristine A. Moore, Nicholas S. Kelley et Lisa M. Brosseau, « Transmission of Ebola Viruses: What We Know and What We Do Not Know », mBio, vol. 6, no 2, , e00137-15 (ISSN 2150-7511, PMID 25698835, PMCID PMC4358015, DOI 10.1128/mBio.00137-15, lire en ligne, consulté le ).
- (en) Edward M. Fisher, John D. Noti, William G. Lindsley et Francoise M. Blachere, « Validation and Application of Models to Predict Facemask Influenza Contamination in Healthcare Settings: Models to Predict Facemask Influenza Contamination », Risk Analysis, vol. 34, no 8, , p. 1423-1434 (PMID 24593662, PMCID PMC4485436, DOI 10.1111/risa.12185, lire en ligne, consulté le ).
- (en) Y. Li, T. Wong, J. Chung et Y.P. Guo, « In vivo protective performance of N95 respirator and surgical facemask », American Journal of Industrial Medicine, vol. 49, no 12, , p. 1056-1065 (DOI 10.1002/ajim.20395, lire en ligne, consulté le ).
- « Un modèle de masque en tissu en production », CHU de Lille, (consulté le ).
- (en) Chandini R. MacIntyre, Chi Dung Tham, Holly Seale, et Abrar Chughtai, « COVID-19, shortages of masks and the use of cloth masks as a last resort », (consulté le ).
- « Ecrans anti-postillons (EAP) », Stop-postillons.fr (consulté le ).
- « Covid 19 : Les informations relatives aux masques grand public », Direction générale des entreprises (DGE), .
- (en) « Recommended Guidance for Extended Use and Limited Reuse of N95 Filtering Facepiece Respirators in Healthcare Settings - NIOSH Workplace Safety and Health Topic », CDC, (consulté le ).
- (en) « CDC H1N1 Flu », CDC (consulté le ).
- (en) Terri Rebmann, et al., « APIC Position Paper: Extending the Use and/or Reusing Respiratory Protection in Healthcare Settings During Disasters » [PDF], Association for Professionals in Infection Control and Epidemiology (APIC), .
- (en) « Welcome to CDC stacks », CDC (consulté le ).
- (en) Stella Beckman, Barbara Materna, Suzi Goldmacher et Jennifer Zipprich, « Evaluation of respiratory protection programs and practices in California hospitals during the 2009-2010 H1N1 influenza pandemic », American Journal of Infection Control, vol. 41, no 11, , p. 1024-1031 (PMID 23932825, PMCID PMC4615716, DOI 10.1016/j.ajic.2013.05.006, lire en ligne, consulté le ).
- (en) Leah Hines, Elizabeth Rees et Nicholas Pavelchak, « Respiratory protection policies and practices among the health care workforce exposed to influenza in New York State: Evaluating emergency preparedness for the next pandemic », American Journal of Infection Control, vol. 42, no 3, mars 2014-03, p. 240-245 (PMID 24457143, PMCID PMC7115259, DOI 10.1016/j.ajic.2013.09.013, lire en ligne, consulté le ).
- (en) « Guidelines for Preventing the Transmission of Mycobacterium tuberculosis in Health-Care Settings, 2005 », CDC (consulté le ).
- (en) « Reusability of Facemasks During an Influenza Pandemic », The National Academies of Sciences, Engineering, and Medicine (consulté le ).
- (en + es) « Sequence for donning personal protective equipment PPE/Sequence for removing personal protective equipment » [« Séquence de mise en place des équipements de protection individuelle EPI / Séquence de retrait des équipements de protection individuelle »] [PDF], CDC.
- (en) 510(k) Premarket Notification - FDA 2014.
- (en) Edward M. Fisher et Ronald E. Shaffer, « Considerations for Recommending Extended Use and Limited Reuse of Filtering Facepiece Respirators in Healthcare Settings », Journal of Occupational and Environmental Hygiene, .
- (en) Terri Rebmann et Ruth Carrico, « Physiologic and other effects and compliance with long-term respirator use among medical intensive care unit nurses », American Journal of Infection Control, (ISSN 0196-6553, DOI 10.1016/j.ajic.2013.02.017, consulté le ), p. 1218-1223.
- (en) A. D. Coulliette et K. A. Perry, « Persistence of the 2009 Pandemic Influenza A (H1N1) Virus on N95 Respirators », sur Applied and Environmental Microbiology, (ISSN 0099-2240, PMID 23335770, PMCID PMC3623216, DOI 10.1128/AEM.03850-12, consulté le ), p. 2148-2155.
- (en) Tyler M. Brady, Amanda L. Strauch, Claudia M. Almaguer et George Niezgoda, « Transfer of bacteriophage MS2 and fluorescein from N95 filtering facepiece respirators to hands: Measuring fomite potential », Journal of Occupational and Environmental Hygiene, vol. 14, no 11, , p. 898-906 (ISSN 1545-9624 et 1545-9632, PMID 28650715, PMCID PMC5705010, DOI 10.1080/15459624.2017.1346799, lire en ligne, consulté le ).
- (en) Edward M. Fisher, Jessica L. Williams et Ronald E. Shaffer, « Evaluation of Microwave Steam Bags for the Decontamination of Filtering Facepiece Respirators », PLoS ONE, vol. 6, no 4, , e18585 (ISSN 1932-6203, PMID 21525995, PMCID PMC3078131, DOI 10.1371/journal.pone.0018585, lire en ligne, consulté le ).
- (en) T.-H. Lin, F.-C. Tang, P.-C. Hung et Z.-C. Hua, « Relative survival of Bacillus subtilis spores loaded on filtering facepiece respirators after five decontamination methods », Indoor Air, vol. 28, no 5, , p. 754-762 (DOI 10.1111/ina.12475, lire en ligne, consulté le ).
- (en) Brian K. Heimbuch, Kimberly Kinney, April E. Lumley et Delbert A. Harnish, « Cleaning of filtering facepiece respirators contaminated with mucin and Staphylococcus aureus », American Journal of Infection Control, vol. 42, no 3, , p. 265-270 (PMID 24462175, PMCID PMC4469386, DOI 10.1016/j.ajic.2013.09.014, lire en ligne, consulté le ).
- (en) Edward M. Fisher et Ronald E. Shaffer, « A method to determine the available UV-C dose for the decontamination of filtering facepiece respirators », Journal of Applied Microbiology, vol. 110, no 1, , p. 287-295 (ISSN 1365-2672, DOI 10.1111/j.1365-2672.2010.04881.x, lire en ligne, consulté le ).
- (en) Devin Mills, Delbert A. Harnish, Caryn Lawrence et Megan Sandoval-Powers, « Ultraviolet germicidal irradiation of influenza-contaminated N95 filtering facepiece respirators », American Journal of Infection Control, vol. 46, no 7, , e49-e55 (PMID 29678452, PMCID PMC7115285, DOI 10.1016/j.ajic.2018.02.018, lire en ligne, consulté le ).
- (en) Myung-Heui Woo, Adam Grippin, Diandra Anwar et Tamara Smith, « Effects of Relative Humidity and Spraying Medium on UV Decontamination of Filters Loaded with Viral Aerosols », Applied and Environmental Microbiology, vol. 78, no 16, , p. 5781-5787 (ISSN 0099-2240 et 1098-5336, PMID 22685135, PMCID PMC3406129, DOI 10.1128/AEM.00465-12, lire en ligne, consulté le ).
- (en) Michael B. Lore, Brian K. Heimbuch, Teanne L. Brown et Joseph D. Wander, « Effectiveness of Three Decontamination Treatments against Influenza Virus Applied to Filtering Facepiece Respirators », The Annals of Occupational Hygiene, vol. 56, no 1, , p. 92-101 (ISSN 0003-4878, DOI 10.1093/annhyg/mer054, lire en ligne, consulté le ).
- (en) Brian K. Heimbuch, William H. Wallace, Kimberly Kinney et April E. Lumley, « A pandemic influenza preparedness study: Use of energetic methods to decontaminate filtering facepiece respirators contaminated with H1N1 aerosols and droplets », American Journal of Infection Control, vol. 39, no 1, , e1-e9 (ISSN 0196-6553, DOI 10.1016/j.ajic.2010.07.004, lire en ligne, consulté le ).
- (en) W. B. Salter, K. Kinney, W. H. Wallace, A. E. Lumley, B. K. Heimbuch, et J. D. Wander, « Analysis of residual chemicals on filtering facepiece respirators after decontamination », Journal of Occupational and Environmental Hygiene, vol. 7, , p. 437-445 (lire en ligne).
- (en) Cynthia Danisile Vuma, Jeanneth Manganyi, Kerry Wilson et David Rees, « The Effect on Fit of Multiple Consecutive Donning and Doffing of N95 Filtering Facepiece Respirators », Annals of Work Exposures and Health, vol. 63, no 8, , p. 930-936 (ISSN 2398-7308, DOI 10.1093/annweh/wxz060, lire en ligne, consulté le ).
- (en) Michael S. Bergman, Dennis J. Viscusi, Ziqing Zhuang et Andrew J. Palmiero, « Impact of multiple consecutive donnings on filtering facepiece respirator fit », American Journal of Infection Control, vol. 40, no 4, , p. 375-380 (ISSN 0196-6553, DOI 10.1016/j.ajic.2011.05.003, lire en ligne, consulté le ).
- (en) Dennis J. Viscusi, Michael S. Bergman, Debra A. Novak et Kimberly A. Faulkner, « Impact of Three Biological Decontamination Methods on Filtering Facepiece Respirator Fit, Odor, Comfort, and Donning Ease », Journal of Occupational and Environmental Hygiene, vol. 8, no 7, , p. 426-436 (ISSN 1545-9624 et 1545-9632, DOI 10.1080/15459624.2011.585927, lire en ligne, consulté le ).
- (en) William G. Lindsley, Stephen B. Martin Jr, Robert E. Thewlis et Khachatur Sarkisian, « Effects of Ultraviolet Germicidal Irradiation (UVGI) on N95 Respirator Filtration Performance and Structural Integrity », Journal of Occupational and Environmental Hygiene, vol. 12, no 8, , p. 509-517 (ISSN 1545-9624, PMID 25806411, PMCID PMC4699414, DOI 10.1080/15459624.2015.1018518, lire en ligne, consulté le ).
- (en) E. J. Sinkule, J. B. Powell, et F. L. Goss, « Evaluation of N95 respirator use with a surgical mask cover: effects on breathing resistance and inhaled carbon dioxide », The Annals of Occupational Hygiene, vol. 57, no 3, , p. 384-398 (lire en ligne).
- (en) Raymond J. Roberge, Aitor Coca, W. Jon Williams et Andrew J. Palmiero, « Surgical mask placement over N95 filtering facepiece respirators: Physiological effects on healthcare workers », Respirology, vol. 15, no 3, , p. 516-521 (ISSN 1440-1843, DOI 10.1111/j.1440-1843.2010.01713.x, lire en ligne, consulté le ).
- (en) Lisa Casanova, William A. Rutala, David J. Weber et Mark D. Sobsey, « Coronavirus Survival on Healthcare Personal Protective Equipment », Infection Control & Hospital Epidemiology, vol. 31, no 05, , p. 560-561 (ISSN 0899-823X et 1559-6834, DOI 10.1086/652452, lire en ligne, consulté le ).
- (en) A. D. Coulliette, K. A. Perry, J. R. Edwards et J. A. Noble-Wang, « Persistence of the 2009 Pandemic Influenza A (H1N1) Virus on N95 Respirators », Applied and Environmental Microbiology, vol. 79, no 7, , p. 2148-2155 (ISSN 0099-2240 et 1098-5336, PMID 23335770, PMCID PMC3623216, DOI 10.1128/AEM.03850-12, lire en ligne, consulté le ).
- (en) Edward Fisher et Ronald Shaffer, « Survival of Bacteriophage MS2 on Filtering Facepiece Respirator Coupons », Applied Biosafety, vol. 15, no 2, , p. 71-76 (ISSN 1535-6760 et 2470-1246, DOI 10.1177/153567601001500205, résumé, lire en ligne, consulté le ).
- (en) Gerardo U. Lopez, Charles P. Gerba, Akrum H. Tamimi et Masaaki Kitajima, « Transfer Efficiency of Bacteria and Viruses from Porous and Nonporous Fomites to Fingers under Different Relative Humidity Conditions », Applied and Environmental Microbiology, vol. 79, no 18, , p. 5728-5734 (ISSN 0099-2240 et 1098-5336, PMID 23851098, PMCID PMC3754157, DOI 10.1128/AEM.01030-13, lire en ligne, consulté le ).
- (en) Edward M. Fisher, Caroline M. Ylitalo, Narina Stepanova, Ronald E. Shaffer, « Assessing Filtering Facepiece Respirator Contamination During Patient Care in Flu Season: Experimental and Modeling Approaches » [PDF], The International Society for Respiratory Protection (ISRP) : Conférence de Boston, .
- (en) P. Rusin, S. Maxwell et C. Gerba, « Comparative surface-to-hand and fingertip-to-mouth transfer efficiency of gram-positive bacteria, gram-negative bacteria, and phage », Journal of Applied Microbiology, vol. 93, no 4, , p. 585-592 (ISSN 1365-2672, DOI 10.1046/j.1365-2672.2002.01734.x, résumé, lire en ligne, consulté le ).
- (en) Edward M. Fisher, Aaron W. Richardson, Shannon D. Harpest et Kent C. Hofacre, « Reaerosolization of MS2 Bacteriophage from an N95 Filtering Facepiece Respirator by Simulated Coughing », The Annals of Occupational Hygiene, vol. 56, no 3, , p. 315-325 (ISSN 0003-4878, DOI 10.1093/annhyg/mer101, lire en ligne, consulté le ).
- (en) Jeffrey S. Birkner, David Fung, William C. Hinds et Nola J. Kennedy, « Particle Release from Respirators, Part I: Determination of the Effect of Particle Size, Drop Height, and Load », Journal of Occupational and Environmental Hygiene, vol. 8, no 1, , p. 1-9 (ISSN 1545-9624, PMID 21132594, DOI 10.1080/15459624.2011.534975, lire en ligne, consulté le ).
- (en) Nola J. Kennedy et William C. Hinds, « Release of Simulated Anthrax Particles from Disposable Respirators », Journal of Occupational and Environmental Hygiene, vol. 1, no 1, , p. 7-10 (ISSN 1545-9624, PMID 15202151, DOI 10.1080/15459620490250017, lire en ligne, consulté le ).
- (en) Yinge Qian, Klaus Willeke, Sergey A. Grinshpun et Jean Donnelly, « Performance of N95 Respirators: Reaerosolization of Bacteria and Solid Particles », American Industrial Hygiene Association Journal, vol. 58, no 12, , p. 876-880 (ISSN 0002-8894, PMID 9425648, DOI 10.1080/15428119791012216, résumé).
- (en) Klaus Willeke et Yinge Qian, « Tuberculosis control through respirator wear: Perforance of National Institute for Occupational Safety and Health-regulated respirators », American Journal of Infection Control, vol. 26, no 2, , p. 139-142 (ISSN 0196-6553, DOI 10.1016/s0196-6553(98)80033-3, résumé).
- « Recommandation (UE) 2020/403 de la Commission du 13 mars 2020 relative aux procédures d’évaluation de la conformité et de surveillance du marché dans le contexte de la menace que représente le COVID-19 », Journal officiel de l'Union européenne, EUR-Lex, (consulté le ).
- https://www.who.int/fr/news-room/q-a-detail/q-a-on-covid-19-and-masks
- oronavirus disease 2019 (COVID-19) in the EU/EEA and the UK – eleventh update, 10 August 2020
- « Votre masque de protection a-t-il été fabriqué sous la contrainte? », sur Lecho.be,
- « Covid-19 : des masques dotés d'une puce RFID », sur Scoop.fr, (consulté le )
Voir aussi
Articles connexes
Liens externes
- Ressource relative à la santé :
- (no + nn + nb) Store medisinske leksikon
- Jacques Lavoie, Yves Cloutier, Jaime Lara et Geneviève Marchand, « Guide sur la protection respiratoire contre les bioaérosols » [PDF], Institut régional du travail social (IRTS), .