Maïtotoxine
La maïtotoxine (MTX-1) est une phycotoxine extrêmement puissante produite par Gambierdiscus toxicus, une microalgue du groupe des dinoflagellés qui, ingérée par des poissons tels que Ctenochaetus striatus, appelé maïto à Tahiti, rendent ces derniers toxiques en provoquant des intoxications alimentaires appelées ciguatera.
| Maïtotoxine | |
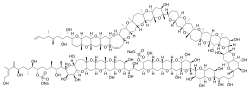 Structure de la maïtotoxine |
|
| Identification | |
|---|---|
| Synonymes |
MTX-1 |
| No CAS | |
| No ECHA | 100.227.039 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C164H258Na2O68S2 [Isomères] |
| Masse molaire[1] | 3 427,872 ± 0,18 g/mol C 57,46 %, H 7,59 %, Na 1,34 %, O 31,74 %, S 1,87 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
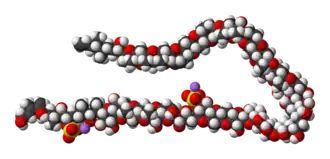
La molécule, dont la masse est de 3,425 kDa, est l'une des biomolécules les plus grosses et les plus complexes qui ne soient ni un polysaccharide, ni un polypeptide, ni un polynucléotide. Elle comprend 32 cycles fusionnés (dont 28 à six atomes, trois à sept atomes et un à huit atomes), 32 liaisons éther, 28 hydroxyles, 22 méthyles et deux éthers sulfuriques, qui forment une chaîne en C142. Malgré cette structure complexe, cette molécule est stable à température élevée.
La maïtotoxine agit en activant des canaux ioniques non sélectifs perméables aux cations de calcium Ca2+, ce qui accroît la concentration cytosolique en Ca2+. On pense que la maïtotoxine forme des pores sur ces canaux. Cela déclenche l'apoptose des cellules touchées, dont la membrane plasmique se détache du cytosquelette pour former des vésicules ou « bulles » en conduisant finalement à la lyse des cellules[2].
La maïtotoxine active les calpaïnes 1 et 2, des peptidases activées par les ions Ca2+, ce qui contribue à la nécrose[3]. La toxicité de cette molécule chez la souris est la plus élevée des toxines non protéiques : sa dose létale médiane est de l'ordre de DL50 = 50 ng·kg-1.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Mark Estacion et William P Schilling*, « Maitotoxin-induced membrane blebbing and cell death in bovine aortic endothelial cells », BMC Physiology, vol. 1, no 2, (DOI 10.1186/1472-6793-1-2, lire en ligne)
- (en) Kevin K.W. Wang, Rathna Nath, Kadee J. Raser et Iradj Hajimohammadreza2, « Maitotoxin Induces Calpain Activation in SH-SY5Y Neuroblastoma Cells and Cerebrocortical Cultures », Archives of Biochemistry and Biophysics, vol. 331, no 2, , p. 208-214 (PMID 8660700, DOI 10.1006/abbi.1996.0300, lire en ligne)