Iodoacétamide
L'iodoacétamide (IAA) est un composé organo-iodé de formule brute C2H4INO. C'est un agent alkylant utilisé dans la cartographie des peptides. Son action est semblable à celle de l'acide iodoacétique. Il est communément utilisé pour se lier de façon covalente avec le groupe thiol de la cystéine afin que cette protéine ne forme pas de liaison disulfure[6] - [7]. Il est aussi utilisé dans les études sur l'ubiquitine comme inhibiteur des désubiquitinases (DUB) car il alkyle les résidus de cystéine sur le site actif des DUB. L'iodoacétamide peut également induire une gastrite légère et est utilisé dans les modèles de sensibilisation gastrique chronique (iodoacétamide 0.1% dans l'eau de boisson du rongeur durant 7 jours)[8]. Comme beaucoup d'autres agents alkylants, l'iodacétamide est très toxique. Sur les souris de laboratoire, il a été montré qu'il peut provoquer des tumeurs de la peau et affecter négativement leur reproduction.
| Iodoacétamide | |||
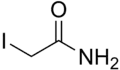  Structure de l'iodoacétamide |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Iodoacétamide | ||
| No CAS | |||
| No ECHA | 100.005.119 | ||
| No CE | 205-630-1 | ||
| No RTECS | AC4200000 | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | cristal jaune clair[1] | ||
| Propriétés chimiques | |||
| Formule | C2H4INO [Isomères] |
||
| Masse molaire[2] | 184,963 7 ± 0,002 4 g/mol C 12,99 %, H 2,18 %, I 68,61 %, N 7,57 %, O 8,65 %, |
||
| Propriétés physiques | |||
| T° fusion | 92 à 95 °C[1] | ||
| Solubilité | 100 g·l-1 (eau)[1] | ||
| Précautions | |||
| SGH[1] | |||
  |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 50 mg/kg (souris, intrapéritonéal)[3] 56 mg/kg (souris, i.v.)[4] 7 4mg/kg (souris, oral)[5] |
||
| LogP | 0,04[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Inhibiteur de peptidase
L'iodoacétamide est un inhibiteur irréversible de toutes les cystéine peptidases, ce mécanisme d'inhibition se faisant par alkylation des résidus cystéine :
 Schéma de l'inhibition irréversible de peptidases de cystéine par l'iodoacétamide.
Schéma de l'inhibition irréversible de peptidases de cystéine par l'iodoacétamide.
Comparé à l'acide carboxylique, l'acide iodoacétique réagit de façon sensiblement plus rapide. Cette observation semble contradictoire avec la réactivité chimique standard de ces groupes fonctionnels, cependant l'existence d'interactions favorables entre le cation imidazolium de l'histidine et le groupe carboxylate chargé négativement semble être la raison de cette réactivité relative accrue par rapport à l'iodoacétamide[9].
Notes et références
- Fiche Sigma-Aldrich du composé Iodoacetamide, consultée le 19 juin 2012.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- National Technical Information Service. Vol. AD277-689
- U.S. Army Armament Research & Development Command, Chemical Systems Laboratory, NIOSH Exchange Chemicals. Vol. NX#02060
- Archives of Toxicology. Vol. 47, Pg. 179, 1981 Pubmed
- (en) Smythe CV, « The reactions of Iodoacetate and of Iodoacetamide with various Sulfhydryl groups, with Urease, and with Yeast preparations », J. Biol. Chem., vol. 114, no 3, , p. 601–12 (lire en ligne)
- (en) Anson ML, « The reactions of Iodine and Iodoacetamide with native Egg Albumin », J. Gen. Physiol., vol. 23, no 3, , p. 321–31 (PMID 19873158, PMCID 2237930, DOI 10.1085/jgp.23.3.321)
- (en) Laura Piqueras & Vicente Martinez, « Gastric hypersecretion associated to iodoacetamide-induced mild gastritis in mice », Gastroenterology, vol. 124, no 4, , A443 (lire en ligne)
- (en) Polgar, L, « Deuterium isotope effects on papain acylation. Evidence for lack of general base catalysis and for enzyme-leaving group. interaction », Eur. J. Biochem., vol. 98, no 2, , p. 369–374 (PMID 488108, DOI 10.1111/j.1432-1033.1979.tb13196.x)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « iodoacetamide » (voir la liste des auteurs).
Liens externes
- (en) La base de données MEROPS répertorie les peptidases ainsi que leurs inhibiteurs : « Iodoacétamide »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )

