Hexafluorure d'uranium
L'hexafluorure d'uranium (UF6) est un composé utilisé dans le procédé d'enrichissement de l'uranium. Son utilisation industrielle est liée au cycle du combustible nucléaire (procédé qui produit du combustible pour les réacteurs nucléaires et les armes nucléaires). Sa synthèse chimique, qui intervient après l'extraction de l'uranium, fournit ensuite l'entrée au procédé d'enrichissement.
| Hexafluorure d'uranium | |
  |
|
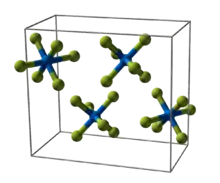
| __ U6+ __ F− Molécule et structure cristalline de l'hexafluorure d'uranium. |
|
| Identification | |
|---|---|
| Nom UICPA | hexafluorouranium |
| Synonymes |
fluorure d'uranium(VI) |
| No CAS | |
| No ECHA | 100.029.116 |
| No CE | 232-028-6 |
| PubChem | 24560 |
| ChEBI | 30235 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores à blancs, déliquescents[1]. |
| Propriétés chimiques | |
| Formule | UF6 |
| Masse molaire[2] | 352,019 33 ± 3,0E−5 g/mol F 32,38 %, U 67,62 %, |
| Moment dipolaire | nul |
| Propriétés physiques | |
| T° fusion | 64,8 °C |
| T° ébullition | 56,5 °C (sublimation) |
| Solubilité | dans l'eau à 20 °C : réaction[1] |
| Masse volumique | 5,09 g·cm−3 solide |
| Pression de vapeur saturante | à 20 °C : 14,2 kPa[1] |
| Point critique | 46,6 bar, 232,65 °C[3] |
| Point triple | 64 °C, 150 kPa |
| Thermochimie | |
| S0solide | 228 J·K−1·mol−1 |
| ΔfH0solide | −2317 kJ/mol |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 14,00 ± 0,10 eV (gaz)[4] |
| Cristallographie | |
| Système cristallin | orthorhombique |
| Classe cristalline ou groupe d’espace | Pnma (no 62) |
| Paramètres de maille | a = 990,0 pm, b = 896,2 pm, c = 520,7 pm, Z = 4. |
| Précautions | |
 Composé radioactif |
|
| SGH[5] | |
   Danger |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Propriétés physiques
L'hexafluorure d'uranium est solide à température ambiante (~20 °C), il se présente sous la forme de cristaux gris dans les conditions normales de température et de pression (CNTP).
 Cristaux de l'hexafluorure d'uranium dans une ampoule en verre.
Cristaux de l'hexafluorure d'uranium dans une ampoule en verre.
Sa pression de vapeur arrive à 1 atmosphère à 56,4 °C. Dans un milieu ouvert à l'air, il se sublime de façon irréversible.
Sa phase liquide apparait à partir de son point triple, à 1,5 atm et à 64 °C (337 K).
La diffraction neutronique a été utilisée pour déterminer la structure de UF6, MoF6 et WF6 à 77 K[6].
 Structure cristalline de l'hexafluorure d'uranium[7].
Structure cristalline de l'hexafluorure d'uranium[7].
Propriétés chimiques
Outre sa radioactivité due à l'uranium, c'est un produit hautement toxique, qui réagit violemment avec l'eau. En atmosphère humide ou en présence d'eau, il se transforme en fluorure d'uranyle (UO2F2) et acide fluorhydrique (HF). La transformation est immédiate et violente et s'accompagne d'émission d'abondantes fumées opaques, irritantes et suffocantes de HF.
Le produit est corrosif pour la plupart des métaux. Il réagit faiblement avec l'aluminium, formant une fine couche de AlF3 qui résiste ensuite à la corrosion (passivation).
Il a été montré que l'hexafluorure d'uranium est un oxydant et un acide de Lewis qui peut se lier à un fluorure, par exemple la réaction du fluorure de cuivre avec l'hexafluorure d'uranium dans l'acétonitrile est réputée former Cu[UF7]2·5 MeCN[8].
Les fluorures d'uranium(VI) polymères contenant des cations organiques ont été isolés et caractérisés par diffraction de rayons X[9].
Autres fluorures d'uranium
Le pentafluorure d'uranium (UF5) et le nonafluorure de diuranium (U2F9) ont été caractérisés par C.J. Howard, J.C Taylor et A.B. Waugh[10].
Le trifluorure d'uranium a été caractérisé par J. Laveissiere[11].
La structure de UOF4 a été décrite par J.H. Levy, J.C. Taylor et P.W. Wilson[12].
Tous les autres fluorures d'uranium sont des solides non volatils qui sont des polymères de coordination.
Applications industrielles
Enrichissement de l'uranium
L'hexafluorure d'uranium est utilisé dans les deux principales méthodes d'enrichissement de l'uranium, la diffusion gazeuse et l'ultracentrifugation, car il possède un point triple à 64 °C et à une pression légèrement plus élevée que la pression atmosphérique. De plus, le fluor possède un seul isotope naturel stable (19F), par conséquent les masses moléculaires des isotopomères de l'UF6 différent uniquement par l'isotope d'uranium présent : U-238, U-235, ou U-234[13].
En plus de son usage dans l'enrichissement, l'hexafluorure d'uranium a été utilisé dans un procédé de retraitement avancé développé en République tchèque. Dans ce procédé, le combustible nucléaire : l'oxyde d'uranium usagé est traité avec du fluor pour former un mélange de fluorures. Ce dernier est ensuite distillé pour séparer les différents types de matériaux.
Conversion en oxyde d'uranium
Après enrichissement, l'hexafluorure d'uranium est converti en oxyde d'uranium (UO2) pour ses applications nucléaires.
La conversion en UO2 peut se faire par voie sèche (le plus fréquemment) ou par voie humide.
- Voie sèche
- L'UF6 est vaporisé par chauffage dans une étuve et mis en présence de vapeur d'eau surchauffée.
- L'UF6 s'hydrolyse en UO2F2 entre 250 °C et 300 °C : UF6 + 2H2O –––> UO2F2 + 4HF Dr - 113 kJ/mole
- Le composé UO2F2 est ensuite réduit vers 700 à 800 °C par l'hydrogène, produisant l'UO2 sous forme de poudre : UO2F 2+ H2 –––> UO2 + 2HF + 14,2 kJ/mole
Le rendement est supérieur à 99,5 %.
- Voie humide
Ce procédé présente l'inconvénient de produire plus d'effluents que la voie sèche, ce qui a un impact environnemental plus important. Plus flexible, en revanche, il est souvent utilisé pour la récupération des matières fissiles dans les rebuts et les déchets.
Les étapes consistent en un traitement de l'UF6 à la vapeur d'eau et en l'obtention, successivement, d'UO2F2, sels d'uranium, diuranate d'ammonium, UO3 et UF4. Ce procédé enchaine dissolution en milieu nitrique, purification par solvant en colonne pulsée, précipitation ammoniacale et réduction sous hydrogène.
Entreposage et stockage
- États-Unis

Aux États-Unis, environ 95 % de l'uranium appauvri produit jusqu'à présent est stocké sous forme d'hexafluorure d'uranium UF6 dans des réservoirs en acier sur des parcs en plein air à proximité des usines d'enrichissement. Chaque réservoir contient jusqu'à 12,7 tonnes d'UF6. L'hexafluorure d'uranium est introduit sous forme liquide dans le réservoir. Après refroidissement, la majeure partie du liquide se solidifie pour occuper environ 60 % du réservoir tandis que le reste de l'espace est occupé par de l'hexafluorure sous forme gazeuse. Ce gaz réagit avec l'acier de la surface interne du réservoir et forme une couche protectrice vis-à-vis de la corrosion.
560 000 tonnes d'UF6 appauvri étaient stockés en 1993 et 686 500 tonnes en 2005 dans 57 122 réservoirs de stockage situés à Portsmouth dans l'Ohio, Oak Ridge dans le Tennessee et Paducah dans le Kentucky[14] - [15].
Cet entreposage présente des risques environnementaux, sanitaires et de sûreté à cause de son instabilité chimique. Quand l'UF6 est en contact avec de l'air humide, il réagit avec l'eau contenue dans l'air pour produire UO2F2 (fluorure d'uranyle) et HF (fluorure d'hydrogène) qui sont tous deux très solubles et toxiques. Les réservoirs de stockage doivent être régulièrement inspectés pour rechercher des traces de corrosion ou des fuites. La durée de vie estimée d'un réservoir en acier se mesure en décennies[16].
Le gouvernement des États-Unis a commencé à convertir le UF6 en oxyde d'uranium solide pour un stockage à long terme[17]. Un tel stockage de l'ensemble du stock du UF6 pourrait coûter entre 15 millions et 450 millions de dollars[18].
Risques industriels
L'UF6 émet des rayonnements alpha, bêta et gamma. Exposé à la vapeur d'eau, l'UF6 se décompose en acide fluorhydrique (HF) et en fluorure d'uranyle (UO2F2) qui sont très toxiques[19].
Il y a eu plusieurs accidents impliquant le fluorure d'uranium aux États-Unis. Ces accidents ont causé 2 morts en 1944 et un mort en 1986[20] - [21].
Le , une fuite d'hexafluorure d'uranium est survenue à l'Usine Honeywell de transformation de l'uranium: 7 personnes situées sous le panache ont souffert de brûlures et 7 à 10 autres personnes sur le site ou à proximité ont également subi des blessures[19].
Notes et références
- HEXAFLUORURE D'URANIUM, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- (en) J.H. Levy, J.C Taylor, A.B Waugh, « Neutron powder structural studies of UF6, MoF6 and WF6 at 77 K », J. Fluor. Chem., vol. 23, , p. 29–36 (DOI 10.1016/S0022-1139(00)81276-2)
- J. C. Taylor, P. W. Wilson, J. W. Kelly: „The structures of fluorides. I. Deviations from ideal symmetry in the structure of crystalline UF6: a neutron diffraction analysis“, Acta Cryst., 1973, B29, p. 7–12; DOI 10.1107/S0567740873001895.
- (en) Berry JA, Poole RT, Prescott A, Sharp DWA, Winfield JM, « The oxidising and fluoride ion acceptor properties of uranium hexafluoride in acetonitrile », J. Chem. Soc. Dalton Trans., , p. 272 (DOI 10.1039/DT9760000272)
- (en) Walker SM, Halasyamani PS, Allen S, O'Hare D, « From Molecules to Frameworks: Variable Dimensionality in the UO2(CH3COO)2·2H2O/HF(aq)/Piperazine System. Syntheses, Structures, and Characterization of Zero-Dimensional (C4N2H12)UO2F4·3H2O, One-Dimensional (C4N2H12)2U2F12·H2O, Two-Dimensional (C4N2H12)2(U2O4F5)4·11H2O, and Three-Dimensional (C4N2H12)U2O4F6 », J. Am. Chem. Soc., vol. 121, , p. 10513 (DOI 10.1021/ja992145f)
- (en) Howard CJ, Taylor JC, Waugh AB, « Crystallographic parameters in α-UF5 and U2F9 by multiphase refinement of high-resolution neutron powder data », J. Solid State Chem., vol. 45, , p. 396–398 (DOI 10.1016/0022-4596(82)90185-2)
- (en) Laveissiere J, « Application de la diffraction de neutrons à l'étude de la structure cristalline du trifluorure d'uranium UF3 », Bulletin de la Société française de minéralogie et de cristallographie, vol. 90, , p. 304–307
- (en) Levy JH, Taylor JC, Wilson PW, « Structure of fluorides. 17. NEUTRON-DIFFRACTION STUDY OF ALPHA-URANIUM OXIDE TETRAFLUORIDE », J. Inorg. Nucl. Chem., vol. 39, , p. 1989–1991
- « Enrichment and the Gaseous Diffusion Process »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- FAQ 16-How much depleted uranium hexafluoride is stored in the United States?
- Documents
- IEER: Science for Democratic Action Vol. 5 No. 2
- FAQ 22-What is going to happen to the uranium hexafluoride stored in the United States?
- FAQ 27-Are there any currently-operating disposal facilities that can accept all of the depleted uranium oxide that would be generated from conversion of DOE's depleted UF6 inventory?
- (en) Reports Differ on Injuries at Metropolis Nuclear Plant Following Leakage of Uranium Hexafluoride - Thursday, October 30, 2014 - by Tony E. Rutherford, News Editor
- FAQ 30-Have there been accidents involving uranium hexafluoride?
- (en) Uranium Hexafluoride (UF6) Tailings, Characteristics,Transport and Storage at the Siberian Chemical Combine (Sibkhimkombinat) Tomsk, novembre 2005 - Rapport du cabinet d'étude antinucléaire Large & Associates pour Greenpeace International
Bibliographie
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, dans: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; (ISBN 1-4020-3555-1), p. 253–698; DOI 10.1007/1-4020-3598-5_5.
- (en) Levy JH, « Structure of fluorides. Part XII. Single-crystal neutron diffraction study of uranium hexafluoride at 293 K », J. Chem. Soc. Dalton Trans., , p. 219 (DOI 10.1039/DT9760000219) x (xstal structure)
- (en) Olah GH, Welch J, « Synthetic methods and reactions. 46. Oxidation of organic compounds with uranium hexafluoride in haloalkane solutions », J. Am. Chem. Soc., vol. 100, , p. 5396 (DOI 10.1021/ja00485a024) x (selective oxidant of CFCs)






