Dégradation de Bergmann
La dégradation Bergmann est une série de réactions chimiques conçues pour supprimer un seul acide aminé de l'acide carboxylique (C-terminal) à la fin d'un peptide[1] - [2]. Démontrée pour la première fois par Max Bergmann en 1934, c'est une méthode rarement utilisée pour le séquençage des peptides[1] - [3]. La dégradation développée plus tard par Edman est une amélioration de la dégradation Bergmann, clivant plutôt le groupement N-terminal des acides aminés des peptides pour produire une hydantoïne contenant l'acide aminé désiré[4] - [5] - [6]. La dégradation Bergmann combine la dégradation de l'azoture du réarrangement de Curtius avec la méthode carbobenzoxy de Bergmann et de Zervas, qu'ils ont conçue pour se produire dans des conditions relativement douces, afin de permettre le séquençage de peptides[1]. Un seul tour de la dégradation Bergmann donne un aldéhyde contenant le résidu d'acide aminé recherché et le fragment restant de peptide d'origine sous une forme amide[3].
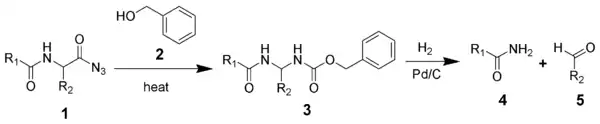
L'azoture d'acyle d'un peptide (1) subit un réarrangement de Curtius en présence d'alcool benzylique et de chaleur(2) pour donner le carbamate de benzyle (3). Le groupement intermédiaire 3 est supprimé par hydrogénolyse pour donner une amide non substituée (4) et un aldéhyde (5).
Mécanisme
La dégradation Bergmann commence par la benzoylation du groupement alpha d'un peptide et la conversion ultérieure en un azoture d'acyle[1]. Comme dans le réarrangement de Curtius, l'azoture d'acyle, en présence de l'alcool benzylique et de chaleur, se réorganise en un intermédiaire isocyanate très réactif, libérant de l'azote gazeux dans le procédé[1]. L'isocyanate à son tour, réagit avec de l'alcool benzylique pour former un benzyluréthane (aussi appelé carboxybenzyle), un composé possédant un groupe protecteur amine carbamate[1] - [3]. L'élimination du groupement protecteur carbamate est effectuée par hydrogénation catalytique en présence d'acide chlorhydrique, suivie d'une addition d'eau bouillante[1] - [3] - [7], ce qui donne un intermédiaire instable qui se réorganise rapidement pour libérer du dioxyde de carbone CO2, poussant la réaction vers l'avant. Ceci conduit à un nouveau réarrangement et à une hydrolyse, aboutissant finalement à la formation d'un aldéhyde portant le résidu d'acide aminé suivant dans la série de séquençage et à l'expulsion du peptide résiduel sous forme amide[3].
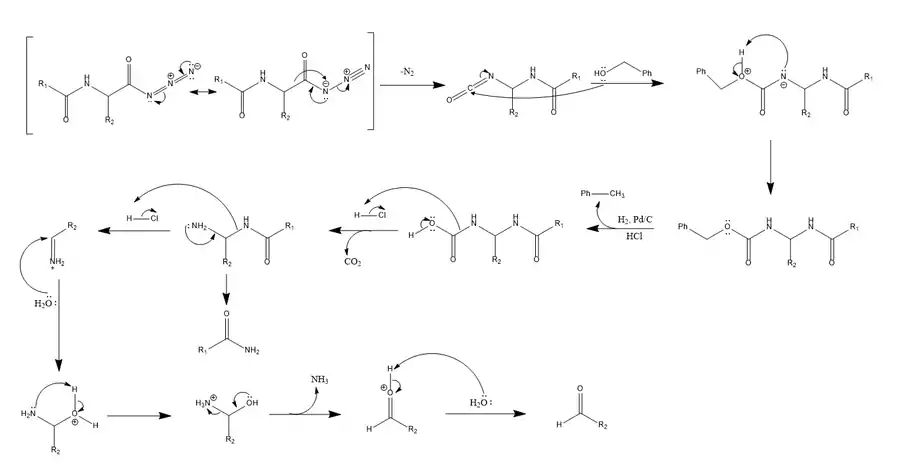
Un mécanisme a été proposé, qui représente l'hydrogénation catalytique du benzyluréthane comme un réarrangement concerté qui libère du dioxyde de carbone en concomitance avec la formation de l'amide[3].
Préparation de l'azoture
La conversion ci-dessus en azoture d'acyle a été réalisée de manière multiforme; Bergmann a utilisé l'ester méthylique du peptide et de l'hydrazide, tandis que les plus récentes tentatives ont conçu des méthodes telles que : nitrosylation du N-formylaminoacylhydrazide et de substitution successive par l'azoture de sodium[7], la réaction d'un acide carboxylique avec le phosphorazidate de diphényle, la triéthylamine et un composant hydroxyle[8], et la réaction entre l'azoture de triméthylsilyle et le groupement anhydride d'un acide aminé[3].
Applications
La dégradation de Bergmann est prévu pour, et a été utilisé comme une méthode de séquençage de peptides[1] - [3]. Il a également été proposé pour cliver la liaison 3,4 du noyau de la pénicilline[3] - [9]. Le composé isocyanate de 2,2-diméthyl-6-phthalimido-3-pénamyle a été obtenu par divers moyens, y compris le réarrangement de Curtius, et il a été envisagé qu'il pourrait subir la dégradation Bergmann pour former l'aldéhyde désiré ainsi que de l'urée en sous-produit[9]. Bien que le dégradation de Bergmann soit effectivement possible, on a découvert qu'une simple hydrolyse acide diluée suffisait à former le produit souhaité[9].
Le réarrangement de Curtius
La dégradation de Bergmann utilise la dégradation de l'azoture décrite par le réarrangement de Curtius[1]. Curtius a également tenté de dégrader les acides aminés benzoylés; toutefois, sa méthode impliquait le fractionnement du carbamate avec un traitement fortement énergique avec des acides, ce qui conduit à la décomposition de l'aldéhyde et des acides aminés résultant[1]. Cela a convaincu Bergmann que la dégradation de l'azoture de Curtius pouvait être suivie d'un traitement par l'alcool benzylique pour isoler l'aldéhyde d'acide aminé résultant et l'amide peptidique résiduel à des fins de séquençage[1].
La dégradation d'Edman
La dégradation d'Edman est une autre méthode de séquençage de peptides qui clive les résidus d'acides aminés N-terminale du peptide[4]. En 1950 Edman a conçu une réaction avec le thiocyanate de phényle (idée qui a été empruntée à partir d'une étude de 1927 par Bergmann, Kann et Miekeley[10]) pour donner des peptides phénylthiocarbamyl suivie d'une hydrolyse dans des conditions relativement douces pour cliver l'acide aminé N-terminal sous forme de phénylthiohydantoïne[4] - [10]. La phénylthiohydantoïne est suffisamment stable pour subir diverses procédures de séquençage comme celles qui impliquent la chromatographie et la spectrométrie de masse[1] - [6]. Ceci a été une amélioration par rapport à une méthode antérieure proposée par Abderhalden et Brockmann, en 1930, qui a démontré la conversion d'acides aminés N-terminaux en une hydantoïne dans des conditions hydrolytiques plus fortes, où un clivage du peptide résiduel s'est avéré problématique[10]. Le principal avantage que la dégradation d'Edman a sur la dégradation de Bergmann est la facilité avec laquelle le peptide résiduel peut réintégrer le procédé en raison de la rétention de sa structure tout au long du clivage séquentiel[5] - [6]. La répétition de la dégradation de Bergmann n'est sans doute pas aussi simple, quand les peptides résiduels sont sous forme amide[3].
Références
- Bergmann, M., « Synthesis and Degradation of Proteins in the Laboratory and in Metabolism », Science, vol. 79, no 2055, , p. 439–45 (PMID 17821739, DOI 10.1126/science.79.2055.439)
- Bergmann, M. et Zervas, L., « A Method for the Stepwise Degradation of Polypeptides », J. Biol. Chem., vol. 113, , p. 341
- Comprehensive Organic Name Reactions and Reagents : Bergmann Degradation, John Wiley & Sons, Inc, , 3824 p. (ISBN 978-0-471-70450-8)
- Pehr Edman, Erik Högfeldt, Lars Gunnar Sillén et Per-Olof Kinell, « Method for Determination of the Amino Acid Sequence in Peptides », Acta Chemica Scandinavica, vol. 4, , p. 283–293 (DOI 10.3891/acta.chem.scand.04-0283)
- R.S. Johnson et Walsh K.A., « Sequence analysis of peptide mixtures by automated integration of Edman and mass spectrometric data », Protein Sci., vol. 1, no 9, , p. 1083–1091 (PMID 1304388, PMCID 2142175, DOI 10.1002/pro.5560010902)
- John Bryan Smith, Peptide Sequencing by Edman degradation, Slough, UK, Macmillan Publisher Ltd., , 1–3 p.
- M. Chorev et Goodman, « Partially modified retro-inverso peptides », Int. J. Pept. Protein Res., vol. 21, no 3, , p. 258–268 (DOI 10.1111/j.1399-3011.1983.tb03103.x)
- K. Ninomiya, Shioiri, T. et Yamada, S., « Phosphorus in organic synthesis—VII », Tetrahedron, vol. 30, no 14, , p. 2151–2157 (DOI 10.1016/S0040-4020(01)97352-1)
- J.C. Sheehan et Brandt, K.G., « A Novel Cleavage of the Penicillin Nucleus », J. Am. Chem. Soc., vol. 87, no 23, , p. 5468–5469 (DOI 10.1021/ja00951a038)
- G.G. Evans et Reith, W.S., « The synthesis of 3-(4'-dimethylamino-3:'5'-dinitrophenyl)hydantoin derivatives of various amino acids and their use for the determination of N-terminal amino acids », The Biochemical Journal, vol. 56, no 1, , p. 111–6 (PMID 13126100, PMCID 1269577, DOI 10.1042/bj0560111)