Chlorure de butyryle
Le chlorure de butyryle ou chlorure de butanoyle est un composé organique de formule chimique CH3CH2CH2COCl. Il s'agit d'un chlorure d'acyle se présentant sous la forme d'un liquide volatil incolore à légèrement jaunâtre avec une forte odeur piquante, soluble dans pratiquement tous les solvants organiques aprotiques, mais qui se décompose en présence d'eau en libérant du chlorure d'hydrogène HCl. Il réagit également violemment en présence d'oxydants forts, de métaux de transition (notamment du fer), de métaux alcalins, de métaux alcalino-terreux, de bases et d'une variété de substances organiques telles que des amines, le diméthylsulfoxyde OS(CH3)2 et les alcools. Ces réactions sont souvent incendiaires et explosives, ce qui impose la plus extrême prudence lorsqu'on manipule du chlorure de butyryle. Le chlorure de butyryle fait partie des halogénures d'acyle susceptibles d'induire des réactions d'acylation (réaction de Friedel-Crafts[5]).
| Chlorure de butyryle | |
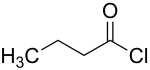
| |
| Structure du chlorure de butyryle | |
| Identification | |
|---|---|
| Nom UICPA | chlorure de butanoyle |
| No CAS | |
| No ECHA | 100.004.999 |
| No CE | 205-498-5 |
| PubChem | 8855 |
| SMILES | |
| InChI | |
| Apparence | liquide volatil incolore à forte odeur piquant[1] |
| Propriétés chimiques | |
| Formule | C4H7ClO [Isomères] |
| Masse molaire[2] | 106,551 ± 0,006 g/mol C 45,09 %, H 6,62 %, Cl 33,27 %, O 15,02 %, |
| Propriétés physiques | |
| T° fusion | −89 °C[3] |
| T° ébullition | 101 °C[3] |
| Solubilité | se décompose au contact de l'eau |
| Masse volumique | 1,03 g·cm-3[3] à 20 °C 1,026 g·cm-3 à 25 °C[4] |
| T° d'auto-inflammation | 280 °C[3] |
| Point d’éclair | 8 °C[3] 18 °C (coupelle fermée)[4] |
| Limites d’explosivité dans l’air | 2,5 %(vol) - 7,3 %(vol)[4] |
| Pression de vapeur saturante | 3,9 kPa[3] à 20 °C |
| Propriétés optiques | |
| Indice de réfraction | = 1,412[4] |
| Précautions | |
| SGH[3] | |
   Danger |
|
| Transport[3] - [4] | |
| Écotoxicologie | |
| CL50 | 464 mg/l (Danio rerio (poison zèbre), 96 h)[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
On peut obtenir le chlorure de butyryle en faisant réagir de l'acide butanoïque CH3CH2CH2COOH avec du chlorure de thionyle Cl2SO :
- CH3CH2CH2COOH + Cl2SO → CH3CH2CH2COCl + SO2 + HCl.
On utilise des dérivés du chlorure de butyryle pour produire des pesticides, des médicaments, des fixateurs de perfums, des catalyseurs de polymérisation et pigments. On l'utilise notamment en synthèse organique pour préparer les substances précitées ainsi que des esters et des peroxydes.
Notes et références
- PubChem CID 8855
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Butyryl chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 juillet 2017 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Butyryl chloride 98%, consultée le 21 juillet 2017. + (pdf) Fiche MSDS
- (en) Hisashi Yamamoto, Koichiro Oshima Main Group Metals in Organic Synthesis, John Wiley & Sons, 2006, p. 370, (ISBN 978-3-527-60535-4).


