Chlorure d'acyle
En chimie organique, un chlorure d'acyle est un composé organique comportant un groupe fonctionnel -CO-Cl, leur formule générale étant usuellement noté RCOCl, R étant une chaîne latérale. On les considère en général comme des dérivés réactifs des acides carboxyliques. Ils sont l'un des plus importants sous-groupes des halogénures d'acyle.
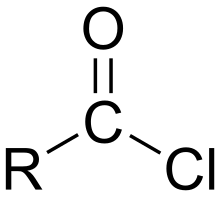
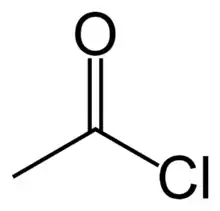
Nomenclature
Lorsque la fonction chlorure d'acyle est le groupe prioritaire, les chlorures d'acyle sont nommés d'après leur acide carboxylique parent en substituant le mot « acide » par « chlorure », le suffixe « ique » par « yle » et en insérant un « de » (ou « d' ») entre les deux mots :
- l'acide acétique/éthanoïque devient le chlorure d'acétyle/éthanoyle, CH3COCl ;
- l'acide benzoïque devient le chlorure de benzoyle C6H5COCl.
Lorsqu'un autre groupe est prioritaire, la présence d'un groupe chlorure d'acyle impose l'ajout d'un préfixe « chlorocarbonyl- » au nom de la molécule[1] : ex. : acide (chlorocarbonyl)acétique, ClOCCH2COOH. Le préfixe « chloroformyl- » est aussi parfois rencontré, ex. : éthyl-6-(chloroformyl)hexanoate.
Propriétés
N'ayant pas la possibilité de former des liaisons hydrogène, les chlorures d'acyle ont des points de fusion et d'ébullition inférieurs à leur acide carboxylique correspondant. Par exemple, l'acide acétique bout à 118 °C alors que le chlorure d'acétyle bout à 51 °C. Comme la plupart des composés carbonylés, ils ont une bande d'absorption à 1 750 cm−1 en spectroscopie infrarouge.
Synthèses
Dans l'industrie
La méthode de synthèse industrielle du chlorure d'acétyle implique la réaction de l'anhydride acétique avec le chlorure d'hydrogène. Pour le chlorure de benzoyle, on utilise l'hydrolyse partielle du (trichlorométhyl)benzène[2] : C6H5CCl3 + H2O → C6H5C(O)Cl + 2HCl
En laboratoire
Au laboratoire, les chlorures d'acyle sont généralement préparés de la même façon que les chlorures d'alkyle, en remplaçant le groupe -OH d'un carboxyle par un chlorure. On traite ainsi les acides carboxyliques avec le chlorure de thionyle (SOCl2), le trichlorure de phosphore (PCl3) ou le pentachlorure de phosphore (PCl5)[3] :
- RCOOH + SOCl2 → RCOCl + SO2 + HCl
- 3 RCOOH + PCl3 → 3 RCOCl + H3PO3
- RCOOH + PCl5 → RCOCl + POCl3 + HCl
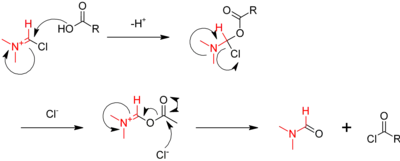
La réaction avec le chlorure de thionyle peut être catalysée par le diméthylformamide[4]. Dans cette réaction, le dioxyde de soufre (SO2) et le chlorure d'hydrogène (HCl) générés sont gazeux et peuvent donc s'échapper du milieu réactionnel, déplaçant la réaction dans le sens de la synthèse. Un excès de chlorure de thionyle (point d'ébullition de 74,6 °C) peut aussi facilement être évaporé[3]. Les mécanismes réactionnels des réactions avec le chlorure de thionyle ou le pentachlorure de phosphore sont similaires, celui avec le chlorure de thionyle est présenté ci-dessous [4] :
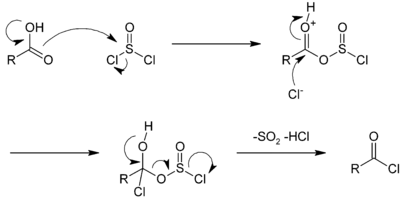
La première étape consiste en une substitution nucléophile du carboxyle sur le chlorure de thionyle libérant un ion chlorure. Cet ion vient ensuite s'additionner au carbone du groupe carboxyle, puis le composé se réorganise en chlorure d'acyle, libérant l'ion H+ du groupe hydroxyle, du dioxyde soufre en un ion chlorure.
Un autre méthode consiste à utilise le chlorure d'oxalyle : RCOOH + ClCOCOCl → RCOCl + CO + CO2 + HCl
Cette réaction est catalysée par le diméthylformamide (DMF), qui réagit avec le chlorure d'oxalyle dans la première étape pour donner un intermédiaire iminium :
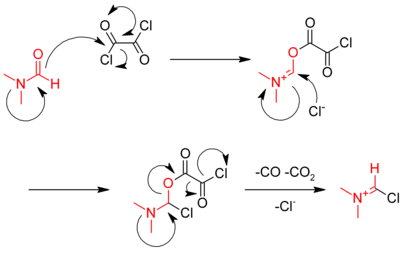
L'iminium réagit ensuite avec l'acide carboxylique, en lui arrachant un oxygène et lui transférant son chlorure régénérant le catalyseur[4] :
On utilise aussi des méthodes qui ne libèrent pas d'HCl, telles que la réaction d'Appel[5] : RCOOH + Ph3P + CCl4 → RCOCl + Ph3PO + HCCl3
ou l'utilisation du chlorure cyanurique (C3N3Cl3)[6] :

Réactions
Réactions nucléophiles
Les chlorures d'acyle sont très réactifs, notamment comparés à leurs analogues acides carboxyliques, l'ion chlorure étant un excellent groupe partant alors que le groupe -OH du carboxyle part difficilement dans des conditions normales. Même un nucléophile faible peut attaquer le carbonyle. Une réaction commune — en général parasite — est la réaction avec l'eau formant un acide carboxylique :
- RCOCl + H2O → RCO2H + HCl
Les chlorures d'acyles peuvent être utilisés pour synthétiser des dérivés acyles, comme les anhydrides d'acide, les esters ou les amides en les faisant réagir respectivement avec un sel d'acide carboxylique, un alcool, ou une amine, réactions appelées substitutions nucléophiles d'acyle. L'utilisation d'une base soude ou pyridine par exemple[3] ou un excès d'amine (lors de la préparation d'amides)[4] est désirable pour supprimer le chlorure d'hydrogène produit et pour catalyser la réaction. S'il est généralement possible de former des esters ou des amides à partir des acides carboxyliques et des alcools/amines, ces réactions sont réversibles, ce qui cause un rendement bas. Au contraire, les réactions de synthèse d'esters ou d'amides via les chlorures d'acyles (eux-mêmes synthétisés à partir des acides carboxyliques) sont rapides et irréversibles, ainsi il est souvent préférable de choisir la voie à deux étapes (former le chlorure d'acyle pour faire réagir celui-ci avec l'alcool ou l'amine) que la voie à une seule étape[3].
Avec des carbones nucléophiles tels que les réactifs de Grignard, les chlorures d'acyle réagissent d'abord une première fois pour donner une cétone, puis réagissent une seconde fois pour donner l'alcool tertiaire équivalent. Une exception notable est la réaction avec certains organocadmiens où la réaction s'arrête à l'étape de la cétone. La réaction nucléophile avec le réactif de Gilman (diorganocuprate lithié) permet aussi de produire des cétones, du fait de sa réactivité moindre[3]. Les chlorures d'acyles d'acides aromatiques sont généralement moins réactifs que ceux des acides d'alkyle et nécessitent donc des conditions plus dures pour les faire réagir.
Les chlorures d'acyle sont réduits en alcools primaires par les donneurs d'hydrure forts, tels que le tétrahydruroaluminate de lithium et l'hydrure de diisobutylaluminium (DIBAL). L’hydrure de lithium et tri-tert-butoxyaluminium, un donneur d'hydrure encombré, réduit les chlorures d'acyles en aldéhydes, tout comme la réduction de Rosenmund qui utilise du dihydrogène sur un catalyseur au palladium empoisonné[7].
Réactions électrophiles
Avec une catalyse par un acide de Lewis tel que le chlorure ferrique ou le chlorure d'aluminium, les chlorures d'acyles peuvent servir dans l'acylation de Friedel-Crafts pour donner une phénone[3] :
Dans la première étape, l'acide de Lewis provoque une dissociation du chlorure :
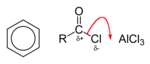
Cette étape est suivie par une attaque nucléophile de l'arène sur le groupe acyle :

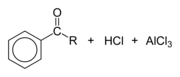
Finalement, le chlorure se recombine avec l'ion hydrogène libéré par l'arène pour former HCl et le catalyseur AlCl3 est régénéré :
Risques
À cause de leur réactivité, des précautions doivent être prises lorsque les chlorures d'acyles sont manipulés. Ils sont lacrymogènes car ils réagissent avec l'eau à la surface de l'œil en produisant de l'acide chlorhydrique et des acides organiques irritant l'œil. Des problèmes similaires peuvent apparaître à la suite de l'inhalation de vapeur de chlorures d'acyle.
Notes et références
- Nomenclature of Organic Chemistry, R-5.7.6 Acid halides
- Takao Maki, Kazuo Takeda “Benzoic Acid and Derivatives” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI 10.1002/14356007.a03_555
- (en) Boyd, Robert W.; Morrison, Robert, Organic chemistry, Englewood Cliffs, N.J, Prentice Hall, , 1278 p. (ISBN 0-13-643669-2), p. 666–762
- (en) Clayden, Jonathan, Organic chemistry, Oxford, Oxford University Press, , 1508 p. (ISBN 0-19-850346-6), p. 276–296
- "Triphenylphosphine-carbon tetrachloride Taschner, Michael J. e-EROS: Encyclopedia of Reagents for Organic Synthesis, 2001
- (en) K. Venkataraman, and D. R. Wagle, « Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides », Tet. Lett., vol. 20, no 32, , p. 3037–3040 (DOI 10.1016/S0040-4039(00)71006-9)
- (en) William Reusch, « Carboxylic Acid Derivatives », VirtualText of Organic Chemistry, Michigan State University
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Acyl chloride » (voir la liste des auteurs).