Chlorure de benzoyle
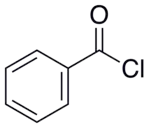
Le chlorure de benzoyle, aussi appelé chlorure de benzènecarbonyle, est le chlorure de l'acide benzoïque et a pour formule semi-développée C7H5COCl. C'est un liquide incolore, fumant et d'odeur irritante. Il est principalement utilisé pour la production de peroxydes organiques mais aussi dans d'autres domaines comme la production de colorants, de parfums, pharmacologique et de résines.
| Chlorure de benzoyle | |||
   |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | chlorure de benzoyle | ||
| Synonymes |
chlorure de l'acide benzoïque |
||
| No CAS | |||
| No ECHA | 100.002.464 | ||
| No CE | 202-710-8 | ||
| No RTECS | DM6600000 | ||
| PubChem | 7412 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore d'une odeur pénétrante | ||
| Propriétés chimiques | |||
| Formule | C7H5ClO [Isomères] |
||
| Masse molaire[1] | 140,567 ± 0,008 g/mol C 59,81 %, H 3,59 %, Cl 25,22 %, O 11,38 %, |
||
| Propriétés physiques | |||
| T° fusion | −1 °C[2] | ||
| T° ébullition | 198 °C[2] | ||
| Paramètre de solubilité δ | 20,4 J1/2·cm-3/2 (25 °C)[3] | ||
| Masse volumique | 1,21 g·cm-3 [4] 1,211 g·cm-3 à 25 °C[2] |
||
| T° d'auto-inflammation | 360 °C[4] 568,9 °C[2] |
||
| Point d’éclair | 72 °C[2] | ||
| Pression de vapeur saturante | 1 mmHg (32 °C)[2] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction | [2] | ||
| Précautions | |||
| SGH[2] | |||
 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Préparation
Le chlorure de benzoyle est produit du trichlorotoluène (phénylchloroforme) en utilisant soit de l'eau, soit de l'acide benzoïque[6]:
- C6H5CCl3 + H2O → C6H5COCl + 2 HCl
- C6H5CCl3 + C6H5CO2H → 2 C6H5COCl + HCl
Comme d'autres chlorures d'acide, il peut être généré par réaction entre son acide parent et un agent de chloration comme le pentachlorure de phosphore (PCl5) ou le chlorure de thionyle (SOCl2)[7].
Réactions
Le chlorure de benzoyle est un chlorure d'acyle typique. Il réagit avec les alcools et les amines pour donner respectivement les esters et amides correspondants. Il subit les acylations de Friedel-Crafts avec des arènes pour donner les benzophénones correspondantes. Similairement, il réagit avec l'eau pour former de l'acide chlorhydrique et l'acide benzoïque:
- C6H5COCl + H2O → C6H5CO2H + HCl
Le chlorure de benzoyle réagit avec le peroxyde de sodium pour former du peroxyde de benzoyle et du chlorure de sodium:
- 2 C6H5COCl + Na2O2 → (C6H5CO)2O2 + 2 NaCl
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Benzoyl chloride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Benzoyl chloride, ACS reagent, ≥99.5% (T), consultée le 13/05/2017. + (pdf) Fiche MSDS et (en) « Benzoyl chloride », sur NIST/WebBook
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- fiche MSDS
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic compounds C5 to C7, vol. 2, Huston, Texas, Gulf Pub. Co., , 400 p. (ISBN 0-88415-858-6)
- Takao Maki, Kazuo Takeda “Benzoic Acid and Derivatives” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI 10.1002/14356007.a03_555
- (en) Friedrich Wöhler, Justus von Liebig, « Untersuchungen über das Radikal der Benzoesäure », Annalen der Pharmacie, vol. 3, , p. 249-282 (DOI 10.1002/jlac.18320030302)




