Benzophénone
La benzophénone est une cétone bicyclique de formule brute C13H10O. Ce composé est utilisé dans les encres et les vernis UV d'imprimerie, comme intermédiaire pour la synthèse de composés pharmaceutiques et agrochimiques et dans l'industrie des parfums[8]. Il est mutagène, perturbateur endocrinien et classé "peut-être cancérogène pour l'homme (Groupe 2B)", par le Centre international de Recherche sur le Cancer (CIRC/Iarc) de l'OMS selon qui il existe des preuves suffisantes chez les animaux de laboratoire du risque de cancers dus à la benzophénone, et peut se former naturellement par vieillissement/oxydation d'autres composés utilisés dans des crèmes solaires et/ou crèmes de beauté.
| Benzophénone | ||
| ||
 | ||
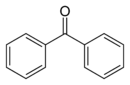
| Structure 2D de la benzophénone | ||
| Identification | ||
|---|---|---|
| Nom UICPA | diphénylméthanone | |
| Synonymes |
diphénylcétone |
|
| No CAS | ||
| No ECHA | 100.003.943 | |
| No CE | 204-337-6 | |
| DrugBank | DB01878 | |
| PubChem | 3102 | |
| FEMA | 2134 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs dont l'odeur rappelle la rose[1]. | |
| Propriétés chimiques | ||
| Formule | C13H10O [Isomères] |
|
| Masse molaire[2] | 182,217 9 ± 0,011 4 g/mol C 85,69 %, H 5,53 %, O 8,78 %, |
|
| Diamètre moléculaire | 0,709 nm[3] | |
| Propriétés physiques | ||
| T° fusion | 49 °C[4] | |
| T° ébullition | 305 °C[4] | |
| Solubilité | 137 mg/l (eau, 25 °C)[5] | |
| Paramètre de solubilité δ | 23,0 J1/2 cm−3/2 (45 °C)[3] | |
| Masse volumique | 1,146 g/cm3 à 20 °C[4] | |
| T° d'auto-inflammation | 560 °C[4] | |
| Point d’éclair | 150 °C[4] | |
| Thermochimie | ||
| ΔfH0gaz | 49,9 J K−1 mol−1 [6] | |
| ΔfH0solide | −34 kJ/mol[6] | |
| ΔfusH° | 18,194 kJ/mol à 47,88 °C[6] | |
| ΔvapH° | 94,977 kJ/mol[6] | |
| Cp | 224,8 J K−1 mol−1 à 26,85 °C[6] | |
| PCI | −6 508 kJ/mol [6] | |
| Précautions | ||
| SGH | ||
 Attention |
||
| SIMDUT[7] | ||
Produit non contrôlé |
||
| Directive 67/548/EEC | ||
 Xi  N |
||
| Transport | ||
| Écotoxicologie | ||
| DL50 | 10 g·kg-1 (rat, oral) 2,895 g·kg-1 (souris, oral) [5] |
|
| LogP | 3,38[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Utilisation
Ce composé est utilisé comme photo-amorceur UV pour la polymérisation des encres[8].
En chimie, elle sert à assécher, désoxygéner en association avec le sodium des solvants aprotiques avant distillation pour synthèse. Elle forme avec le sodium, un radical (C6H5)2C∙-O− qui réagit avec l'eau et l'oxygène et aussi avec les peroxydes d'éther en les éliminant. Ce radical est d'une couleur violet foncé qui quand elle est observée, garantit que tous les peroxydes, eau et O2 ont été éliminés.
Ce composé est également utilisé comme additif dans les cigarettes .
Production et synthèse
La principale voie de synthèse est l'oxydation en présence d'air du diphénylméthane à l'aide de catalyseur métallique tel le naphténate de cuivre. D'autres voies utilisent le benzène et le chlorure de benzoyle via une acylation de Friedel-Crafts ou encore le benzène et le phosgène[8].
Il peut aussi, selon une étude récente (2021) publiée dans la revue de la Société américaine de chimie, Chemical Research in Toxicology se former spontanément, et alors de manière indésirable, par vieillissement/oxydation de l'octocrylène, un composé courant de crèmes solaires de shampoing et de crèmes de beauté anti-âge[9].
Dangers pour la santé
Le benzophénone est un produit mutagène, cancérigène (cancers du foie et lymphomes dans le modèle animal), source de problèmes dermatologiques[9] et perturbateur endocrinien.
Il est interdit dans la nourriture aux États-Unis[10].
L'octocrylène, sa molécule mère est en outre accusé (à partir des crèmes solaires) de contribuer à la mortalité des coraux et d'être néfaste pour la vie marine, ce pourquoi "Certains fabricants l'ont retiré de leurs crèmes solaires pour des raisons environnementales" et ce pourquoi certaines juridictions marines ont interdit son utilisation sur leur territoire note Philippe Lebaron du Laboratoire de biodiversité et biotechnologie microbienne de l'Observatoire de Banyuls-sur-Mer (Sorbonne Université/CNRS, France)[9].
Notes et références
- BENZOPHENONE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- Entrée « Benzophenone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 février 2009 (JavaScript nécessaire)
- (en) « Benzophénone », sur ChemIDplus, consulté le 23 février 2009
- « Benzophenone », sur http://www.nist.gov/ (consulté le )
- « Benzophénone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Hardo Siegel et Manfred Eggersdorfer, Ullmann's Encyclopedia of Industrial Chemistry, Ketones, Wiley-VCH Verlag GmbH & Co,
- « Consommation. Crèmes solaires et anti-âge : une étude alerte sur la présence d'un composé fréquemment cancérigène », Le Dauphiné libéré, (lire en ligne, consulté le )
- C. A. Downs, Joseph C. DiNardo, Didier Stien et Alice M. S. Rodrigues, « Benzophenone Accumulates over Time from the Degradation of Octocrylene in Commercial Sunscreen Products », Chemical Research in Toxicology, (ISSN 0893-228X, DOI 10.1021/acs.chemrestox.0c00461, lire en ligne, consulté le )