Peroxyde de sodium
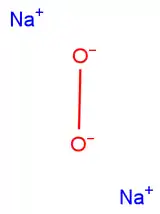
Le peroxyde de sodium, ou commercialement appelé oxylithe[6], est un composé de formule brute Na2O2.
| Peroxyde de sodium | |||
| |||
 | |||
 |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Peroxyde de sodium | ||
| Synonymes |
Peroxyde de disodium ; Dioxyde de sodium |
||
| No CAS | |||
| No ECHA | 100.013.828 | ||
| No CE | 215-209-4 | ||
| PubChem | 14803 | ||
| SMILES | |||
| InChI | |||
| Apparence | Poudre blanche à jaune | ||
| Propriétés chimiques | |||
| Formule | Na2O2 [Isomères] |
||
| Masse molaire[1] | 77,978 3 ± 0,000 6 g/mol Na 58,96 %, O 41,04 %, |
||
| Propriétés physiques | |||
| T° fusion | 460 °C[2] | ||
| T° ébullition | 657 °C[2] | ||
| Masse volumique | 2,8 g cm−3 à 20 °C[3] | ||
| Point d’éclair | non inflammable | ||
| Thermochimie | |||
| S0solide | 94,78 J K−1 mol−1[4] | ||
| ΔfH0solide | −513,21 kJ mol−1[4] | ||
| Précautions | |||
| SGH[5] | |||
  Danger |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Ce composé fut décrit en 1811 par les chimistes français Joseph Louis Gay-Lussac et Louis Jacques Thénard, qui étudiaient les propriétés physico-chimiques du sodium et du potassium, éléments isolés quelques années auparavant par le chimiste britannique Sir Humphry Davy. Pour obtenir du peroxyde de sodium, qu'ils qualifiaient "d'oxyde au maximum du sodium", Gay-Lussac et Thénard firent chauffer vivement du sodium sous une cloche de verre, dans une atmosphère riche en dioxygène (O2)[7].
Il est utilisé au début du XXe siècle par le chimiste George-François Jaubert pour produire de l'oxygène[8] - [9]. C'est un solide friable de couleur jaune, qui se dissout au contact de l'eau en libérant de l'oxygène[10] - [11]. La réaction, très violente, est fortement exothermique. Du fait de cette réactivité, l'oxylithe doit être absolument conservé à l'abri de l'humidité. Stocké sans précautions particulières, il finit par se désagréger au contact de la vapeur d'eau présente dans l'air ambiant. Ce produit ne doit pas non plus entrer au contact de la peau (en particulier, on ne doit le manipuler qu'avec une pince), car ses effets déshydratants provoquent des brûlures sérieuses.
L'oxylithe a été utilisé dans les premiers masques à gaz[12], qui équipaient les mines de charbon puis plus tard l'infanterie française pendant la Première Guerre mondiale. Il était encore utilisé dans les cours de chimie de l'enseignement secondaire dans les années 1980.
Préparation
La préparation du peroxyde de sodium se fait idéalement en deux étapes, selon Georg Brauer (en). La première consiste en l'oxydation de sodium Na en oxyde de sodium (Na2O). Pour ce faire, le sodium doit être placé dans un environnement contenant moins de dioxygène que l'air ambiant. La deuxième étape consiste en l'oxydation du Na2O en Na2O2, en plaçant l'oxyde de sodium dans une atmosphère riche en oxygène et en le chauffant entre 200 et 350 °C[13].
- 2 Na + 1⁄2 O2 → Na2O
- Na2O + 1⁄2 O2 → Na2O2
Au total, 2 Na + O2 → Na2O2
Propriétés
La température d'ébullition de ce composé est de 657 °C. À cette température, le peroxyde de sodium se décompose en oxyde de sodium (Na2O), en libérant du dioxygène[2].
- Na2O2 → Na2O + 1⁄2 O2
Sa température de fusion est d'environ 460 °C, mais cela n'entraîne pas sa décomposition[13].
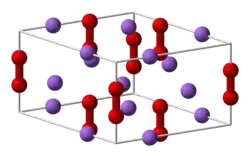
Les cristaux de peroxyde de sodium sont hexagonaux et appartiennent au groupe de Laue 6/mmm[14].
Le peroxyde de sodium peut être utilisé comme agent oxydant[2]. Il est utilisé comme agent de blanchiment[15].
La réaction entre de l'eau et du peroxyde de sodium (Na2O2) permet la formation de soude (NaOH) et de peroxyde d'hydrogène (H2O2)[13].
- Na2O2 + 2 H2O → 2 NaOH + H2O2
À l'instar du peroxyde de lithium (Li2O2) et du peroxyde de potassium (K2O2), le peroxyde de sodium peut être utilisé comme source de dioxygène. La réaction entre du peroxyde de sodium et du dioxyde de carbone (CO2) permet la production de carbonate de sodium (Na2CO3) tout en libérant du dioxygène.
- Na2O2 + CO2 → Na2CO3 + 1⁄2 O2
La réaction entre du peroxyde de sodium, du dioxyde de carbone et de l'eau amènera quant à elle à la formation de bicarbonate de sodium (NaHCO3) et de dioxygène.
- Na2O2 + H2O + 2 CO2 → 2 NaHCO3 + 1⁄2 O2
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Richard J. Lewis Sr, Hawley's Condensed Chemical Dictionary, New York, John Wiley & Sons, , 13e éd. (ISBN 0471292052), p. 1024.
- Clayton, G.D., F.E. Clayton (éds.), Patty's Industrial Hygiene and Toxicology, vol. 2A, 2B, 2C, 2D, 2E, 2F: Toxicology, 4e éd., New York, John Wiley & Sons, 1993-1994, p. 773.
- Chase, M.W., Jr., NIST-JANAF Themochemical Tables, 4e éd., J. Phys. Chem. Ref. Data, Monograph 9, 1998, 1-1951.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008, 16 décembre 2008.
- G.-F. Jaubert, « Le quotient respiratoire et la régénération de l'air en circuit fermé par les peroxydes », Gaz de combat, défense passive, 1re année no 1, .
- Gay-Lussac, Louis Joseph, Recherches physico-chimiques, faites sur la pile ; sur la préparation chimique et les propriétés du potassium et du sodium ; sur la décomposition de l'acide boracique ; sur les acides fluorique, muriatique et muriatique oxigéné ; sur l'action chimique de la lumière ; sur l'analyse végétale et animale, etc. Par MM. Gay-Lussac et Thénard, membres de l'Institut, etc. Avec six planches en taille-douce. Tome Premier[-Second], chez Deterville, Libraire, rue Hautefeuille N° 8. M. DCCC. XI (OCLC 489634164, lire en ligne).
- M. Chaussart, « Pierre d'oxygène », Gazette des hôpitaux de Toulouse, , p. 2 (lire en ligne).
- Anon., « Le boroxylithe », Journal de Monaco, no 2426, , p. 190.
- L. Guillet, L'industrie de la soude, Gauthier Villars, Masson et Cie, , « X. L'industrie du sodium et du peroxyde de sodium », p. 133.
- Anon., « Science notes », Scientific American, , p. 190 (lire en ligne).
- G.-F. Jaubert, « Sur les appareils respiratoires à peroxydes alcalins », Comptes rendus hebdomadaires des séances de l’Académie des sciences, vol. 197, , p. 484.
- (en) Georg Brauer, Handbook of Preparative Inorganic Chemistry 1, New York, Londres, Academic Press, , 1859 p. (ISBN 9780123955906, lire en ligne), p. 980.
- (en) Richard L. Tallman, John L. Margrave et Sturges W. Bailey, « The Crystal Structure of Sodium Peroxide », Journal of the American Chemical Society, vol. 79, no 11, , p. 2979–2980 (ISSN 0002-7863 et 1520-5126, DOI 10.1021/ja01568a087, lire en ligne, consulté le ).
- « Fiche complète pour Peroxyde de sodium », sur reptox.cnesst.gouv.qc.ca (consulté le ).

