Cancer pagurus
Le crabe dormeur ou dormeur ou poupard, poupart, plus connu des gastronomes sous le nom de tourteau et parfois aussi appelé crabe-de-lune ou poing-clos ou clos-poing, ou encore ouvet, a pour nom scientifique Cancer pagurus. Attention, « crabe dormeur » s'utilise aussi pour le Dromia personata.

Ce gros crabe de forme elliptique est un Crustacé décapode, brachyoure, appartenant à la famille des Cancéridés, trouvé sur le plateau continental européen, et peut vivre jusqu'à une vingtaine d'années (voire plus ?), atteignant alors une trentaine de cm.
Son surnom de dormeur viendrait du fait que quand on le retourne ou qu'on le sort de son habitat assez longtemps, il prend une attitude typique, repliant ses pattes et ses pinces sur le dessous de sa carapace, ne bougeant plus comme s'il dormait. Pour respirer il absorbe l’oxygène dissous dans l’eau grâce à des branchies situées à l’intérieur de la carapace. Ce nom peut aussi venir du fait que le jour, il se tient généralement immobile. Au contraire, la nuit il est très actif ; les femelles font des migrations pouvant dépasser 200 km.
L'espèce a localement beaucoup régressé. Elle n'est pas considérée comme en danger, mais nécessite, comme beaucoup d'autres crustacés en forte régression près des côtes (homard, langouste, araignée) une exploitation raisonnée[1].
Description

.jpg.webp)


Il peut être confondu avec Cancer bellianus, tourteau vivant plus en profondeur et avec d'autres espèces du genre Cancer trouvées ailleurs (Cancer magister ou dormeur du Pacifique), plus petit et plus sombre). On le différentie des autres crabes par :
- un feston dentelé bordant la carapace d'une dizaine de petits lobes de part et d'autre des yeux, les lobes sont plus ou moins aigus ou arrondis selon l'âge et les individus,
- des pinces très robustes, des péréiopodes duveteux,
- l'extrémité des pinces,
- les pointes de dactyles (pattes) colorés en noir mat,
- les yeux sont souvent verts d'eau.
Le tourteau est de couleur brun-chamois avec nuances orangées. Sa couleur et sa forme lui confèrent une certaine capacité à se fondre dans un environnement rocheux, capacité proche du mimétisme[2] ; il peut se confondre avec les galets ovales et la carapace des individus plus âgés est souvent garnie d'organismes marins fixés (balane, tubes calcaires d'annélides polychètes) qui accentuent ce phénomène.
De petits hydraires se fixent aussi parfois sous la tête des tourteaux, profitant sans doute des restes de son alimentation mis en suspension dans l'eau.
Comme chez la plupart des espèces, la face ventrale (dessous de la carapace et des pinces) est plus claire (beige tirant vers le jaune ou blanc).
La couleur de la carapace varie selon l'âge (premier stade, immatures, adultes, avec des nuances possibles selon les individus et la proximité temporelle d'une mue). En particulier, certains jeunes tourteaux sont parfois très clairs[3] (dépigmentation pathologique ? ou absence naturelle de pigments ?) sans qu'il s'agisse d'albinisme, car les yeux sont normalement pigmentés[3].
Les jeunes adultes mesurent de 15 à 20 cm, mais des individus plus âgés, de plus en plus rares en raison d'une pêche ancienne et régulière de l'espèce, peuvent atteindre 30 cm [4].
- Les femelles dont la taille peut atteindre 20 cm atteignent la maturité aux environs de 17 cm. Leur abdomen est plus large. Ses somites sont garnis (sauf le 1er et 6e) d'une paire de pléopodes, appendices où se fixeront les œufs.
- Les mâles, plus petits, n'atteignent que 15 cm environ. Leur céphalothorax est beaucoup plus plat que celui des femelles. L'abdomen est plus étroit et possède sur les deux premiers somites des appendices qui sont des organes copulateurs.
Habitat, répartition
On le trouvait presque partout sur la façade atlantique de l'Europe, de la Norvège au sud-Maroc [5] (voire plus au sud), et jusqu'en Mer Égée (Grèce) en Méditerranée[6]. Il est surtout abondant sur le littoral Nord Ouest de l'Europe et tout autour du Royaume-Uni.
Relativement ubiquiste, cette espèce occupe une large niche écologique.
Elle était ou est encore localement trouvée par les pêcheurs à pied sur l'estran à marée basse, où ce crabe se cache alors sous les rochers ou dans leurs anfractuosités (de jeunes individus en général).
Il vit aussi plus loin des côtes sur des fonds rocheux, sableux ou sablo-vaseux, jusqu'à 200 m de profondeur[7], dans toutes les eaux marines fraiches bordant l'Europe, jusqu’à l’Afrique de l'Ouest. Il est présent, mais très rare en Méditerranée[3]. En Bretagne sud, on le pêchait déjà à 200 m dans les années 1980.
Biologie
Bien que cette espèce soit commune dans toute l'Europe, sa biologie est encore pour partie mal connue.
Les données fournies par les crabes débarqués se limitent aux individus de taille commerciale (8 cm en France dans les années 1980[8]) et ne sont précises que dans le cas de pêche localisée au casier. Des élevages expérimentaux de larves et juvéniles ont permis d'étudier leur croissance, et à partir de 50 mm, de jeunes crabes peuvent être marqués et suivis par des techniques de capture-recapture[8]. Des expériences de marquage/captures-recapture ont été faites avec plusieurs milliers d'individus en Bretagne-sud et en Manche dès les années 1980. Les taux de recapture étaient de moins de 10 %.
Ces études permettent de mesurer la croissance des jeunes, mâles et femelles. On a ainsi montré que ce crabe ne grandit pas nécessairement à chaque mue[8], et que la relation taille-poids diffère pour le mâle et la femelle, avec des différences observées selon les zones géographiques étudiées[8].
Elles montrent aussi que les femelles sont assez mobile, les mâles étant, dans les zones étudiées, plus sédentaires. La cartographie des points de capture-recapture ne laisse pas apparaitre des directions privilégiées de migration saisonnières ou annuelles comme c'est le cas avec les langoustes ou d'autres espèces.
Remarque : en milieu confiné (d'élevage en laboratoire ou in situ) le cannibalisme est fréquent au moment de la mue[8].
Alimentation
Contrairement à ce que pourraient laisser penser ses imposantes pinces, ce crabe n'est pas un grand prédateur des fonds marins du plateau continental.
Sa larve se nourrit de plancton en suspension ou de matières organiques en décomposition filtrées dans l'eau.
Le tourteau dormeur adulte est surtout détritivore et plus précisément nécrophage. Ce petit charognard marin joue de ce point de vue un rôle important dans les écosystèmes qu'il fréquente, en éliminant les cadavres et les restes de proies qu'il déchiquète grâce à ses pinces puissantes. Il est d'ailleurs souvent appâté dans les casiers au moyen de cadavres de poissons.
En complément, il capture aussi des proies fixées ou peu capables de fuite, appartenant à des espèces variées (crustacés et invertébrés/mollusques, dont vers marins sédentaires et gastéropodes).
Mues[9]
La mue est un moment délicat pour tous les crustacés. 5 % des crabes captifs meurent durant la mue. C'est aussi, d'après les observations réalisées sur les animaux en captivité, un moment où les crabes peuvent adopter un comportement cannibale, ce qui constitue d'ailleurs un frein à leur élevage. Chez les femelles, la mortalité lors des mues est bien moindre, car les mâles qui vont à ce moment se reproduire avec elles les protègent durant plusieurs jours (d'une vingtaine de jours avant la mue jusqu'à 10 jours après, selon les individus, et d'après les observations faites par Edwards (1971) sur 36 couples maintenus en captivité ; en moyenne cette durée de protection de la femelle par le mâle est de 8 jours en pré-mue et 5 jours en post-mue). Les mâles fécondants effectuent toujours leurs mues à un autre moment, ce qui leur permet de toujours protéger les femelles en mues.
La mue du crabe-dormeur se fait toujours sous l'eau, de nuit et loin de l'estran. Elle serait selon Aiken [1969] déclenchée par le système hormonal, activé par deux types de stimuli : température de l'eau et photopériode.
D'après les observations faites sur des animaux captifs, la mue dure de 30 minutes à 6 heures, durant lesquelles le crabe s'extrait de son ancien exosquelette ; c'est l'exuviation ; le bouclier dorsal se fend le long de lignes dites lignes exuviales. Il s'ouvre alors sous la pression du corps qui gonfle (voir pourquoi ci-dessous). L'abdomen puis les huit péréiopodes en sortent et ces derniers poussent ensuite en avant l'exuvie pour en extraire le reste du corps en finissant par les pinces.
Dès le début de la mue et durant environ 24 h, l'animal gonfle en absorbant de l'eau (60 % du poids total du corps à ce moment). Dans les mois qui vont suivre (dits période d'« intermue »), cette eau sera peu à peu remplacée par les organes et la chair en croissance. Les crabes devenus mous sont vulnérables à leurs prédateurs durant 7 à 8 jours, mais il faudra deux ou trois mois pour que la chitine ait parfaitement consolidé la carapace. Le crabe en train de muer est vulnérable à ses prédateurs naturels, mais moins à l'homme, car cessant de s'alimenter pour quelques semaines, il n'est pas attiré par les appâts des casiers de pêche.
Les mues peuvent survenir toute l'année, mais sont nettement plus fréquentes au printemps et en été.
Une étude[8] (en 1979) a montré en Bretagne-Sud 3 pics importants de mue ; en mai, juillet et octobre, mais ces pics étaient moins nets et décalés dans le temps l'année suivante (1980). Ces pics présentent une certaine corrélation avec les variations mensuelles de la température de l'eau ; les mues sont rares en dessous de 8 °C et plus fréquentes au-dessus de 10 °C.
Croissance
Avant maturité sexuelle, l'accroissement de taille et poids à la mue sont comparables pour mâles et femelles, puis il diminuent à chaque mue, plus fortement chez les femelles. Des observations faites en Manche laissent penser que les mâles après avoir atteint une taille de 10 cm, muent 3 fois plus souvent que les femelles.
La croissance est moins rapide dans les eaux froides ; le jeune crabe atteint 80 mm de longueur (350 g) à 3 à 4 ans en Bretagne-Sud/Golfe de Gascogne, alors qu'il lui faut presque le double (5 à 6 ans) en Mer du nord. Des données anglaises, intermédiaires donnent un poids moyen de 450 g vers 5 ans, 1 kg vers 7 ans et 1,5 kg vers 15 ans[8]. On connait mal les cycles de mues à grande profondeur (vers 200 m).
Reproduction
Elle a commencé à être étudiée il y a plus d'un siècle à l'Est de la Grande- Bretagne (Écosse, Northumberland) par Williamson (1904), Pearson (1908), L. Ebour (1927-1928) et plus tard par[10], Edwards et Meaney (1968) dans les eaux du Norfolk du Yorkhshire et du sud-Irlande.
Le tourteau est une espèce gonochorique, c'est-à-dire à reproduction sexuelle obligatoire. Les glandes génitales mâle et femelles sont abritées dans le céphalothorax à la surface de l'hépatopancréas.
Les femelles semblent adultes quand leur carapace atteint 73 mm.
Les dates de fécondation et fécondité varient selon la température et le milieu. En Bretagne sud, un début de développement ovarien apparait en juillet. Il se poursuit jusqu'en mars de l'année suivante où de mars à juin la femelle est sexuellement non active. Le mâle semble sexuellement mature plus tôt, dès 65 mm[8].
- Accouplement : la femelle ovigène ne se nourrit pas. Le mâle, attiré par une femelle mature et prête à muer se tient sur elle, jusqu'à ce qu'elle mue. Après la mue, elle devient réceptive. C'est alors que la copulation se produit, souvent de nuit et pouvant durer plusieurs heures.
- Le sperme est stocké par la femelle dans une spermathèque où il est conservé vivant plusieurs mois, alors que des bouchons spermatiques apparaissent sur les orifices génitaux de la femelle (sous la languette abdominale). Elle n'est donc plus fécondable avant la mue qui suivra la ponte qui ne se produira que plusieurs mois après, jusqu'à un an plus tard ; ceci explique que les jeunes femelles semblent pouvoir être fécondées avant leur maturité ovarienne[8]. En captivité, plusieurs pontes successives ont été observées après une seule fécondation, mais l'auteur ne précisait pas si les œufs étaient fertilisés.
Williamson (1940) a supposé que le sperme contenu dans la spermathèque pouvait inhiber le déclenchement de la et donc la croissance de femelles. On a longtemps pensé que les bouchons empêchaient la fécondation par plusieurs mâles, mais des études génétiques de larves, montrent qu'au moins parfois, plusieurs mâles ont pu féconder une même femelle. Il pourrait aussi s'agir du sperme ancien d'un cycle de reproduction antérieur, conservé encore vivant dans la spermathèque, qui se serait mélangé avec celui du dernier mâle[6].
- Le frai (la ponte) survient en hiver, de novembre à février-mars en Bretagne-Sud. À l'émission des œufs (collants), la femelle les récupère en les fixant sur les soies qui garnissent les pléopodes de ses pattes natatoires.
- La femelle est ensuite dite « ovigères » (qui signifie « porteuse d'œuf ») ou « grainée ». À ce stade, elle ne se nourrit pas, et se cache probablement soigneusement, car elle est rarement pêchée ou observée. Elle porte jusqu'à 20 millions d'œufs fécondés. Le nombre d'œufs varie fortement selon l'âge et la taille de la femelle ; par exemple en Bretagne sud, les femelles de 75 mm ne portaient que 257 000 œufs, alors qu'elles en portaient 433 000 à 85 mm puis 683 000 œufs à 85 mm, puis en moyenne 1 046 000 à 105 mm. Plus tard, elles pourront produire plus de 2 millions d'œufs.
- L'éclosion se produit au printemps, dès avril avec un maximum vers mai, et moindrement jusqu'en septembre-octobre en Bretagne-Sud[8]. Cette période semble plus courte sur les côtes du Yorkshire et du sud-ouest de l'Irlande Edwards (1979) (mai à septembre),
- Au stade suivant, les œufs ont éclos (« dégrainage ») et ces femelles qui portent encore quelques capsules vides collées sur les soies des pléopodes des pattes natatoires semblent alors s'activer pour se nourrir. C'est le moment où elles sont capturées en grand nombre[8].
- Après la naissance, les larves sont planctoniques jusqu'au 30e jour. Ce sont d'abord des larves zoé typiques, puis des mégalopes à grands yeux. La très grande majorité des larves meurent à ce stade, mangées par un grand nombre de "prédateurs".
Migrations et génétique
En 1914, on s'intéresse déjà aux migrations des crabes[11]. De nombreux indices laissaient penser que comme d'autres espèces de grands crustacés, les dormeurs pouvaient effectuer d'importantes migrations (dépassant 260 km pour de femelles observées en Atlantique nord). Le premier de ces indices était que les dormeurs les plus gros sont toujours trouvés au large, et que ceux qui sont pêchés près du trait de côte sont plus petits. Il semblait donc que les individus migraient au fur et à mesure de leur vie vers le large et les zones plus profondes. Les études ont montré que dans la plupart des cas, la migration se fait effectivement dans des directions privilégiées (à partir des points de lâcher) Edwards (1965, 1967, voir bibliographie en bas de page), Hallback en Suède (1969)[12], Benett & Brown dans le Channel (de 1968 à 1976)[13] - [14]. Il existe cependant des exceptions (a priori dans des zones de golfes à faible courant et courants giratoires[8]). Ailleurs, les déplacements se font nettement dans le sens opposé à la dérive résiduelle des courants marins. Une explication plausible étant que la femelle doit « compenser, en l'anticipant, la dérive que subissent les larves au cours de leur vie pélagique »[8].
Ces migrations, ainsi qu'une bonne dispersion des larves probablement[15], jouent indirectement un rôle important pour le brassage génétique et la large répartition biogéographique de l'espèce[8]. Le brassage génétique se fait même si bien qu'en mer Baltique on a trouvé une très forte homogénéité de l'espèce, dans la zone Kattegat-Skagerrak en Baltique, pour les marqueurs microsatellites utilisés[15].
Des premières expériences de marquage de l'exosquelette ou de pinces (claw-tag) de crabes vivants et ensuite relâchés ont été faites il y a plus d'un siècle, dans les eaux écossaises avant 1900[16] puis à l'Est de l'Angleterre par Meek (1914)[17], Tosk (1906), Donnison (1912)[8].
D'autres expériences de suivi ont été réalisées à la fin des années 1930 et des années 1950 par Williamson (1940)[18] et Mistakidis (1960)[19]. Chaque marque était perdue avec la mue, et les données restaient donc très partielles[8]. On a pu mieux suivre les déplacements pluriannuels grâce à de nouvelles techniques de marquage : « toggle-tag » et « suture-tag »[20] qui ne sont pas perdues par le crabe lors des mues[8].
En Bretagne sud, on a constaté que, comme ailleurs, les femelles sont beaucoup plus nombreuses à être capturées par les pêcheurs que les mâles ; probablement parce qu'elles se déplacent et s'exposent beaucoup plus : 39 % des dormeurs recapturés s'étaient déplacés à plus de 5 milles, parmi ce lot, 91 % étaient des femelles. 87 % des mâles recapturés avaient effectué moins de 5 milles (soit 43 % de la population recapturée sur le site de marquage)[8].
Statut de l'espèce et des populations (état, pressions, menaces)


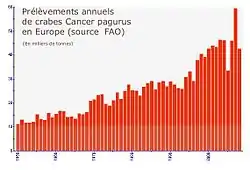
Même si elle a localement pu régresser depuis plusieurs décennies de pêche artisanale puis industrielle ou semi-industrielle, l'espèce n'est pas considérée comme menacée pour le moment.
Certains pêcheurs notent cependant que le produit de la pêche au large des côtes françaises, anglaises et irlandaises, est moins abondant que par le passé.
Il est possible que cette espèce, soit sensible et localement vulnérable à des perturbateurs endocriniens, et à certains polluants émis dans les ports ou apportés par les cours d'eau et estuaires. C'est une espèce lucifuge, qui pourrait donc être éventuellement repoussée par certains éclairages artificiels portuaires, source de pollution lumineuse, mais cette question n'a pas fait l'objet d'études particulières.
La pêche au chalut de fond est susceptible d'endommager les fonds et les écosystèmes sur de vastes espaces. En tant que charognard, il peut en profiter dans un premier temps, mais pourrait ensuite régresser avec la dégradation générale des réseaux trophiques.
Les individus affaiblis ou plus exposés peuvent être parasités, notamment par la sacculine (Sacculina triangularis), un petit crustacé cirripède.
Pêche et filière agro-alimentaire
À la suite de la régression d'autres espèces, le Dormeur est devenu (en termes de tonnage) l'un des crustacés les plus recherchés et pêchés en Europe.
- Il est pêché par des caseyeurs, au moyen de casiers appâtés (l'appât est appelé boette en Bretagne) et disposés en filières (en zone rocheuse ou à leurs abords). Le nombre de casiers par filière (10 à 40) varie selon les capacités du navire et de la stratégie de pêche retenue. Dès les années 1970, les plus gros caseyeurs pouvaient en Bretagne sud mouiller un total de 350 à 600 casiers, par filière de 40 à 60. Initialement artisanalement fait de bois et filet ils sont maintenant en plastique et nylon. À titre d'exemple, rien qu'en Bretagne-sud, les 6 Quartiers abritaient en 1980 : 373 caseyeurs, dont 335 de moins de 8 tonneaux, un seul faisant plus de 30 tonneaux. Ces navires disposaient de 10 650 casiers pour la flotte du Guilvinec, 13 000 pour Concarneau, 8 500 pour Lorient, 14 540 pour Auray, 7 500 pour Vannes et 5 000 à Saint-Nazaire, ce qui leur a permis de pêcher 3 B95 tonnes de dormeurs cette même année 1980[21].
En Bretagne nord, la flotte était surtout concentrée dans les « quartiers » de Paimpol, Brest et Morlaix avec respectivement 174, 160 et 128 caseyeurs[22]. - Le dormeur est aussi pêché par des chalutiers au moyen d'engins trainés (chalut de fond), qui endommagent les fonds.
- C'est aussi une prise accessoire des filets à soles ou d'autres engins (seules les pinces sont alors vendues).
Il peut être conservé un certain temps en vivier comme à Camaret-sur-mer. Cette pêche est surtout pratiquée en été et automne, d'avril à octobre en Bretagne-Sud[8].
Malgré une réglementation précisant une taille marchande minimale (donnée en largeur de carapace en France) une pêche annuelle quantitativement croissante jusque dans les années 1980 (milliers de tonnes de dormeurs capturés rien qu'en métropole), sauf certaines années en été lors des pics de production, la demande restait supérieure à l'offre (le marché Français importait à lui seul environ 6 000 t de chair de crabe en 1986 selon la FAO[23]). La règlementation française reprend une taille marchande proposée par les professionnels[24].
Depuis les années 1970, la pêche ciblée de cette espèce s'est substituée à celle du homard et des langoustes et des araignées de mer (Maia squinada), largement surexploités[6]. Elle constitue un revenu important pour la pêche artisanale, particulièrement en France pour certains ports de Manche et d'Atlantique[6].
Au début des années 1980, la Manche était la première zone de production, au bénéfice de flottilles bretonnes et anglaises assurant respectivement plus de 40 % du total européen des pêches devant la Norvège (10 %).
Le nombre d'individus prélevés est considérable. Selon la Marine Marchande, environ 10 000 tonnes de dormeurs avaient été débarquées et déclarées en 1980 [6]. Deux ans après, 8 700 tonnes auraient été pêchées, d'une valeur de 85 millions de francs, soit environ 40 % du total européen. Presque vingt ans après (en 1999), le total des captures déclarées dans le monde selon la FAO s'élevait à 41 337 t (19 988 t pour le Royaume-Uni et 8 498 t pour la France, soit une diminution de tonnage pêché pour la France malgré des moyens techniques améliorés)[23].
Bien que cette pêche soit récente (hors pêche à pied), des chutes de rendement sont observées depuis 20 à 30 ans dans certaines zones d'Europe. Cette régression de l'espèce a causé des reconversions ou au contraire une intensification de la pêche (plus profonde, plus instrumentalisée, et avec éloignement toujours plus au large des zones de pêche)[6].
On cherche à mieux comprendre la croissance (modèle de von Bertalanffy...) et la biologie de l'espèce (ex : étude des parasitoses, des zones de reproduction et corridors et vitesses de déplacements par marquage-recapture[6].
Pour preuve de sa fraicheur, cet animal est généralement vendu vivant. Or ses pinces sont - comme celles du homard - très puissantes, suffisamment pour presque sectionner un doigt humain. Le tendon du muscle qui les ferme est donc généralement sectionné sur le bateau par le pêcheur lui-même, au niveau de l'articulation au moyen d'un outil tranchant. D'un point de vue bioéthique, c'est sans doute une source supplémentaire de souffrance pour l'animal, sans que l'on sache si elle est moindre que la pose de l'élastique sur les pinces du homard.
Règlementation
Au Royaume-Uni
Dans ce pays qui a toujours été le premier producteur de crabes-tourteaux, des objectifs de gestion de la ressource et de contrôle de l'effort de pêche se traduisent dans les textes réglementaires en 1870. Les tailles marchandes minimales sont édictées, publiées par la revue "Fishing Prospects 1979-1980, Lowestoft".
- Depuis 1976, cette taille est de 115 mm de largeur (soit environ 70 mm de longueur) pour le Devon, de 127 mm (à peu près 76 mm] dans le Dorset, le Hampshire et en Cornouailles.
- Dans les années 1980, des travaux scientifiques proposaient de l'augmenter à 140 mm pour les femelles et 160 mm pour les mâles.
En France
Pour les pêcheurs, à partir des années 1960 apparaît une première auto-réglementation, faite par un organisme professionnel : le Comité Interprofessionnel des Crustacés et Coquillages de Pêche, et plus précisément par sa Section I : "Langouste rouge, homard, crabe et araignée", sans base scientifique ni évaluation des populations et sans tenir compte des inégalités régionales ou de la pression de pêche, mais avec l'objectif d'intuitivement déterminer la taille minimale idéale pour protéger les jeunes et les reproducteurs, sans brimer l'effort de pêche. La marine marchande édictait également des règles (publiées via des arrêtés) pour les pêcheurs amateurs.
- 19 octobre 1964 : la taille marchande minimale (en deçà de laquelle tout animal pêché doit immédiatement être rejeté à l'eau) est fixée à 70 mm.
- 1er août 1978 : à la suite de méventes, le CRUSCO [décision no 3] fait passer cette taille à 100 mm.
- le 6 octobre 1978, par décision no 40 du CRUSCO, pour permettre la survie d'une pêche par canots côtiers en Bretagne-Sud, la taille passe marchande min. passe à 80 mm de largeur.
- À ce jour, la taille minimale de pêche (et donc de vente) est de 14 cm, taille mesurée à la plus grande largeur de la carapace.
Il est interdit pour tout grand crustacé de capturer et vendre des femelles grainées (portant leurs œufs). Il est interdit de commercialiser des crabes clairs ou blancs (venant de muer). La pêche du tourteau est interdite sur les cantonnements à crustacés créés pour tenter de protéger des noyaux de population de homards. Anne Le Foll dans sa thèse (p. 32/189) note que faute de contrôles, cette réglementation, au moment de son travail n'était pas respectée.
Valeur nutritive et risques sanitaires
C'est un crabe très recherché pour son goût et ses qualités gustatives, mais en tant que nécrophage, comme d'autres espèces de crabes, il peut localement être contaminé par certains polluants (en aval des ports industriels, de certaines épaves ou d'estuaires notamment).
Les crabes peuvent être vendus vivants, congelés, bouillis ou en boîte. Ils ont une chair délicate.
Les crabes sont une source de vitamine B12 et de zinc et contiennent énormément de vitamine E.
Constituants principaux en g/100 g :
Voir aussi
Galerie de photos
 Tourteau (dessus)
Tourteau (dessus) Tourteau (dessous)
Tourteau (dessous) Tourteau (de face)
Tourteau (de face) Produit de la pêche, ici en vente directe sur le quai
Produit de la pêche, ici en vente directe sur le quai Anomalie de configuration de pince
Anomalie de configuration de pince
Bibliographie
- Butler (T.H.), 1957. — The tagging of commercial crab in the Queen Charlotte Islands région. — Prog. Rep. Pacific Coast St., no 109 : 16-19.
- Linnaeus, 1758 : Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, ed. 10, vol. 1 (texte original).
- Fischer, W.; G. Bianchi; W. B. Scott (eds.).- 1981. Fiches FAO d'identification des espèces pour les besoins de la pêche. Atlantique centre-est; zones de pêche 34, 47 (en partie).Canada Fonds de Dépôt. Ottawa, Ministère des Pêcheries et Océans Canada, en accord avec l'Organisation des Nations unies pour l'Alimentation et l'Agriculture, Vol. 1-7: pag. var.
- Le Foll, Anne, 1982. ; La pêcherie du tourteau Cancer pagurus sur les côtes de Bretagne-Sud : déplacements, croissance, reproduction (South Brittany edible crab (Cancer pagurus) fishery : movements, growth, reproduction)] ; Thèse 3e cycle en Océanologie biologique, Univ. Bretagne occidentale, 206 p.
- Le Foll, Anne ; Contribution à l'étude de la biologie du crabe-tourteau cancer pagurus sur les côtes de Bretagne sud ; synthèse de 2 ans d'étude (mai 1980 - septembre 1982) faites dans la zone de pêche de Lorient, avec prélèvements tous les 15 jours entre 20 et 40 m de fond, sur sable et fond rocheux.
- Lebour (M.V.), 1927. ; Life history of the edible crab. ; The fishing News, 20 August 1927.
- Lloris, D. & J. Rucabado ; 1998. Guide FAO d'Identification des espèces pour les besoins de la pêche.
- Anette Ungfors, Niall J. McKeown, Paul W. Shaw et Carl André, Lack of spatial genetic variation in the edible crab (Cancer pagurus) in the Kattegat–Skagerrak area Oxford Journals Life Sciences ; ICES Journal of Marine Science ; Volume 66, Issue 3 ; p. 462–469.
Liens externes
- (en) Référence Animal Diversity Web : Cancer pagurus (consulté le )
- (en) Référence Catalogue of Life : Cancer pagurus Linnaeus, 1758 (consulté le )
- (fr+en) Référence ITIS : Cancer pagurus (consulté le )
- (en) Référence NCBI : Cancer pagurus (taxons inclus) (consulté le )
- (fr) Référence SeaLifeBase : (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- (en) Référence World Register of Marine Species : espèce Cancer pagurus Linnaeus, 1758 (consulté le )
- (en) Référence BioLib : Cancer pagurus (consulté le )
- (fr) Référence INPN : Cancer pagurus Linnaeus, 1758 (TAXREF) (consulté le )
- (fr) Référence DORIS : espèce Cancer pagurus (consulté le )
- (fr) Tourteau sur guidedesespeces.org/fr
Notes et références
- CORPECUM, 1982. — Étude préalable à la gestion des stocks de crustacés en Bretagne. — Comité régional des pêches et cultures marines, Brest, 2 vol., 4 annexes
- Photo d'un dormeur dont la carapace évoque un galet (DORIS)
- Page Cancer pagurus, DORIS
- Fiche Cancer pagurus du Centre Maréis de découverte de la pêche en mer
- Guide d'Identification des Ressources Marines Vivantes du Maroc. Rome, FAO 263 pp. Zariquiey, R.- 1968. Crustáceos decápodos Ibéricos.Inv. Pesq. 32. 510 pp.
- Thèse de Anne Le Foll en Océanologie biologique : La pêcherie du tourteau Cancer pagurus sur les côtes de Bretagne Sud : déplacements, croissance, reproduction (South Brittany edible crab (Cancer pagurus) fishery : movements, growth, reproduction) ; Université de Bretagne occidentale, avec l'Institut Scientifique et Technique des Pêches Maritimes ; 1982; (sur le site d'Ifremer)
- Les Camarétois le pèchent entre les bancs de la Chapelle à Rochebonne le long de l'isobathe 150 m, note A. LeFoll (voir biblio)
- Contribution à l'étude de la biologie du crabe-tourteau Cancer pagurus sur les côtes de Bretagne sud, Anne Le Foll, Ifremer
- DRACH (P.), 1939. ; Mue et cycle d'intermue chez les crustacés décapodes ; Ann. Inst. Oceanogr., 19 (3) : 103-391
- Edwards (E.), 1966. — Mating behaviour in the European edible crab (Cancer pagurus L.). — Crustaceana, 10, Pt. I, 23-30
- MEEK (A.), 1914. ; Migrations of the crab ; Rep. Northumb. Sea. Fish., coram., Ill, 73 p.
- Hallback (H.), 1969. ; Swedish crab investigations. Some preliminary results. ;CIEM, K/27
- Benett (D.B.) & Brown (C.G.), 1976. ; Crab migration in the English channel 1968-1975. ; Food Fish. lab., Lowestoft U.K., Fish notice n° 44.
- Camus (P.), 1982. — Marquage d'une population côtière de tourteaux (Cancer pagurus L.) en baie d'Audierne (Bretagne-Sud). Premiers résultats. — CIEM, K/18.
- Anette Ungfors, Niall J. McKeown, Paul W. Shaw et Carl André, Lack of spatial genetic variation in the edible crab (Cancer pagurus) in the Kattegat–Skagerrak area Oxford Journals Life Sciences ; ICES Journal of Marine Science ; Volume 66, Issue 3 ; Pp. 462-469 ; doi: 10.1093/icesjms/fsn223 First published online: January 18, 2009
- Williamson (H.C.), 1900. , Contributions to the life-history of the edible crab (Cancer pagurus, Linn). — Rep Fish. Bd. Scotland 18 (3) : 77-143
- Meek (A.), 1914. ; Migrations of the crab. ; Rep. Northumb. Sea. Fish., coram., I l l, 73 p.
- Williamson ; 1940. — The crab fishery. — Aberdeen Journals Ltd, 1-64
- Mistakidis (M.N.), 1960 ; Movements of the edible crab (Cancer pagurus) in English waters. — CIEM, n° 88
- Edwards (E.), 1964. — The use of the suture tag for the determination of growth increments and migrations of the edible crab (Cancer pagurus). - CIEM, K/42.
— 1965. — Observations on growth of the edible crab (Cancer pagurus). Cons. Int. Explor. Mer, Rapp. P. V., 156 : 62-70.
— 1966. — Mating behaviour in the European edible crab (Cancer pagurus L.). — Crustaceana, 10, Pt. I, 23-30
— 1967. — The Yorshire crab stocks. — Lab. leaf!. Fish. Lab. Burnham - on - Crouch (New Ser.), n° 17, 34 p
— 1979. — The edible crab and its fishery in British waters. — Fishing news books Ltd. Farnham, Surrey, U.K., 1-135. - Source : Affaires maritimes, citées par A Le Foll dans sa thèse* (page 20) ; * voir bibliographie
- Composition de la flottille en Bretagne sud (source : statistiques du CORPECUM, 1980 Rem : le CORPECUM ne donne pas les mêmes chiffres que les affaires maritimes pour les tonnages pêchés). 1980
- voir paragraphe 2.1
- (ex : décision interprofessionnelle n° 40 du CRUSCO (Comité interprofessionnel des Crustacés et Coquillages de Pêche) fixant 80 mm comme taille commerciale, bien que cette taille soit acquise près de 2 fois plus lentement par l'espèce en Mer du Nord, par rapport à la Bretagne-Sud, notait A. Le Foll dès 1984