Barrière muqueuse intestinale
La barrière muqueuse intestinale, également appelée barrière intestinale, fait référence à la propriété de la muqueuse intestinale qui assure un confinement adéquat du contenu luminal indésirable dans l'intestin tout en préservant la capacité d'absorber les nutriments. La séparation entre le corps et les intestins empêche la translocation incontrôlée du contenu luminal dans le corps proprement dit. Son rôle dans la protection des tissus muqueux et du système circulatoire contre l'exposition à des molécules pro-inflammatoires, telles que des micro-organismes, des toxines et des antigènes est essentiel pour le maintien de la santé et du bien-être[1] - [2] - [3]. La dysfonction de la barrière muqueuse intestinale a été impliquée dans de nombreuses pathologies telles que: allergies alimentaires, infections microbiennes, syndrome du côlon irritable, maladie intestinale inflammatoire, maladie cœliaque, syndrome métabolique, stéatose hépatique non alcoolique, diabète et choc septique[3] - [4] - [5].
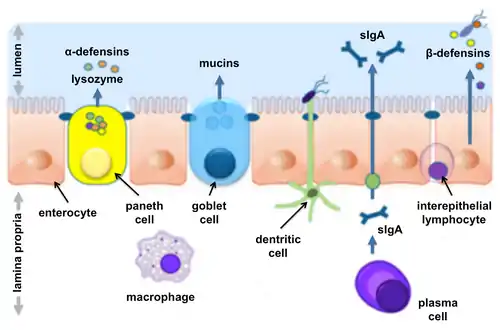
Composition
La barrière muqueuse intestinale est une entité hétérogène composée d'éléments physiques, biochimiques et immunitaires élaborés par la muqueuse intestinale. Le composant central est la couche épithéliale intestinale, qui assure la séparation physique entre la lumière et le corps. La sécrétion de diverses molécules dans la lumière renforce la fonction de barrière du côté extra-épithélial, tandis que diverses cellules immunitaires offrent une protection supplémentaire sous la couche épithéliale[3] - [5] - [6].
Couche de mucus
Le mucus forme une couche (ou des couches, dans le cas du côlon) qui sépare la majeure partie du contenu luminal de l'épithélium intestinal. Le mucus consiste en un gel hydraté hautement glycosylé formé de molécules de mucine sécrétées par les cellules caliciformes. Le mucus empêche les grosses particules d'entrer en contact avec la couche de cellules épithéliales tout en laissant passer les petites molécules. Le mucus facilite également le glissement du contenu luminal contre la paroi intestinale, protège les cellules épithéliales des enzymes digestives et empêche le contact direct des micro-organismes avec la couche épithéliale[1] - [5] - [6] - [7].
L'épithélium intestinal
L'épithélium intestinal est le composant le plus important de la barrière muqueuse intestinale. Il se compose de la couche de cellules épithéliales tapissant l'intestin. Le contrôle précis de la voie para-cellulaire (voie de translocation de molécules entre 2 entérocytes voisins) est crucial pour la formation d’une barrière efficace. L'étanchéité de l'espace entre les cellules adjacentes est médiée par des complexes jonctionnels formés par des connexions protéiques élaborées par chaque cellule individuelle[1]. En plus de sa fonction protectrice, l'épithélium intestinal contrôle l'absorption sélective d'ions bénéfiques, de nutriments et d'autres substances captés dans la lumière intestinale et distribués dans le corps[3] via la veine porte ou le système lymphatique.
Microbiote
Les chercheurs considèrent actuellement que les espèces microbiennes commensales qui habitent l’intestin font partie de la barrière muqueuse intestinale. Le microbiote peut influer directement sur la fonction de barrière en stimulant la prolifération des cellules épithéliales et la sécrétion d'IL-8 et, indirectement, en produisant des acides gras à courte chaîne (AGCC) ou acides gras volatils, tels que lactate, acétate, propionate, butyrate. Le butyrate constitue une source d'énergie importante pour les cellules épithéliales du côlon[3].
Acide biliaire et gastrique
La bile produite par le foie pour faciliter la digestion des lipides a des propriétés bactéricides[7]. L'acide gastrique produit par l'estomac peut également tue de nombreux micro-organismes provenant de l'alimentation[8]. Les sels biliaires et l'acidité gastrique contribuent tous deux à la fonction de barrière intestinale, bien qu'ils ne soient pas produits par la muqueuse intestinale.
Défensines
Les cellules épithéliales sécrétoires spécialisées, appelées cellules de Paneth, sécrètent des quantités abondantes d' α- et β-défensines humaines dans la lumière intestinale d'individus en bonne santé[9].
Lysozyme
Le lysozyme est une autre molécule défensive sécrétée par les cellules de Paneth dans la lumière[10].
Régénérant la protéine 3 gamma dérivée d'îlots (Reg3γ)
Reg3γ est une lectine antibactérienne sécrétée par les cellules de Paneth qui empêche les micro-organismes d'entrer en contact avec la couche épithéliale[3] - [10].
Peptides antimicrobiens
Les peptides antimicrobiens (PAM), sont un ensemble de diverses molécules qui détruisent les bactéries et les champignons.Ils sont sécrétés par les cellules de Paneth dans la lumière[6] - [7].
Immunoglobuline sécrétoire A (IgAs)
Les immunoglobulines A sécrétoires (IgAs) sont produites par les plasmocytes de la lamina propria qui est située à la base de l'épithélium intestinal, puis elles sont transportées vers la lumière intestinale par les cellules entérocytes[7]. Les IgAs bloquent les récepteurs épithéliaux spécifiques situés à la surface des agents pathogènes, empêchant ainsi leur fixation aux cellules épithéliales.
Immunité cellulaire
Une grande variété de cellules immunitaires réside dans la lamina propria. Il s'agit notamment des cellules dendritiques (CD), des macrophages, des lymphocytes intra-épithéliaux (LIE), des cellules T régulatrices (T Regs), des lymphocytes T CD4+, des lymphocytes B et des plasmocytes[6]. Cette population fournit une protection immunitaire qui se caractérise par la détection rapide et la destruction des micro-organismes pénétrant dans l'épithélium intestinal[7].
Physiologie
L’intégrité de la barrière intestinale est fluctuante et il a été démontré que de multiples mécanismes sont capables de moduler la perméabilité intestinale (mesure de la fonction de barrière intestinale)[4]. Les facteurs de modulation comprennent les cytokines, les cellules immunitaires et les facteurs exogènes[4].
La mesure
La perméabilité intestinale est une mesure de la fonction de barrière de la muqueuse intestinale et est définie comme "la facilité avec laquelle l'épithélium intestinal laisse passer des molécules par diffusion passive non médiée"[11]. La perméabilité à cet égard est principalement liée au passage mesurable des ions et des petites molécules inertes. Les méthodes de mesure standard incluent la résistance électrique des tissus pour les tests in vitro et le dosage dans l’urine des molécules inertes ingérées de poids moléculaires spécifiques pour les tests in vivo[12] - [13]. Par exemple, les tests in vivo utilisant du lactulose/mannitol consistent à ingérer 5 g de lactulose et 2 g de mannitol, puis à déterminer les concentrations urinaires de lactulose et de mannitol cinq heures après l'ingestion. Le pourcentage d'excrétion de lactulose et le rapport lactulose/mannitol dans l'urine sont calculés et utilisés comme mesure de la perméabilité intestinale[14].
Régulateurs endogènes
Cytokines
- Interféron gamma (IFNγ) [4]
- Facteur alpha de nécrose tumorale (TNFα) [4]
- L'interleukine 4 (IL4) et l' interleukine 13 (IL-13) des cytokines effectrices des cellules Th2 [4]
- Cytokine anti-inflammatoire interleukine 10 (IL-10) [4]
- Zonuline [4]
Cellules immunitaires
- Lymphocytes intra-épithéliaux intestinaux gamma / delta positifs (iIELγδ+) [4]
- Mastocytes [4]
- Eosinophiles [4]
Régulateurs exogènes
- Alcool [4]
- Les anti-inflammatoires non stéroïdiens (AINS) [4] peuvent entraîner une augmentation de la sécrétion d'acide gastrique, une diminution de la sécrétion de bicarbonate , une diminution de la sécrétion de mucus et une diminution des effets trophiques sur la muqueuse épithéliale en inhibant COX-1 , COX-2 et les prostaglandines .
- Tacrolimus [4]
Agents pathogènes
- Escherichia coli entéropathogène (EPEC) [4]
- Vibrio cholerae [4]
- Clostridium perfringens [4]
- Candida albicans [5]
Signification clinique
Une barrière muqueuse intestinale perturbée peut permettre le passage des microbes, des produits microbiens ainsi que des antigènes étrangers à travers la muqueuse, avant de se disséminer dans tout le corps. Cela peut entraîner une activation du système immunitaire et la sécrétion de médiateurs inflammatoires. Certaines réponses immunitaires pourraient, à leur tour, causer des lésions cellulaires entraînant un dysfonctionnement supplémentaire de la barrière[7]. Les défauts de la fonction de la barrière muqueuse intestinale, accompagnés de la translocation des microbes,de leurs sécrétions toxiques et de leurs produits de dégradation, ont été liés à diverses affections[3], dont certaines sont supposées nécessiter une prédisposition génétique[15]. Des troubles auto-immuns intestinaux et extra-intestinaux peuvent en résulter[15]. On pense que le dysfonctionnement de la barrière intestinale est une condition préalable et un facteur aggravant de nombreuses affections auto-immunes et inflammatoires, notamment les allergies alimentaires, les maladies inflammatoires de l'intestin (Maladie de Crohn et recto-colite ulcéro-hémorragique), la maladie cœliaque et le diabète[4].
Allergies alimentaires
Le dysfonctionnement de la barrière intestinale est un facteur critique pour le développement de sensibilisations aux antigènes alimentaires et la phase effectrice anaphylactique des IgE / mastocytes des allergies alimentaires. Le développement des allergies alimentaires dépend du contact de l'antigène avec les composants du système immunitaire muqueux. Cela conduit à une sensibilisation à l'antigène et à la production de cellules Th2 CD4+ et d'IgE spécifiques aux différents antigènes alimentaires. L'hypothèse est que le dysfonctionnement de la barrière intestinale permet aux antigènes alimentaires de traverser la barrière intestinale, d'entrer en contact avec le système immunitaire muqueux et de déclencher une réponse immunitaire spécifique de l'antigène[4].
Une hyper-perméabilité de la muqueuse intestinale est en corrélation avec la sévérité des symptômes ressentis par les personnes souffrant d'allergies alimentaires. Une provocation orale avec l'allergène impliqué entraîne une augmentation du ratio lactulose / mannitol retrouvé dans les urines (mesure de la perméabilité intestinale)[4].
Maladie inflammatoire de l'intestin
Un modèle émergent de pathogenèse de la maladie inflammatoire de l'intestin (MICI) postule trois facteurs préalables: 1) la dégradation de la fonction de barrière intestinale, 2) la translocation du contenu luminal dans la lamina propria et l'exposition subséquente aux cellules immunitaires, et 3) une réponse immunitaire inappropriée. Bien que le dysfonctionnement de la barrière intestinale soit clairement impliqué dans le développement de la maladie inflammatoire de l'intestin, il est difficile de savoir ce qui initie le cycle d'auto-perpétuation menant à l'exacerbation de la maladie. Néanmoins, de plus en plus de preuves suggèrent une augmentation de la perméabilité intestinale en tant que facteur étiologique principal de la pathogenèse des maladies inflammatoires de l'intestin[4].
Maladie cœliaque
Une fonction de barrière intestinale altérée peut jouer un rôle dans le développement de la maladie cœliaque. En permettant à la gliadine, l'agent causal de la maladie cœliaque, de traverser la barrière intestinale, une activation inappropriée du système immunitaire peut survenir. Il a été démontré que les personnes souffrant de la maladie cœliaque avaient une perméabilité intestinale élevée et des jonctions serrées altérées. De plus, ces perturbations persistent chez les patients qui maintiennent avec succès un régime alimentaire sans gluten. Il existe également des données démontrant qu'une augmentation de la perméabilité intestinale est présente avant l'apparition de la maladie cœliaque[4].
Diabète de type 1
On a émis l'hypothèse qu'une combinaison de génétique, de fonction de barrière intestinale dérégulée et de réponses immunitaires inappropriées joue un rôle dans le diabète de type 1. Une perméabilité intestinale élevée a été observée chez des patients au début de la maladie. L’augmentation de l’exposition aux antigènes qui en résulte peut entraîner une destruction auto-immune des cellules bêta du pancréas[4].
D'autres conditions
Des défauts de la fonction de barrière muqueuse intestinale ont également été impliqués dans le syndrome du côlon irritable, le syndrome métabolique, la stéatose hépatique non alcoolique et le choc septique[3] - [13].
Stress
Les stress psychologiques ou physiques peuvent induire diverses altérations de la fonction intestinale. Celles-ci incluent des modifications de la motilité intestinale, de la perméabilité intestinale, du flux ionique, de l'équilibre hydrique et de la sécrétion de mucus. De plus, l'étude des stress aussi bien aigus que chroniques, dans les modèles animaux, ont démontré leurs capacité à entraîner une dégradation importante de la fonction de barrière intestinale[4]. Le stress psychologique peut influer sur l'issue clinique de la maladie inflammatoire de l'intestin et du syndrome du côlon irritable. Il a été démontré que le stress chronique pouvait être associé à des rechutes de colite ulcéreuse[4] .
L'histoire
Cummings a adopté le terme barrière muqueuse en 2004 pour décrire la "structure complexe qui sépare le milieu interne de l'environnement luminal"[16]. Plus récemment, des gastro-entérologues, des immunologistes et des microbiologistes ont utilisé la barrière intestinale pour souligner le composant de l'intestin qui protège le corps contre les micro-organismes et leurs toxines[6].
Notes et références
- Turner, « Intestinal mucosal barrier function in health and disease. », Nat Rev Immunol, vol. 9, , p. 799–809 (PMID 19855405, DOI 10.1038/nri2653)
- Lee, « Intestinal Permeability Regulation by Tight Junction: Implication on Inflammatory Bowel Diseases », Intestinal Research, vol. 13, no 1, , p. 11–18 (ISSN 1598-9100, PMID 25691839, PMCID 4316216, DOI 10.5217/ir.2015.13.1.11)
- Sánchez de Medina, Romero-Calvo, Mascaraque et Martínez-Augustin, « Intestinal inflammation and mucosal barrier function », Inflammatory Bowel Diseases, vol. 20, no 12, , p. 2394–2404 (ISSN 1536-4844, PMID 25222662, DOI 10.1097/MIB.0000000000000204)
- Groschwitz et Hogan, « Intestinal Barrier Function: Molecular Regulation and Disease Pathogenesis », The Journal of Allergy and Clinical Immunology, vol. 124, no 1, , p. 3–22 (ISSN 0091-6749, PMID 19560575, PMCID 4266989, DOI 10.1016/j.jaci.2009.05.038)
- Yan, Yang et Tang, « Disruption of the intestinal mucosal barrier in Candida albicans infections », Microbiological Research, vol. 168, no 7, , p. 389–395 (ISSN 1618-0623, PMID 23545353, DOI 10.1016/j.micres.2013.02.008)
- De Santis, Cavalcanti, Mastronardi et Jirillo, « Nutritional Keys for Intestinal Barrier Modulation », Frontiers in Immunology, vol. 6, (ISSN 1664-3224, PMID 26697008, PMCID 4670985, DOI 10.3389/fimmu.2015.00612)
- Márquez, Fernández Gutiérrez et Girón-González, « Gut epithelial barrier dysfunction in human immunodeficiency virus-hepatitis C virus coinfected patients: Influence on innate and acquired immunity. », World J. Gastroenterol., vol. 22, , p. 1433–48 (PMID 26819512, PMCID 4721978, DOI 10.3748/wjg.v22.i4.1433)
- Schubert, « Gastric secretion », Curr Opin Gastroenterol, vol. 30, , p. 578–82 (PMID 25211241, DOI 10.1097/MOG.0000000000000125)
- Jäger, Stange et Wehkamp, « Inflammatory bowel disease: an impaired barrier disease. », Langenbecks Arch Surg., vol. 398, , p. 1–12 (PMID 23160753, DOI 10.1007/s00423-012-1030-9)
- Ouellette, « Paneth Cell α-Defensins in Enteric Innate Immunity », Cell Mol Life Sci, vol. 68, , p. 2215–29 (PMID 21560070, PMCID 4073591, DOI 10.1007/s00018-011-0714-6)
- Travis et Menzies, « Intestinal permeability: functional assessment and significance », Clinical Science, vol. 82, no 5, , p. 471–488 (ISSN 0143-5221, PMID 1317756, DOI 10.1042/cs0820471)
- Ménard, Cerf-Bensussan et Heyman, « Multiple facets of intestinal permeability and epithelial handling of dietary antigens », Mucosal Immunology, vol. 3, no 3, , p. 247–259 (ISSN 1935-3456, PMID 20404811, DOI 10.1038/mi.2010.5)
- Bischoff, Barbara, Buurman et Ockhuizen, « Intestinal permeability--a new target for disease prevention and therapy », BMC Gastroenterology, vol. 14, , p. 189 (ISSN 1471-230X, PMID 25407511, PMCID 4253991, DOI 10.1186/s12876-014-0189-7)
- Johnston, Smye, Watson et McMillan, « Lactulose-mannitol intestinal permeability test: a useful screening test for adult coeliac disease », Annals of Clinical Biochemistry, vol. 37, no 4, , p. 512–519 (ISSN 0004-5632, PMID 10902869, DOI 10.1177/000456320003700413)
- Fasano et Shea-Donohue, « Mechanisms of disease: the role of intestinal barrier function in the pathogenesis of gastrointestinal autoimmune diseases », Nature Clinical Practice Gastroenterology & Hepatology, vol. 2, no 9, , p. 416–422 (ISSN 1743-4378, PMID 16265432, DOI 10.1038/ncpgasthep0259)
- Cummings, Antoine, Azpiroz et Bourdet-Sicard, « PASSCLAIM--gut health and immunity », European Journal of Nutrition, vol. 43 Suppl 2, , II118–II173 (ISSN 1436-6207, PMID 15221356, DOI 10.1007/s00394-004-1205-4)
Voir également
- Peptides antimicrobiens
- Immunoglobuline A
- Épithélium intestinal
- Physiologie gastro-intestinale
- Appareil digestif humain
- Tissu lymphoïde associé à la muqueuse ou GALT (Gut Associated Lymphoid Tissue)
- Mucine