Acide tellurique
L'acide tellurique est un composé chimique de formule Te(OH)6, également écrite H6TeO6. Il se présente sous la forme d'un solide blanc rhomboédrique ou monoclinique constitué de molécules à géométrie octaédrique[3] conservée en solution aqueuse[4]. L'acide tellurique est un acide faible diprotique qui forme des tellurates avec les bases fortes et des hydrogénotellurates avec les bases faibles ou par hydrolyse de tellurates[3] - [5].
| Acide tellurique | |||
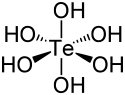
| |||
| Structure de l'acide tellurique | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide orthotellurique | ||
| No CAS | |||
| No ECHA | 100.029.334 | ||
| No CE | 232-267-6 | ||
| No RTECS | WY2350000 | ||
| PubChem | 62686 | ||
| ChEBI | 30461 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | H6O6Te |
||
| Masse molaire[1] | 229,64 ± 0,03 g/mol H 2,63 %, O 41,8 %, Te 55,57 %, |
||
| Précautions | |||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Préparation
On peut obtenir l'acide tellurique par oxydation du tellure ou du dioxyde de tellure TeO2 avec un oxydant fort comme le peroxyde d'hydrogène H2O2, le trioxyde de chrome CrO3 et le peroxyde de sodium Na2O2[3].
La cristallisation de solutions d'acide tellurique en dessous de 10 °C donne l'hydrate Te(OH)6·4H2O[4]. C'est un oxydant, comme le montre le potentiel d'électrode de la réaction ci-dessous, bien que les oxydations qu'il réalise soient lentes[3] :
Les potentiels correspondants pour le chlore Cl2 et l'acide sélénieux H2SeO3 sont respectivement +1,36 V et +0,74 V en conditions oxydantes.
Propriétés
L'acide tellurique anhydre est stable à l'air jusqu'à 100 °C mais se déshydrate pour former l'acide polymétatellurique, une poudre blanche hygroscopique blanche de formule approximative (H2TeSO4)10, et l'acide allotellurique, de formule approximative (H2TeO4)3(H2O)4[4].
Les sels de l'acide tellurique contiennent généralement les anions [TeO(OH)5]− and [TeO2(OH)4]2−. La présence de l'ion tellurate TeO42− a été confirmée dans la structure du solide de formule Rb6[TeO5][TeO4][6]. Un chauffage au-delà de 300 °C conduit à la formation de la forme cristalline α du trioxyde de tellure α-TeO3[5]. La réaction avec le diazométhane CH2N2 donne l'ester hexaméthylique (MeO)6Te[4].
L'acide tellurique et ses sels contiennent généralement du tellure hexacoordonné[3], y compris pour des sels comme le tellurate de magnésium MgTeO4, qui est isostructurel avec le molybdate de magnésium et contient du TeO6 octaédrique[3].
Composés apparentés
L'acide métatellurique H2TeO4, analogue de l'acide sulfurique H2SO4, n'a pas été isolé. L'acide allotellurique, de formule approximative (H2TeO4)3(H2O)4, n'est pas clairement caractérisé et peut être un mélange de Te(OH)6 et de (H2TeO4)n[4].
L'acide tellureux H2TeO3, avec le tellure à l'état d'oxydation +4, a été isolé mais n'est pas clairement caractérisé. Le tellurure d'hydrogène H2Te est un gaz instable qui forme l'acide hydrotellurique avec l'eau.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Telluric acid purum, ≥99.0% (T), consultée le 24 juillet 2018.
- (en) F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo et Manfred Bochmann, Advanced Inorganic Chemistry, 6e édition, Wiley-Interscience, New-York, 1999. (ISBN 0-471-19957-5)
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997. (ISBN 0-08-037941-9)
- (en) A. F. Holleman et E. Wiberg, Inorganic Chemistry, Academic Press, San Diego, 2001. (ISBN 0-12-352651-5)
- (en) Catherine E. Housecroft et Alan G. Sharpe, « Chapter 16: The group 16 elements », Inorganic Chemistry, 3e édition, Pearson, 2008, p. 526. (ISBN 978-0-13-175553-6)

