Acide sélénieux
L'acide sélénieux est un composé chimique de formule H2SeO3. C'est le principal oxoacide de sélénium, l'autre étant l'acide sélénique H2SeO4. C'est un analogue de l'acide sulfureux H2SO3, mais il est plus facile à isoler. On l'obtient facilement par addition de dioxyde de sélénium SeO2 et d'eau H2O. À l'état solide cristallisé, ses molécules sont pyramidales, unies par des liaisons hydrogène. En solution aqueuse, c'est un diacide diprotique.
- H2SeO3 H+ + HSeO3− (pKa = 2,62)
- HSeO3− H+ + SeO32− (pKa = 8,32)
| Acide sélénieux | |
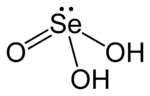
| |
| Structure de l'acide sélénieux | |
| Identification | |
|---|---|
| Nom UICPA | acide sélénieux |
| No CAS | |
| No ECHA | 100.029.067 |
| No CE | 231-974-7 |
| No RTECS | VS7175000 |
| PubChem | 1091 |
| ChEBI | 26642 |
| SMILES | |
| InChI | |
| Apparence | solide blanc hygroscopique |
| Propriétés chimiques | |
| Formule | H2SeO3 |
| Masse molaire[1] | 128,97 ± 0,03 g/mol H 1,56 %, O 37,22 %, Se 61,22 %, |
| Propriétés physiques | |
| T° fusion | 70 °C[2] (décomposition) |
| Solubilité | 1 670 g·L-1[2] |
| Masse volumique | 3,004 g·cm-3[2] à 15 °C |
| Précautions | |
| SGH[2] | |
   Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est faiblement oxydant, avec une cinétique assez lente. À 1 mol·L-1 d'ions H+ :
À 1 mol·L-1 d'ions OH− :
Il est utilisé en synthèse organique pour produire des 1,2-dialdéhydes, comme le glyoxal O=CH–CH=O[3].
L'utilisation principale de l'acide sélénieux est dans le bleuissage des surfaces métalliques, notamment des aciers des armes à feu. Ainsi, on utilise de l'acide sélénieux H2SeO3 avec du nitrate de cuivre(II) Cu(NO3)2 et de l'acide nitrique HNO3 pour changer la couleur de l'acier depuis le gris argenté vers le gris-bleu ou le noir. D'autres procédés font plutôt intervenir du sulfate de cuivre CuSO4 et de l'acide phosphorique H3PO4. Il se forme dans tous les cas une couche de passivation en séléniure de cuivre(I) Cu2-δSe, ce qui différencie ces procédés des autres bleuissages, qui aboutissent à la formation d'oxyde de fer(II,III) FeO·Fe2O3.
Il est également employé dans certains tests de dépistage de l'utilisation de produits stupéfiants[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Selenious acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 mai 2017 (JavaScript nécessaire)
- (en) Anthony R. Ronzio et T. D. Waugh, « Glyoxal Bisulfite », Organic Syntheses, vol. 24, , p. 61 (DOI 10.15227/orgsyn.024.0061, lire en ligne)
- (en) « Color Test Reagents/Kits for Preliminary Identification of Drugs of Abuse », Law Enforcement and Corrections Standards and Testing Program, sur U.S. Department of Justice, Office of Justice Programs, National Institute of Justice, (consulté le ).

