Acide tellureux
L'acide tellureux est un composé chimique de formule H2TeO3. C'est l'oxoacide de tellure(IV)[3]. Ce composé n'est pas clairement caractérisé, avec une teneur en eau généralement inférieure à la formule limite H2TeO3. Il est métastable et perd progressivement son eau à moins d'être stocké dans l'eau, auquel cas il peut être conservé plusieurs jours. Il se déshydrate rapidement lorsqu'il est chauffé, pour donner du dioxyde de tellure TeO2.
| Acide tellureux | |
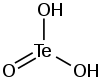
| |
| Structure de l'acide tellureux | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.145 |
| No CE | 233-173-8 |
| PubChem | 24936 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2O3Te |
| Masse molaire[1] | 177,61 ± 0,03 g/mol H 1,14 %, O 27,02 %, Te 71,84 %, |
| Propriétés physiques | |
| Masse volumique | 3,05 g·cm-3[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide tellureux se forme en principe sous l'action de l'eau sur le dioxyde de tellure (hydrolyse). Sa base conjuguée est bien connue sous la forme de plusieurs sels, comme le tellurite de sodium Na2TeO3 ou l'hydrogénotellurite de potassium KHTeO3. La plupart des tellurites contiennent l'anion TeO32−. L'oxydation d'une solution aqueuse d'acide tellureux par le peroxyde d'hydrogène donne l'ion tellurate TeO42−. On le prépare généralement sous forme de solution aqueuse, dans laquelle il se comporte comme un acide faible.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Dale L. Perry, Handbook of Inorganic Compounds, 2e édition, CRC Press, 2011, p. 415. (ISBN 1-4398-1462-7)
- (en) Norman N. Greenwood et Alan Earnshaw, (1997). Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997. (ISBN 0-08-037941-9)
- (en) Debbie Sackett, « Weak Acids », sur http://www.austincc.edu/, Austin Community College District (consulté le ).
