Tellurate
Un tellurate est un composé chimique contenant un oxyanion de tellure dans lequel cet élément est à l'état d'oxydation +6, formellement dérivé de l'acide tellurique Te(OH)6, par opposition à un tellurite, qui est un composé contenant un oxyanion de tellure à l'état d'oxydation +4, formellement dérivé de l'acide tellureux H2TeO3. Ces deux oxyanions sont cependant couramment désignés respectivement comme tellurate(VI) et tellurate(IV) en accord avec les recommandations de l'IUPAC. L'ion métatellurate a pour formule TeO42− tandis que l'ion orthotellurate a pour formule TeO66−. Parmi les autres oxyanions du tellure, on peut également citer le pentaoxotellurate TeO54−[1], le ditellurate Te2O108−[2] et des anions polymériques avec du tellure hexacoordonné, comme (TeO56−)n[3].
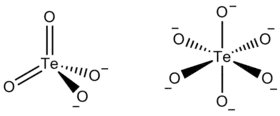
Oxyanions du tellure
Métatellurates
L'anion métatellurate TeO42− est analogue à l'anion sulfate SO42− et à l'anion séléniate SeO42−. Cependant, alors que les sulfates et les séléniates forment des sels isomorphes[4], l'ion métatellurate tétraédrique n'est observé que dans quelques composés tels que le sel de tétraéthylammonium NEt4TeO4[5]. De nombreux composés dont la stœchiométrie suggère la présence d'ions métatellurate contiennent en réalité des anions polymériques de tellure(VI) hexacoordonné, comme le tellurate de sodium Na2TeO4, qui contient des octaèdres centrés sur le tellure et qui se touchent par des sommets[6].
Le potentiel d'oxydo-réduction standard E0 est significatif car il donne une indication de la force de l'ion tellurate comme oxydant[7].
Orthotellurates
On connaît des composés contenant l'anion TeO66−, comme Ag6TeO6, Na6TeO6 et Hg3TeO6[8]. Il existe également des hydroxyoxotellurates, qui contiennent du TeO66− protoné, comme (NH4)2TeO2(OH)4, parfois écrit NH4TeO4·2H2O, qui contient l'ion TeO2(OH)42− octaédrique[9].
Ion TeO54−
Le composé Cs2K2TeO5 contient des ions TeO54− de géométrie bipyramidale trigonale[1]. Le composé Rb6Te2O9 contient à la fois des anions TeO54− et TeO42−[10]. D'autres composés dont la stœchiométrie suggère la présence d'ions TeO54− peuvent contenir le dimère Te2O108− constitué de deux octaèdres TeO6 partageant ou bien un sommet comme dans le Li4TeO5[2] et le Ag4TeO5[11] ou bien une arête comme dans le Hg2TeO5[3].
Ions polymériques
L'ion dimérique Te2O108−, formé de deux octaèdres de TeO6 partageant une arête commune, est observé dans le composé Li4TeO5[2]. Un hydroxy-oxyanion semblable, Te2O6(OH)4, est présent dans l'hexahydrate de ditellurate(VI) de sodium et de potassium Na0.5K3.5Te2O6(OH)4·6H2O, qui contient des paires d'octaèdres ayant une arête en commun[12]. On trouve des chaînes d'anions polymériques (TeO5)4n−
n formées d'octaèdres TeO6 par exemple dans le composé Li4TeO5[2].
Chimie aqueuse
En solution aqueuse, les ions tellurate sont hexacoordonnés. À pH neutre, l'ion le plus courant est H5TeO6−. À pH élevé (basique), c'est l'ion H4TeO62−, tandis qu'à pH faible (acide), il se forme de l'acide tellurique H6TeO6, encore écrit Te(OH)6[7].
Comparaison structurelle avec les oxyanions de soufre et de sélénium
Les oxyanions de soufre ont une coordinence de 4 et tous ces ions, qu'il s'agisse du sulfate SO42−, du pyrosulfate S2O72−, du trisulfate S3O102− et du pentasulfate S5O162−, contiennent du soufre tétracoordonné dans des tétraèdres unis par des sommets[13].
Il existe de nombreux exemples de sélénium tétracoordonné parmi les séléniates, notamment l'ion tétraédrique SeO42− et l'ion pyroséléniate Se2O72−, dont la structure est semblable à celle de l'ion pyrosulfate S2O72−[14]. Contrairement au cas du soufre, il existe des composés de l'oxyanion de sélénium pentacoordonné comme SeO54− et un exemple de composé de l'ion SeO66−[15] - [16] - [17].
Spectroscopie RMN
Le tellure a deux noyau actif pour la spectroscopie RMN, le 123Te et le 125Te. Le 123Te a une abondance de 0,9 % est un spin nucléaire valant 1⁄2. Le 125Te a une abondance de 7 % et également un spin de 1⁄2[18]. On utilise davantage le 125Te car il a une meilleure sensibilité[19]. L'ion métatellurate présente un déplacement chimique d'environ 610 ppm lorsqu'il est analysé à l'aide du 125Te à 25 °C, à une fréquence de 94,735 MHz et par rapport à une solution aqueuse molaire d'acide tellurique (concentration de 1 mol/L)[5].
Notes et références
- (de) H. Untenecker et R. Hoppe, « Die koordinationszahl 5 bei telluraten: Cs2K2[TeO5] », Journal of the Less Common Metals, vol. 124, nos 1-2, , p. 29-40 (DOI 10.1016/0022-5088(86)90474-1, lire en ligne)
- (en) A. F. Wells, Structural Inorganic Chemistry, 5e édition, Oxford Science Publications, 1984. (ISBN 0-19-855370-6)
- (en) Matthias Weil, « Preparation, Thermal Behaviour and Crystal Structure of the Basic Mercury(II) Tetraoxotellurate(VI), Hg2TeO5, and Redetermination of the Crystal Structure of Mercury(II) Orthotellurate(VI), Hg3TeO6 », Zeitschrift für anorganische und allgemeine Chemie, vol. 629, no 4, , p. 653-657 (DOI 10.1002/zaac.200390111, lire en ligne)
- (en) F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, Manfred Bochmann, Advanced Inorganic Chemistry, 6e édition, Wiley-Interscience, New York, 1999, p. 531. (ISBN 0-471-19957-5)
- (en) Saki Konaka, Yoshiki Ozawa et Atsushi Yagasaki, « Tetrahedral Tellurate », Inorganic Chemistry, vol. 47, no 4, , p. 1244-1245 (PMID 18220344, DOI 10.1021/ic701578p, lire en ligne)
- (en) B. Kratochvíl et L. Jensovský, « The crystal structure of sodium metatellurate », Acta Crystallographica Section B, vol. 33, no 8, , p. 2596-2598 (DOI 10.1107/S0567740877008978, lire en ligne)
- (en) Ray L. Frost, « Tlapallite H6(Ca,Pb)2(Cu,Zn)3SO4(TeO3)4TeO6, a multi-anion mineral: A Raman spectroscopic study », Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, vol. 72, no 4, , p. 903-906 (DOI 10.1016/j.saa.2008.12.008, Bibcode 2009AcSpA..72..903F, lire en ligne)
- (en) Arnold Frederik Holleman et Egon Wiberg, Inorganic Chemistry, traduit par Mary Eagleson et William Brewer, Nils Wiberg éditeur, Academic Press/De Gruyter, San Diego/Berlin, 2001, p. 593. (ISBN 0-12-352651-5)
- (en) G. B. Johansson, O. Lindqvist et J. Moret, « Diammonium tellurium(VI) dioxide tetrahydroxide », Acta Crystallographica Section B, vol. 35, no 7, , p. 1684-1686 (DOI 10.1107/S056774087900741X, lire en ligne)
- (en) Norman N. Greenwood et Alan Earnshaw, (1997). Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997, p. 782. (ISBN 0-08-037941-9)
- (en) Matthias Weil, « New Silver Tellurates – The Crystal Structures of a Third Modification of Ag2Te2O6 and of Ag4TeO5 », Zeitschrift für anorganische und allgemeine Chemie, vol. 633, no 8, , p. 1217-1222 (DOI 10.1002/zaac.200700106, lire en ligne)
- (en) B. Kratochvíl, J. Podlahová et L. Jensovský, « Sodium potassium ditellurate(VI) hexahydrate », Acta Crystallographica Section B, vol. 34, no 1, , p. 256-258 (DOI 10.1107/S056774087800271X, lire en ligne).
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997, p. 712. (ISBN 0-08-037941-9)
- (de) R. Paetzold, H. Amoulong et A. Růžička, « Untersuchungen an Selen–Sauerstoff–Verbindungen. XXVI. Schwingungsspektrum und Kraftkonstanten des Diselenations », Zeitschrift für anorganische und allgemeine Chemie, vol. 336, nos 5-6, , p. 278-285 (DOI 10.1002/zaac.19653360508, lire en ligne).
- (en) Helmut Haas et Martin Jansen, « Octahedral SeO66− and Square‐Pyramidal SeO54−, Two New Oxoselenate Anions », Angewandte Chemie, International Edition, vol. 39, no 23, , p. 4362-4364 (PMID 29711896, DOI 10.1002/1521-3773(20001201)39:23<4362::AID-ANIE4362>3.0.CO;2-S, lire en ligne).
- (en) Denis Orosel, Robert Dinnebier et Martin Jansen, « High-Pressure Synthesis and Structure Determination of K6(SeO4)(SeO5), the First Potassium Orthoselenate(VI) », Inorganic Chemistry, vol. 45, no 26, , p. 10947-10950 (PMID 17173453, DOI 10.1021/ic061548v, lire en ligne).
- (de) Helmut Haas et Martin Jansen, « Na4SeO5, ein neues Pentaoxoselenat(VI) – Synthese, Charakterisierung und Vergleich mit isotypem Na4MoO5 », Zeitschrift für anorganische und allgemeine Chemie, vol. 627, no 4, , p. 755-760 (DOI 10.1002/1521-3749(200104)627:4<755::AID-ZAAC755>3.0.CO;2-L, lire en ligne).
- (en) C. E. Housecroft et A. G. Sharpe, Inorganic Chemistry, 3e édition, Prentice Hall, 2008. (ISBN 978-0131755536)
- (en) R. S. Drago, Physical Methods for Chemists, 2e édition, Surfside Scientific Publishers, 1992.