Tellurite (ion)
L'ion tellurite est un oxyanion de tellure de formule chimique TeO32− dans lequel le tellure est à l'état d'oxydation +4, formellement dérivé de l'acide tellureux H2TeO3, par opposition à l'ion tellurate, dans lequel le tellure est à l'état d'oxydation +6 et est formellement dérivé de l'acide tellurique Te(OH)6. Ces deux oxyanions sont cependant couramment désignés respectivement comme tellurate(IV) et tellurate(VI) en accord avec les recommandations de l'IUPAC. Par extension, les composés contenant cet ion, notamment ses sels, sont appelés tellurites.
| Ion tellurite | |
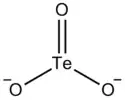
| |
| Structure de l'ion tellurite | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 115037 |
| ChEBI | 30477 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | TeO32− |
| Masse molaire[alpha 1] | 175,6 ± 0,03 g/mol O 27,33 %, Te 72,67 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Cet anion présente une géométrie tétraédrique, comme les ions sélénite SeO32− et sulfite SO32−, dans le groupe de symétrie C3v.
Les tellurites, comme le tellurite de sodium Na2TeO3, se présentent généralement sous la forme de sels cristallisés ayant l'apparence d'une poudre blanche à cristaux incolores, semblable aux sulfites[1]. Il existe au moins un minéral ayant la composition d'un tellurite, l'emmonsite, constituée d'un tellurite de fer hydraté, de formule chimique FeIII2(TeO3)3 • 2 H2O.
Les tellurites peuvent être réduits en tellure par électrolyse ou à l'aide d'un réducteur énergique. Lorsqu'ils sont fondus en présence de sels de nitrate, les tellurites peuvent s'oxyder en tellurates TeO42−. Lorsqu'on acidifie une solution aqueuse de tellurites, il se forme un précipité de dioxyde de tellure TeO2 hydraté. Cette réaction permet de séparer le tellure du sélénium car l'acide sélénieux H2SeO3 reste en solution à pH acide.
Notes et références
Notes
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Références
- (en) Norman N. Greenwood, Alan Earnshaw, Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997. (ISBN 0-08-037941-9)