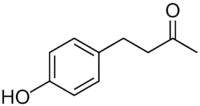
4-(4-Hydroxyphényl)-2-butanone
La 4-(4-hydroxyphényl)-2-butanone, rhéosmine, oxyphénylone, frambinone, frambione ou cétone de la framboise est un composé phénolique naturel de formule C10H12O2. C'est le principal composé aromatique de la framboise.
| 4-(4-Hydroxyphényl)-2-butanone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | 4-(4-hydroxyphényl)butan-2-one | |
| Synonymes |
4-(parahydroxyphényl)-2-butanone, frambinone, oxyphénylone, rhéosmine |
|
| No CAS | ||
| No ECHA | 100.024.370 | |
| No RTECS | EL8925000 | |
| PubChem | 21648 | |
| SMILES | ||
| InChI | ||
| Apparence | solide cristallin blanc cassé, odeur sucrée[1] | |
| Propriétés chimiques | ||
| Formule | C10H12O2 [Isomères] |
|
| Masse molaire[2] | 164,201 1 ± 0,009 4 g/mol C 73,15 %, H 7,37 %, O 19,49 %, |
|
| Propriétés physiques | ||
| T° fusion | 82,5 °C[1] | |
| T° ébullition | se décomposé si chauffé[1] | |
| Solubilité | pratiquement insoluble dans l'eau[1] | |
| Précautions | ||
| SGH | ||
 Attention |
||
| Écotoxicologie | ||
| DL50 | 1 320 mg·kg-1 (rat, oral)[3] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Occurrence naturelle

Elle est présente en particulier dans les framboises (Rubus idaeus) dont elle est le principal composant odorant. Cependant, l'arôme naturel de framboises résulte d'une combinaison d'environ 250 substances, principalement des alcools comme le linalol et le géraniol, des cétones comme l'ionone, des aldéhydes, des esters (formiate d'éthyle) ou des lactones[4] Elle peut en être extraite à raison d'environ 1 à 4 mg par kg de framboises[5].
Le composé est également présent dans d'autres fruits rouges comme les canneberges (Oxycoccos) et les mûres (Rubus) [6], la mûre de Logan (Rubus ×loganobaccus)[7], directement ou sous la forme d'hétérosides comme la lindléyine ou l'isolindléyine[8], mais également dans d'autres types de fruits comme les kiwis, les pêches, le raisin, les pommes, ainsi que dans la rhubarbe et dans l'écorce d'if, d'érable et de pin[9].
Comme de nombreux composés phénoliques, elle est issue de la voie des phénylpropanoïdes, et est biosynthétisée à partir de la coumaroyl-CoA[10].
La cétone est également présente dans la fumée de tabac, bien qu'elle n'ait pas été trouvée dans le tabac lui-même[11].
Synthèse
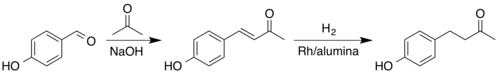
Du fait de sa faible abondance naturelle, elle est synthétisée industriellement de diverses façons à partir d'intermédiaires variés[12]. Une méthode consiste en la crotonisation croisée entre l'acétone et le 4-hydroxybenzaldéhyde, formant une cétone α,β-insaturée. Sa partie alcène est ensuite réduite en alcane par hydrogénation catalytique. Cette méthode en deux étapes a un rendement de 99 %[13]. L'exemple ci-dessous utilise un catalyseur rhodium/alumine, mais il en existe de plus économiques comme le catalyseur au borure de nickel (en), qui montre une haute sélectivité pour l'hydrogénation de cette double liaison de l'énone[14].
Utilisation
La frambione est parfois utilisée en parfumerie, dans les cosmétiques et comme additif alimentaire pour donner une odeur fruitée. C'est l'un des composants d'arômes naturels les plus chers utilisés dans l'industrie alimentaire. Le composé naturel peut coûter jusqu'à 20 000 dollars le kg[5], raison pour laquelle on préfère en général son équivalent synthétique.
Prétendu remède miracle
Des préparations contenant de la frambione sont proposées comme produits amincissants. Ces produits ont connu une immense popularité en 2012, date à laquelle le controversé chirurgien américano-turc Mehmet Oz les a présentés comme un remède miracle dans son émission The Dr. Oz Show[15].
Il n'existe cependant aucune preuve clinique de cet effet chez l'homme[9].
Sécurité alimentaire
Si, en 1965, la Food and Drug Administration américaine a classé la frambione comme sans danger (« generally recognized as safe » ) aux doses où elle est utilisée comme arôme alimentaire[16], il existe des doutes concernant l'effet à long terme de compléments alimentaires extrêmement riches en ce composé[17] - [18], en particulier car très peu de recherches sur l'être humain ont été effectuées[19].
Le fait que la frambinone ait une structure analogue à celle de la synéphrine (en), un stimulant, a soulevé des questions quant à son innocuité[9]. Des modélisations toxicologiques prédisent un potentiel effet cardiotoxique, ainsi que des effets sur la reproduction et le développement[17].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Raspberry ketone » (voir la liste des auteurs) et en allemand « Himbeerketon » (voir la liste des auteurs).
- Entrée « 4-(4-Hydroxyphenyl)-2-butanone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Food and Cosmetics Toxicology. Vol. 8, Pg. 349, 1970
- R. Marsili: Flavor, fragrance, and odor analysis, CRC Press, 2001, (ISBN 978-0-8247-0627-2).
- Jules Beekwilder, Ingrid M. Van Der Meer, Ole Sibbesen, Mans Broekgaarden, Ingmar Qvist, Joern D. Mikkelsen et Robert D. Hall, « Microbial production of natural raspberry ketone », Biotechnology Journal, vol. 2, no 10, , p. 1270–9 (PMID 17722151, DOI 10.1002/biot.200700076)
- Raspberry Ketone, Molecule of the Month, University of Bristol
- (en) G. A. Burdock, Encyclopedia of Food and Color Additives, CRC Press, , 3153 p. (ISBN 978-0-8493-9416-4, lire en ligne)
- (en) J. Buckingham, Dictionary of natural products, CRC Press, , 8584 p. (ISBN 978-0-412-46620-5, lire en ligne), p. 3183
- « Raspberry Ketone », WebMD
- « MetaCyc Pathway: raspberry ketone biosynthesis », MetaCyc (consulté le )
- (en) T. A. Perfetti, A. Rodgman, The Chemical Components of Tobacco and Tobacco Smoke, CRC Press, , 1840 p. (ISBN 978-1-4200-7883-1), p. 231
- Jun-Ichi Tateiwa, Hiroki Horiuchi, Keiji Hashimoto, Takayoshi Yamauchi et Sakae Uemura, « Cation-Exchanged Montmorillonite-Catalyzed Facile Friedel-Crafts Alkylation of Hydroxy and Methoxy Aromatics with 4-Hydroxybutan-2-one to Produce Raspberry Ketone and Some Pharmaceutically Active Compounds », The Journal of Organic Chemistry, vol. 59, no 20, , p. 5901–4 (DOI 10.1021/jo00099a017)
- Leverett R. Smith, « Rheosmin ('Raspberry Ketone') and Zingerone, and Their Preparation by Crossed Aldol-Catalytic Hydrogenation Sequences », The Chemical Educator, vol. 1, no 3, , p. 1–18 (DOI 10.1007/s00897960034a)
- Mikhail Bandarenko et Vitaly Kovalenko, « Synthesis of Raspberry and Ginger Ketones by Nickel Boride-catalyzed Hydrogenation of 4-Arylbut-3-en-2-ones », Zeitschrift für Naturforschung B, vol. 69b, no 8, , p. 885–888 (DOI 10.5560/ZNB.2014-4118)
- (en) Annie Hauser, « Dr. Oz's 'Miracle Fat Burner' Raspberry Ketone: Does It Work? », sur everydayhealth.com, (consulté le )
- « 4-(p-Hydroxyphenyl)-2-butanone », Food and Cosmetics Toxicology, vol. 16, , p. 781–2 (DOI 10.1016/S0015-6264(78)80113-8)
- Bredsdorff L, Wedebye EB, Nikolov NG, Hallas-Møller T, Pilegaard K, « Raspberry ketone in food supplements - High intake, few toxicity data - A cause for safety concern? », Regul Toxicol Pharmacol, vol. 73, no 1, , p. 196–200 (DOI 10.1016/j.yrtph.2015.06.022)
- Cathy Wong, « Raspberry Ketones for Weight Loss », About.com
- Jules Canberra, « What's All The Hype About Raspberry Ketone? », sur Authority Health (consulté le )