Évolution de la couleur et de la morphologie chez les fleurs
Les angiospermes sont le groupe de plantes vertes le plus répandu et ce succès évolutif est, en grande partie, dû à l'évolution de la couleur et de la morphologie chez les fleurs. Le pollen de la fleur mâle féconde le pistil de la fleur femelle de même espèce, et creuse un tube pollinique le long du pistil qui descend dans le carpelle où se trouvent les ovules. L'ovule fécondé donnera le fruit qui lui-même donnera une (ou des) graine(s). Les graines germent ensuite pour donner une nouvelle plante.
Les fleurs ont rendu possible le développement de l’entomogamie (pollinisation faisant intervenir les insectes) qui serait une des forces évolutives ayant conduit à leur expansion rapide. Ainsi, il est possible d'expliquer l'évolution de la couleur et de la morphologie des fleurs par un mécanisme de coévolution. Il est possible, sur des critères paléontologiques de reconstituer cette histoire évolutive et plusieurs hypothèses tendent à l'expliquer en proposant un "archétype angiospermien".
À une autre échelle, l'Homme a aussi joué un rôle important dans cette histoire évolutive et représente une force évolutive non négligeable, pouvant être apparenté à une forme de mutualisme[1] - [2].
À la recherche de la fleur ancestrale
"L’archétype angiospermien" est une hypothèse qui décrit la fleur primitive comme simple, nue et imparfaite, constituant des inflorescences plus ou moins enrichies en bractées. Les relations phylogénétiques entre les différents groupes d'angiospermes étant mal connues, la recherche de l'angiosperme primif oppose plusieurs hypothèses présentées ci-dessous.
Fleur des paléoherbes
Des analyses cladistiques basées sur la morphologie, combinées à des séquences D’ADN, ont fortement remis en question cette hypothèse et place les paléoherbes (monocotylédones, Nymphaeales, Piperales, Aristolochiales) en groupe frère des autres taxons. La fleur primitive devrait ressembler à celle des monocotylédones, c’est-à-dire trimère, bisexuée, périanthée, à 6 étamines bien différenciées en anthère et filet et à carpelles contenant plusieurs ovules anatropes à placentation marginale[3].
Grande fleur strobiloïde de type magnolia
Certaines études basées sur des découvertes fossiles, ont permis la création de cladogrammes montrant les magnoliales comme groupe frère des autres taxons, attesté par le caractère plésiomorphe des anthères laminaires, ou les grains de pollen à exine sans columelle. Cette fleur serait grande, complexe et composée de nombreuses parties séparées.
Fleur de type Amborella
Amborella pourrait permettre de mieux comprendre les transitions qui se sont opérées entre angiospermes et son groupe ancestral des gymnospermes.
La classification APG III place Amborella en groupe frère des autres taxons. Cette plante présente des caractères très particuliers : la fleur est fonctionnellement unisexuée mais porte les deux sexes. La fleur mâle porte seulement des étamines, dont les sacs polliniques ressemblent fortement à ceux des cônes mâles des conifères. Amborella possède aussi des fleurs qui semblent être hermaphrodites portant à la fois des carpelles et des étamines, bien que ces derniers soient stériles. La fleur présente une continuité morphologique entre les bractées et le périanthe.
Dans cette dernière classification les lignées basales dont Amborella fait partie sont caractérisées par une angiospermie imparfaite : les carpelles sont libres, ascidiformes, stipités, soudés dans la partie supérieure par sécrétion et non par un épiderme.Ces lignées regroupent aussi les plésiomorphies suivantes : petites fleurs homoïochlamydes (les 2 verticilles sont difficilement identifiables) à nombre de tépales, d'étamines et de carpelles peu élevé[4].
Des découvertes récentes bouleversent notre vision actuelle de l'évolution des fleurs
Le plus vieux fossile de fleur retrouvé est estimé vieux de 160 millions d'années, ce qui correspond à l’ère du jurassique. Ce fossile a été appelé "Euanthus panii", sa fleur serait minuscule (12 mm de largeur par 12 mm de longueur), et présenterait des traits dérivés des angiospermes. Elle porte les pièces mâles et femelles comme les sépales, l’anthère et un stigmate avec une surface réceptive pour le pollen, ses pétales sont arrangés comme ceux du lys (Liliopsida) ou du pavot (Ranunculales). Cette fleur affiche cependant un caractère unique dans le clade des angiospermes : une anthère à 4 parties qui contient des grains de pollen[5].
La découverte de grains de pollen datant de 247.2 – 242.0 millions d'années dans le nord de la Suisse, dont les caractéristiques sont très proche des grains de pollen d'angiosperme retrouvés datant du crétacé inférieur, sont des indices qui font remonter la période d'apparition des plantes à fleurs au trias[6].
Évolution de la morphologie florale
La fleur comprend les éléments reproducteurs mâle (androcée) et/ou femelle (pistil) de la plante et les éléments stériles qui les protègent (périanthe). Les différentes glaciations et réchauffements successifs, la formation des mers et des montagnes ont isolé les plantes dans des climats différents en présence de pollinisateurs différents et ont conduit à leur diversification morphologique.
Évolution du pollen
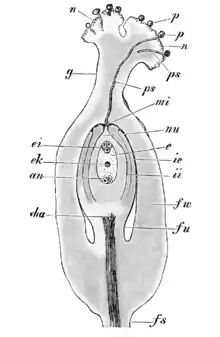

L'évolution du pollen peut permettre d'appréhender l'évolution des angiospermes[7] : l'aperture correspond à la zone de fragilité de l'enveloppe du grain de pollen permettant la germination du tube pollinique.
lors de la fécondation. Le caractère monoaperturé (ou monosulqué) est considéré comme ancestral. Les espèces monoaperturés, à fleurs trimères (monocotylédones et paléodicotylédones) seraient primitives.
Et au contraire les espèces dites supérieures (eudicotylédones : rosidae, asteridae) regroupent des caractères dérivés : elles sont triaperturées (trois apertures) à fleurs tétra ou pentamères. Elles sont apparues plus récemment. Il existe une compétition entre les grains de pollen de même espèce au moment du contact avec le pistil : plusieurs grains peuvent commencer à creuser un tube pollinique mais le premier à descendre empêche les autres de continuer et c'est lui qui ira féconder l'ovule. Être polyaperturé donne plus de chance d'avoir l'aperture du côté de la zone de contact et donc d'être le premier à creuser.
L'ontogenèse du type apertural varie chez les monocotylédones et est plus conservée chez les eudicotylédones[8], ce qui appuie leur apparition plus récente (moins de temps pour évoluer).
Évolution du carpelle
La morphologie du carpelle, organe typique des angiospermes contenant les ovules, pourrait provenir de l'évolution des feuilles portant les gamètes des plantes ancestrales. Les limbes foliaires se seraient pliées longitudinalement, les poils superficiels alors retrouvés sur la face interne recevant le pollen. Ils auraient ainsi donné les stigmates et le style, puis le carpelle fusionnant en hauteur, le pistil[9]. Sa localisation par rapport au pédoncule floral a également subi des évolutions, celles-ci tendent du supère vers l'infère : l'invagination de l'ovaire sous le pédoncule est un caractère dérivé.
Évolution de la symétrie florale

L'évolution de la symétrie de l'inflorescence induit des changements morphologiques plus visibles. On observe une stratégie évolutive d'une symétrie radiaire ancestrale vers une symétrie bilatérale chez de nombreux groupes avancés comme les orchidées. Cette symétrie est apparue plusieurs fois indépendamment au cours de l’évolution, dans des groupes de plantes sans lien de parenté direct. Les gènes de différenciation dorso-ventrale du lotier sont homologues à des gènes présents chez la fleur de gueule de loup mais qui n'y interviennent pas pour la symétrie. Pourtant leurs architectures florales sont semblables[10].
Dans certaines lignées, des pièces florales ont fusionné (concrescence) ou disparu. On utilise des diagrammes floraux empiriques et théoriques pour représenter ces évolutions morphologiques. Ces évolutions sont liées au type de fécondation : par exemple, les posidonies[11] qui ne possèdent plus de pétales, fleurissent sous l'eau et ont donc une pollinisation hydrophile.
L’attractivité des pollinisateurs facteur de diversité morphologique
Certaines fleurs sont dotées d'attracteurs visuels ou olfactifs hautement spécialisés pour attirer les pollinisateurs (cf syndrome de pollinisation). Ces stratégies d'attraction sont portées par des modifications morphologiques. Par exemple, les Hyménoptères perçoivent entre autres les variations d'intensité lumineuse, autrement dit les formes, et sont particulièrement attirés par les figures à haute fréquence spatiale (étoilées). Mais toutes les fleurs ne sont pas étoilées : la Sélection Naturelle a retenu d'autres stratégies.
Chaleur
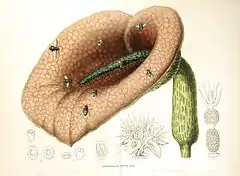
Certaines fleurs comme celles des Aracées possèdent un organe chauffant stérile de forme allongée, le spadice. Cette évolution morphologique de l'inflorescence attire des insectes pollinisateurs endotherme ou nécrophages. Ainsi, le spadice de Philodendron solimoesence, dans les régions tropicales, diffuse de la chaleur qui permet à ses pollinisateurs d'économiser leur énergie tandis qu'il s'activent dans la chambre florale[12]. Un autre exemple est celui de l'arum mange-mouches (Helicodiceros muscivorus) dont le spadice diffuse chaleur et odeur de cadavre en décomposition pour mener les mouches dans l'antre de la fleur[13] où elles s’imprègnent du pollen ou le déposent sur les stigmates. Cette même morphologie en spadice a été sélectionnée dans des zones froides chez le chou puant du Canada qui perce la neige pour fleurir en janvier.
Odeur

La morphologie de la fleur contribue à l'attraction par les phéromones, par exemple chez les plantes entomophiles comme l'orchidée : le labelle peut porter des osmophores qui prennent la forme d'une masse de papilles saillantes pour mimer l'individu femelle du pollinisateur cible. Le pollinisateur s'y pose, et suit le gradient olfactif qui converge vers le centre fertile tandis que les autres pièces florales forment une caverne étroite autour de l'insecte pour maximiser les occasions de contact avec les pollinies[14].
Pièces mobiles
Toujours pour faciliter la pollinisation, on peut observer des éléments morphologiques mobiles. Les étamines de fleurs en cloche, par exemple, se rabattent sur le dos de l’hyménoptère qui butine pour y déposer le pollen. Il ira ensuite féconder le pistil de la fleur suivante. Certaines orchidées piègent physiquement l'insecte une fois qu'il a été attiré sur la fleur. Il est volontairement confiné dans l'espace floral afin qu'il se débatte en présence des pièces fertiles. Il est ensuite libéré et ira polliniser les autres individus de l'espèce[14].
Ces adaptations morphologiques très spécialisées peuvent s'expliquer par la coévolution des plantes et de leur pollinisateurs.
La théorie du syndrome pollinisateur
Un moteur d'évolution des traits floraux (couleur, morphologie, odeur ou la composition de son nectar) repose sur la dépendance de certaines plantes à fleurs à des vecteurs de pollinisation. Ces derniers peuvent être biotiques (oiseaux, insectes...) ou abiotiques (vent, eau). Ce mécanisme s'applique d'autant plus dans le cas des plantes dioïques, monoïques, et hermaphrodites auto incompatibles. En effet, pour ces plantes effectuant la pollinisation croisée, le transport du pollen vers une autre fleur est dépendant de ces vecteurs de pollinisation. Dans le cas des plantes auto-compatibles, réalisant l'autogamie comme le blé, l'évolution des traits floraux dépend moins des pollinisateurs[15].
On observe donc diverses adaptations pour attirer ces agents pollinisateurs qui peuvent aller jusqu'à un mutualisme obligatoire pour la fleur, car elle ne peut plus être pollinisée que par le pollinisateur auquel elle s'est spécialisée. Pour cela, le pollinisateur doit recevoir un gain. La fleur peut lui offrir de quoi se nourrir (pollen, nectar), un lieu de ponte optimal, ou un leurre (alimentaire, sexuel).
De manière générale, on peut retrouver des traits communs chez les fleurs pollinisées par les mêmes animaux. Il est possible de créer des groupes de plantes associées à un même pollinisateur. Ainsi, les fleurs pollinisées par les abeilles (mélittophilie) ont souvent tendance à être de couleur jaune ou bleue (pour lesquelles la perception visuelle des hyménoptères est la plus importante[16]). Celles pollinisées par les papillons (psychophilie) ont tendance à être grandes, de couleur rose ou bleu lavande, avec une "aire d'atterrissage" et généralement parfumées. En revanche celles pollinisées par le vent sont souvent petites, vertes et peu voyantes.
Une fleur qui a un ensemble de traits correspondant à un groupe de pollinisateur ne va pas pour autant exclure la visite de pollinisateurs moins efficaces, qui jouent aussi un rôle dans l'évolution de ces fleurs. Cependant, de par leur morphologie ou leur couleur, il est possible qu'elles n’attirent pas, ou excluent un groupe de pollinisateurs. Par exemple, les fleurs pollinisées par des chiroptères ont des étamines déployées, qui permettent la pollinisation par les oiseaux mais pas par les abeilles[17].
On observe, notamment chez les orchidées, un grand nombre de leurres sexuels ou alimentaires.
.jpg.webp)


Les traits floraux résultent donc de la sélection engendrée par le pollinisateur visitant le plus souvent et le plus efficacement la plante mais les pollinisateurs secondaires jouent aussi un rôle dans l'évolution de ces traits. C'est le principe évoqué par Stebbins : « le moteur principal d'une évolution convergente de plusieurs traits floraux correspond à une adaptation au groupe de pollinisateurs le plus efficace » . Le second pollinisateur associé à une plante correspond souvent au groupe pollinisateur ancestral. Il appartiendrait à un groupe apparu plus précocement que le pollinisateur primaire. Par exemple, le principal pollinisateur secondaire des plantes pollinisées par les oiseaux sont les abeilles. Leur origine étant datée du milieu du crétacé et les colibris de l’éocène, donc plus récent, cela coïncide bien avec cette théorie. Cela suggère que les transitions de groupes pollinisateurs à un autre au fil de leurs apparitions pourraient être un modèle de l'histoire évolutive des angiospermes[18].
Les traits floraux de la plupart des plantes ont un potentiel d'adaptation à de nouvelles conditions en changeant de pollinisateur[19]. Ces changements dans le système pollinisateur d'une plante peuvent arriver très rapidement à la suite d'une mutation. Ainsi, on a démontré que la substitution d'un allèle entraînant le changement de couleur d'une fleur résulte en un changement de pollinisateur, qui exerce une nouvelle force évolutive sur la plante[20]. Ainsi, dans le contexte actuel de changement climatique, une diminution d'un pollinisateur causée par des activités humaines par exemple, peut entraîner un changement vers un pollinisateur moins vulnérable, avec des conséquences évolutives sur la plantes[21].
Les limites de la théorie
Il faut cependant faire attention lors de l'utilisation du syndrome pollinisateur pour prédire l'organisation de la diversité morphologique et de la couleur des fleurs, car dans deux cas sur trois, le pollinisateur le plus commun d'une fleur ne peut pas être prédit grâce à cette théorie[22].
Ainsi, dans le cas du lotus Nelumbo nucifera (qui est une espèce protogyne dont on pourrait bien prédire le pollinisateur grâce au syndrome pollinisateur), le syndrome pollinisateur prédit que des coléoptères seraient les pollinisateurs majeurs de cette fleur. Une étude a montré que dans deux populations naturelles, c'était des mouches (diptères) et des abeilles (hyménoptères) qui visitaient le plus fréquemment cette fleur. Pourtant, dans une population sauvage ainsi qu'en laboratoire, le coléoptère était bien le pollinisateur le plus efficace[23].
Malgré le débat mettant en jeu la fiabilité de cette théorie, de nombreux auteurs l'utilisent pour proposer des mécanismes évolutifs concernant des plantes dont on ne connait parfois même pas les pollinisateurs[24].
Évolution de la couleur
La sélection du trait 'couleur de la fleur' peut se faire soit directement car ce trait améliore la valeur sélective (aussi appelée fitness) de la plante. C’est le cas notamment des fleurs blanches qui attirent plus les abeilles que les fleurs rouges. Soit indirectement via la sélection d’un autre trait bénéfique pour la fitness de la plante. Dans ce cas, le trait 'couleur de la fleur' peut ne pas présenter d’avantage en termes de fitness. Cette sélection indirecte est due à un effet pléiotrope[25],
Effet pléiotrope
Un effet pléiotrope se produit lorsqu’une seule mutation sur un gène a des conséquences sur plusieurs traits phénotypiques.
Par exemple, une étude sur le radis sauvage menée par Irwin et al. a montré un lien entre le gène codant la production d'anthocyanines (pigment responsable de la couleur rose dans les pétales) et celui codant la production d’indole glucosinolate (une molécule, produite en réponse à l’herbivorie, qui dissuade les consommateurs de la plante de la manger à nouveau). Les principaux pollinisateurs du radis sont de la famille des hyménoptères. Cela explique la conservation du phénotype couleur de la fleur rose dans la population. En effet les individus de phénotype blanc gagnent en fitness grâce à une meilleure pollinisation (préférence du blanc par les pollinisateurs comme décrit dans le syndrome pollinisateur), mais les individus de phénotype rose gagnent aussi en fitness car ils sont moins mangés[26].
Un autre exemple d'effet pléiotrope est celui de certaines espèces de bourdons insulaires (Bombus occidentalis par exemple) qui ont développé des photorécepteurs détectant dans une certaine mesure le rouge[27]. L’hypothèse principale est qu’en milieu insulaire la dérive génétique est plus forte. Ainsi la sélection du caractère « préférence des bourdons pour la couleur rouge » est favorisée et parallèlement le trait 'couleur rouge' chez les fleurs est favorisé lui aussi. Cette sélection se serait fait non pas parce que le trait couleur rouge apporte un avantage évolutif mais plutôt parce que ce trait n’est pas contre sélectionné (il n’apporte pas de désavantage évolutif)[28].
La pigmentation : la voie de synthèse des flavonoïdes
Il a été montré que les mutations cis-régulateurs interviennent plus fréquemment dans l’apparition de traits morphologiques différents entre espèces. Certaines mutations vont apparaître plus fréquemment au sein du génome (on parle de biais de mutation) et ainsi avoir une probabilité d’être sélectionnées plus élevée (biais de fixation) [29].
Lorsque l’on s’intéresse à la couleur des fleurs, on observe que les mutations à l’origine des différents phénotypes morphologiques sont, en forte proportion, des mutations cis-régulateur.
Parmi les angiospermes, les pigments les plus communs à l’origine de la couleur bleue, rouge, violette sont les anthocyanines. La voie de synthèse des flavonoïdes responsable de la production de ces pigments est bien conservée au sein du groupe[30] - [31]. On peut ainsi observer que la variation de la couleur chez les fleurs est due soit à une diminution de la quantité de pigment allouée dans les pétales : les fleurs dépourvues de pigment sont jaunes ou blanches. Soit au changement du type d’anthocyanines, par exemple pour passer du rouge au bleu. Le changement du type d’anthocyanines se fait via la voie de synthèse des flavonoïdes, la production du pigment, arrêtée à différentes étapes, pouvant donner différentes couleurs[29].
De nombreuses Angiospermes changent de couleur une fois pollinisées afin d’avertir les futurs pollinisateurs. Ainsi un plus grand nombre de fleurs peut être visité ce qui présente un avantage en termes de fitness pour la fleur[28].
L'Homme: une importante force évolutive
La domestication

La domestication intervient comme un processus rapide de sélection. C'est un processus évolutif complexe dans lequel l’utilisation d’espèces animales et végétales conduit à des changements morphologiques et physiologiques, entraînant une différenciation entre le taxon domestiqué et l’ancêtre sauvage[32].
La prolifération des espèces cultivées par l'homme atteste de l'augmentation de la valeur sélective ou "fitness" de ces organismes domestiqués. La domestication est donc un mécanisme efficace de mutualisme plante-animal[33]. Plus de 160 familles de plantes ont été domestiquées, principalement chez les monocotylédones et dicotylédones [34]. L’Homme a ainsi joué un rôle important dans l'équilibrage des ressources allouées à différents traits (trade-off).
Par exemple le brocoli (Brassica oleracea var. italica) provient d’une domestication du chou commun (Brassica oleracea)[35]. Sa part des ressources allouée à la reproduction est supérieure à celle du chou. Pour contre-balancer l'équilibre, celle allouée à sa survie est diminuée[36].

Le brocoli a été sélectionné à des fins agricoles alors que certaines fleurs ont été domestiquées à des fins esthétiques.
La couleur des fleurs peut être génétiquement modifiée. Par exemple, les roses ne produisent pas le delphinidine, qui est le pigment végétal à l’origine des fleurs bleues. En 2004, deux sociétés australienne et japonaise ont réussi à cloner le gène codant la synthèse de ce pigment et à l'insérer dans un rosier pour obtenir une rose bleue.
Changements environnementaux
Les changements de l’environnement causés par l’Homme, caractérisés par exemple par la perturbation du climat, le retrait et/ou l'ajout de prédateurs ou d’agents pathogènes, peuvent aussi avoir un impact sur l'évolution et la biodiversité des fleurs. Par ces changements, l’Homme contribue à la variation de la biodiversité avec une forme de sélection non naturelle[37].
Fragmentation des habitats
La fragmentation éco-paysagère due principalement à l'expansion des zones urbaines est un exemple de modification de l'environnement. On observe un effet global négatif de la fragmentation sur la reproduction sexuée des plantes à fleurs et sur les pollinisateurs impliqués. La dépendance à la pollinisation mutualiste des plantes allogames rend leur succès reproducteur plus vulnérable que celui des plantes autogames : la fragmentation de l’habitat peut modifier la richesse, la composition, l’abondance et/ou le comportement des pollinisateurs, ainsi que la disponibilité d’autres plantes de la même espèce pour la reproduction sexuée. Tous ces changements peuvent limiter la quantité de pollen compatible déposée sur les stigmates et modifier le processus de pollinisation[38].
Néanmoins, le degré de spécialisation de la pollinisation n’est pas pertinent pour identifier un effet de la fragmentation de l’habitat sur la reproduction des fleurs. En effet, les plantes généralistes ne sont pas favorisées par rapport aux espèces spécialistes[38].
Autofécondation chez les plantes
La plupart des fleurs sont mutualistes avec les insectes pollinisateurs. Mais il existe d’autres stratégies comme l’autofécondation (ou l'autopollinisation). Ce mécanisme reproductif est observé lors de la fécondation d'un ovule par du pollen issu de la même plante. On remarque souvent une grande proximité ou un contact direct entre les stigmates (organes femelles) et les étamines (organes mâles). Une évolution d’adaptation de la morphologie est aussi observée : ces fleurs s'ouvrent peu, voire pas du tout[39].
L'autofécondation est un mécanisme naturel chez les plantes de type autogame comme le blé, l’orge ou le pois. Dans ces fleurs, on retrouve les organes mâles et femelles (elles sont hermaphrodites) et la maturité des gamètes est simultanée. Ces espèces sont homozygotes pour l'ensemble de leur génome : ce sont des lignées pures[39].
Conserver les caractères spécifiques d'une fleur d'une génération à l’autre présente des intérêts économiques à la suite de la création de nouvelles variétés. L'Homme a donc appliqué l’autofécondation préexistante dans la nature pour créer des lignées pures de fleurs de type allogame, qui ne pratiquent pas l'autofécondation naturellement.
Cette pratique est facilement réalisable sur les plants de maïs car les inflorescences males et femelles sont séparées. Les inflorescences femelles sont recouvertes d'un sachet pour éviter tout contact avec un pollen étranger. Le pollen des inflorescences mâles du même pied est ensuite recueilli pour être apporté aux inflorescences femelles. On conserve ainsi les caractères du maïs sélectionné d’une génération à l’autre[39].
Il y a un avantage certain pour l’agriculteur, mais ce procédé limite le brassage génétique. Une fois les phénotypes d'intérêt réunis dans une lignée pure, l’évolution de la variété est stoppée.
Notes et références
- Aurélie Vialette-Guiraud et Michiel Vandenbussche, « Evolution et développement de la fleur », Biologie Aujourd’hui, vol. 206, (lire en ligne).
- (en) Michael D. Purugganan et Dorian Q. Fuller, « The nature of selection during plant domestication », Nature, vol. 457, (lire en ligne).
- (en) David Winship Taylor et Leo J. Hickey, « Phylogenetic evidence for the herbaceous origin of angiosperms », Plant Systematics and Evolution, vol. 180, (lire en ligne)
- (en) Richard M. Bateman, Jason Hilton et Paula J. Rudall, « Morphological and molecular phylogenetic context of the angiosperms: contrasting the ‘top-down’ and ‘bottom-up’ approaches used to infer the likely characteristics of the first flowers », Journal of Experimental Botany, (lire en ligne).
- (en) Becky Oskin et Senior Writer, « Controversy Blooms Over Earliest Flower Fossil », Live Science, (lire en ligne).
- (en) Peter A. Hochuli et Susanne Feist-Burkhardt, « Angiosperm-like pollen and Afropollis from the Middle Triassic (Anisian) of the Germanic Basin (Northern Switzerland) », Frontiers in Plant Science, (lire en ligne).
- Peter Andreas Hochuli et Susanne Feist-Burkhardt, « Angiosperm-like pollen and Afropollis from the Middle Triassic (Anisian) of the Germanic Basin (Northern Switzerland) », Plant Evolution and Development, vol. 4, , p. 344 (PMID 24106492, PMCID 3788615, DOI 10.3389/fpls.2013.00344, lire en ligne, consulté le )
- Thèses de L. Penet 2004 et de Julie Sannier 2006, Penet et al. 2005, Ressayre et al. 2005, Nadot et al. 2006, Sannier et al. 2006, Sannier et al. 2007
- (en) Raven Johnson Mason Losos Singer, Biology, 9th edition, , chap. 42 p.481
- Études du professeur Da Luo, Institute of Plant Physiology and Ecology, Shanghai, 2006
- posidonies
- (en) R.SEYMOUR et al., « The rôle of thermogenesis in the pollination biology of the amazon waterlily Victoria amazonica », Annals of Botany, no vol 98, , p.1129-1135
- (en) R.SEYMOUR et al., « Thermogenesis and respiration of inflorescences of the dead horse arum Helicodiceros muscivorus, a pseudo-thermoregulatory aroid associated with fly pollination », Fonctional Ecology, no vol 17, , p.886-894
- (en) B.BOHMAN et al., « The discovery of 2-hydroxymethyl-3(3-methylbutyl)-5-methylpyrazine: a semiochemical in orchid pollination », Org. Lett., no Vol14, , p.2576-2578
- (en) Víctor Rosas-Guerrero, Ramiro Aguilar, Silvana Martén-Rodríguez, Lorena Ashworth, Martha Lopezaraiza-Mikel, Jesús M. Bastida et Mauricio Quesada, « A quantitative review of pollination syndromes: do floral traits predict effective pollinators? », Ecology Letters, vol. 17, no 3, , p. 388-400 (lire en ligne).
- « FReD - Floral Reflectance Database », sur www.reflectance.co.uk (consulté le )
- (en) Silvana Martén-Rodríguez, Abel Almarales-Castro et Charles B. Fenster, « Evaluation of pollination syndromes in Antillean Gesneriaceae: evidence for bat, hummingbird and generalized flowers », Journal of Ecology, vol. 97, no 2, , p. 348-359 (lire en ligne).
- (en) Víctor Rosas-Guerrero, Ramiro Aguilar, Silvana Martén-Rodríguez, Lorena Ashworth, Martha Lopezaraiza-Mikel, Jesús M. Bastida et Mauricio Quesada, « A quantitative review of pollination syndromes: do floral traits predict effective pollinators? », Ecology Letters, vol. 17, no 3, , p. 388-400 (lire en ligne)
- (en) Kathleen M. Kay, Patrick A. Reeves, Richard G. Olmstead et Douglas W. Schemske, « Rapid speciation and the evolution of hummingbird pollination in neotropical Costus subgenus Costus (Costaceae): evidence from nrDNA ITS and ETS sequences », American Journal of Botany, vol. 92, (lire en ligne).
- (en) H. D. Bradshaw et Douglas W. Schemske, « Allele substitution at a flower colour locus produces a pollinator shift in monkeyflowers », Nature, vol. 426, (lire en ligne)
- (en) Ramiro Aguilar, Lorena Ashworth, Leonardo Galetto et Marcelo Adrián Aizen, « Plant reproductive susceptibility to habitat fragmentation: review and synthesis through a meta-analysis », Ecology Letters, vol. 9, (lire en ligne).
- (en) Jeff Ollerton, Ruben Alarcón, Nickolas M. Waser, Mary V. Price, Stella Watts, Louise Cranmer, Andrew Hingston, Craig I. Peter et John Rotenberry, « A global test of the pollination syndrome hypothesis », Annals of botany, vol. 103, (lire en ligne).
- (en) Jiao-Kun Li et Shuang-Quan Huang, « Effective pollinators of Asian sacred lotus (Nelumbo nucifera): contemporary pollinators may not reflect the historical pollination syndrome », Annals of Botany, vol. 104, (lire en ligne).
- (en) Isabel Cristina Machado et Ariadna Valentina Lopes, « Floral Traits and Pollination Systems in the Caatinga, a Brazilian Tropical Dry Forest », Annals of Botany, vol. 97, (lire en ligne).
- (en) Mark D. Rausher, « Evolutionary transitions in floral color », International Journal of Plant Sciences, vol. 169, (lire en ligne).
- (en) Rebecca E. Irwin, « THE ROLE OF HERBIVORES IN THE MAINTENANCE OF A FLOWER COLOR POLYMORPHISM IN WILD RADISH », Ecology, vol. 84, (lire en ligne).
- (en) Lars Chittka et Nikolas M. Waser, « Why red flowers are not invisible to bees », Israel Journal of Plant Sciences, vol. 45, (lire en ligne).
- (en) Adriana D. Briscoe et Lars Chittka, « The Evolution of Color Vision In Insects », Annual Review of Entomology, vol. 46, (lire en ligne).
- (en) Matthew A. Streisfeld et Mark D. Rausher, « POPULATION GENETICS, PLEIOTROPY, AND THE PREFERENTIAL FIXATION OF MUTATIONS DURING ADAPTIVE EVOLUTION », Evolution, vol. 65, (lire en ligne).
- (en) TA Holton et AC Cornish, « Genetics and Biochemistry of Anthocyanin Biosynthesis », Plant Cell, vol. 7, (lire en ligne)
- (en) Winkel-Shirley, « Flavonoid Biosynthesis. A Colorful Model for Genetics, Biochemistry, Cell Biology, and Biotechnology », Plant Physiology, vol. 126,
- (en) J. F. HANCOCK, « Contributions of Domesticated Plant Studies to our Understanding of Plant Evolution », Annals of Botany, vol. 96, , p. 953-963 (PMID 16159942, PMCID 4247096, DOI 10.1093/aob/mci259, lire en ligne, consulté le )
- (en) Michael D. Purugganan et Dorian Q. Fuller, « The nature of selection during plant domestication », Nature, vol. 457, (lire en ligne).
- (en) Rachel S. Meyer et Michael D. Purugganan, « Evolution of crop species: genetics of domestication and diversification », Nature Reviews Genetics, vol. 14, (lire en ligne).
- (en) Jared Diamond, « Evolution, consequences and future of plant and animal domestication », Nature, vol. 418, , p. 700-707 (ISSN 0028-0836, DOI 10.1038/nature01019, lire en ligne, consulté le )
- (en) Shyam Prakash, Xiaoming Wu et Shripad Bhat, « History, Evolution, and Domestication of Brassica Crops », Plant Breeding Reviews, vol. 35, (lire en ligne).
- (en) David Tilman et Clarence Lehman, « Human-caused environmental change: Impacts on plant diversity and evolution », Proceedings of the National Academy of Sciences, vol. 98, , p. 5433-5440 (ISSN 0027-8424 et 1091-6490, PMID 11344290, PMCID 33230, DOI 10.1073/pnas.091093198, lire en ligne, consulté le )
- (en) Ramiro Aguilar, Lorena Ashworth, Leonardo Galetto et Marcelo Adrián Aizen, « Plant reproductive susceptibility to habitat fragmentation: review and synthesis through a meta-analysis », Ecology Letters, vol. 9, , p. 968-980 (ISSN 1461-0248, DOI 10.1111/j.1461-0248.2006.00927.x, lire en ligne, consulté le )
- « autofécondation », sur www.gnis-pedagogie.org (consulté le )