Triphosphate de sodium
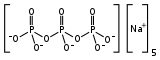
Le triphosphate de sodium (STP), également appelé tripolyphosphate de sodium[2], est un composé inorganique de formule Na5P3O10. C'est le sel de sodium du polyphosphate penta-anion, qui est la base conjuguée de l'acide triphosphorique. Il est produit à grande échelle comme composant de nombreux produits domestiques et industriels, en particulier les détergents. Des problèmes environnementaux associés à l'eutrophisation sont attribués à son utilisation répandue[3].
| Triphosphate de sodium | |
| |
| Identification | |
|---|---|
| Nom UICPA | triphosphate de pentasodium |
| No CAS | |
| No ECHA | 100.028.944 |
| No RTECS | YK4570000 |
| PubChem | 517047 |
| Apparence | Poudre blanche |
| Propriétés chimiques | |
| Formule | Na5O10P3 |
| Masse molaire[1] | 367,864 1 ± 0,003 g/mol Na 31,25 %, O 43,49 %, P 25,26 %, |
| Propriétés physiques | |
| T° fusion | 622°C |
| Solubilité | 14.5 g/100 mL (25 °C) |
| Masse volumique | 2.52 g/cm3 |
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation et propriétés
Le tripolyphosphate de sodium est produit en chauffant un mélange stœchiométrique de phosphate disodique (Na2HPO4) et de phosphate monosodique (NaH2PO4), dans des conditions contrôlées[3].
- 2 Na2HPO4 + NaH2PO4 → Na5P3O10 + 2 H2O
Environ 2 millions de tonnes sont produites annuellement[4].
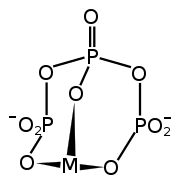
Le STPP est un sel incolore, qui existe à la fois sous forme anhydre et sous forme hexahydratée. L'anion peut être décrit comme la chaîne pentanionique [O3POP(O)2OPO3] 5−[5] - [6]. De nombreux di-, tri- et polyphosphates apparentés sont connus, y compris le triphosphate cyclique P3O93− . Il se lie fortement aux cations métalliques en tant qu'agent chélateur bidenté et tridenté .
Usages
Détergents
La majorité du STPP est consommée en tant que composant de détergents commerciaux . Il sert de «constructeur», jargon industriel pour un adoucisseur d'eau. Dans l'eau dure (eau qui contient de fortes concentrations de Mg 2+ et/ou de Ca 2+ ), les détergents sont désactivés. Étant un agent chélatant hautement chargé, le TPP 5− se lie fortement aux dications et les empêche d'interférer avec le détergent à base de sulfonate[4].
Aliments
Le STPP est un conservateur pour les fruits de mer, les viandes, la volaille et les aliments pour animaux[4]. Il est courant dans la production alimentaire sous le numéro E E451 . Dans les aliments, le STPP est utilisé comme émulsifiant et pour retenir l'humidité. De nombreux gouvernements réglementent les quantités autorisées dans les aliments, car il peut augmenter considérablement le poids de vente des fruits de mer. La Food and Drug Administration des États-Unis répertorie le STPP comme étant généralement reconnu comme sûr[7].
Autre
D'autres utilisations incluent la céramique (pour diminuer la viscosité des émaux jusqu'à une certaine limite), le tannage du cuir (comme agent masquant et agent de tannage synthétique - SYNTAN), les anti- agglomérants, les retardateurs de prise, les retardateurs de flamme, le papier, pigments anticorrosion, textiles, fabrication de caoutchouc, fermentation, antigel ." [4] Le TPP est utilisé comme agent de réticulation polyanionique dans l'administration de médicaments à base de polysaccharides[8] ainsi que dans le dentifrice[9] - [10] - [11] - [12] - [13] - [14] - [15].
Effets sur la santé
Une concentration élevée de phosphate sérique a été identifiée comme un facteur prédictif d'événements cardiovasculaires et de mortalité. Alors que le phosphate est présent dans le corps et les aliments sous des formes organiques, les formes inorganiques de phosphate telles que le triphosphate de sodium sont facilement adsorbées et peuvent entraîner des niveaux élevés de phosphate dans le sérum[16]. Les sels d'anions polyphosphates sont modérément irritants pour la peau et les muqueuses car ils sont légèrement alcalins[17].
Effets environnementaux
Parce qu'il est très soluble dans l'eau, le STPP n'est pas éliminé de manière significative par le traitement des eaux usées . Le STPP s'hydrolyse en phosphate, qui est assimilé au cycle naturel du phosphore . Les détergents contenant du phosphore contribuent à l' eutrophisation de nombreuses eaux douces[18].

Voir aussi
- Trimétaphosphate de sodium, un triphosphate cyclique
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Complexing agents, Environmental and Health Assessment of Substances in Household Detergents and Cosmetic Detergent Products,Danish Environmental Protection Agency, Accessed 2008-07-15
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 0080379419)
- Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Klein et Hofmann, Ullmann's Encyclopedia of Industrial Chemistry, (ISBN 978-3527306732, DOI 10.1002/14356007.a19_465.pub3), « Phosphoric Acid and Phosphates »
- Corbridge, « The crystal structure of sodium triphosphate, Na5P3O10, phase I », Acta Crystallographica, vol. 13, no 3, , p. 263–269 (DOI 10.1107/S0365110X60000583)
- Davies et Corbridge, « The crystal structure of sodium triphosphate, Na5P3O10, phase II », Acta Crystallographica, vol. 11, no 5, , p. 315–319 (DOI 10.1107/S0365110X58000876)
- « Substances Added to Food (Formerly EAFUS) »
- Calvo, Remuñán‐López, Vila-Jato et Alonso, « Novel hydrophilic chitosan-polyethylene oxide nanoparticles as protein carriers », Journal of Applied Polymer Science, vol. 63, no 1, , p. 125–132 (DOI 10.1002/(SICI)1097-4628(19970103)63:1<125::AID-APP13>3.0.CO;2-4)
- Saxton et Ouderaa, « The effect of a dentifrice containing zinc citrate and Triclosan on developing gingivitis », Journal of Periodontal Research, vol. 24, no 1, , p. 75–80 (PMID 2524573, DOI 10.1111/j.1600-0765.1989.tb00860.x)
- Lobene, Weatherford, Ross et Lamm, « A modified gingival index for use in clinical trials. », Clinical Preventive Dentistry, vol. 8, no 1, , p. 3–6 (PMID 3485495)
- Lobene, Soparkar et Newman, « Use of dental floss. Effect on plaque and gingivitis. », Clinical Preventive Dentistry, vol. 4, no 1, , p. 5–8 (PMID 6980082)
- Mankodi, Bartizek, Leslie Winston et Biesbrock, « Anti-gingivitis efficacy of a stabilized 0.454% stannous fluoride/sodium hexametaphosphate dentifrice. A controlled 6-month clinical trial », Journal of Clinical Periodontology, vol. 32, no 1, , p. 75–80 (PMID 15642062, DOI 10.1111/j.1600-051X.2004.00639.x)
- Mankodi, Petrone, Battista et Petrone, « Clinical efficacy of an optimized stannous fluoride dentifrice, Part 2: A 6-month plaque/gingivitis clinical study, northeast USA. », Compendium of Continuing Education in Dentistry, vol. 18 Spec No, , p. 10–5 (PMID 12206029)
- Mallatt, Mankodi, Bauroth et Bsoul, « A controlled 6-month clinical trial to study the effects of a stannous fluoride dentifrice on gingivitis », Journal of Clinical Periodontology, vol. 34, no 9, , p. 762–767 (PMID 17645550, DOI 10.1111/j.1600-051X.2007.01109.x)
- Lang, « Epidemiology of periodontal disease », Archives of Oral Biology, vol. 35, , S9–S14 (PMID 2088238, DOI 10.1016/0003-9969(90)90125-t)
- Ritz, Hahn, Ketteler et Kuhlmann, « Phosphate Additives in Food—a Health Risk », Deutsches Ärzteblatt International, vol. 109, no 4, , p. 49–55 (PMID 22334826, PMCID 3278747, DOI 10.3238/arztebl.2012.0049)
- Complexing agents, Environmental and Health Assessment of Substances in Household Detergents and Cosmetic Detergent Products, Danish Environmental Protection Agency, Accessed 2008-07-15.
- Complexing agents, Environmental and Health Assessment of Substances in Household Detergents and Cosmetic Detergent Products, Danish Environmental Protection Agency, Accessed 2008-07-15