Système ABO
Le système ABO est le premier système de groupes sanguins, découvert en 1900-1901. Il constitue, avec le système Rhésus, un des deux principaux systèmes de groupage à la base de la sécurité des transfusions sanguines. Le terme « ABO » est une combinaison des trois lettres utilisées pour définir les trois groupes sanguins initialement décrits dans ce système : A, B et O, auxquels s'est ensuite ajouté le groupe AB. Au milieu du XXe siècle, il a été découvert que les sites antigéniques reconnus par les anticorps anti-A et anti-B étaient constitués de quelques sucres simples situés à l'extrémité d'oligosaccharides portées par des protéines (glycoprotéines) ou des céramides (glycosphingolipides). Les antigènes A et B ne sont donc pas les produits primaires de l'expression des gènes comme peuvent l'être les antigènes purement protéiques. Leur synthèse dépend l'activité d'enzymes spécifiques, une N-acétyl-galactosaminyltransférase (synthétisant l'antigène A) et une galactosyltransférase (synthétisant l'antigène B). Ces deux glycosyltransférases sont synthétisées par des allèles d'un même gène. Il existe aussi un allèle silencieux entraînant l'absence d'antigène A ou B et l'existence du groupe O. L'identification du gène A et de ses variants a permis d'éclairer la génétique du système ABO et d'expliquer l'existence de groupes rares découverts expérimentalement.
| Groupes Rhésus | Groupes ABO | ||||
|---|---|---|---|---|---|
| O | A | B | AB | Total | |
| Rh+ | 36% | 37% | 9% | 3% | 85% |
| Rh- | 6% | 7% | 1% | 1% | 15% |
| Total | 42% | 44% | 10% | 4% | 100% |
| *Voir en fin d'article la répartition dans les autres pays. | |||||
Transfusion sanguine et système ABO
Découverte
Au début du XXe siècle, Karl Landsteiner a tenté d'expliquer pourquoi certaines transfusions homologues (inter-humaines) étaient couronnées de succès, alors que d'autres conduisaient à des catastrophes. La science médicale savait depuis quelques années que les transfusions hétérologues (de l'animal à l'Homme) conduisaient à des accidents et à une hémolyse des érythrocytes transfusés.
C'est en faisant réagir le sérum de chacun de six de ses collaborateurs vis-à-vis des globules rouges de leurs cinq autres collègues que Landsteiner a remarqué, en 1900, que dans certains cas, les globules rouges se rassemblaient en paquets au lieu de rester en suspension dans le sérum.
Il a alors fait l'hypothèse que les globules rouges qui étaient agglutinés possédaient à leur surface une substance qu'il a appelée agglutinogène, et que les sérums qui avaient la capacité d'agglutiner les globules possédaient une substance appelée agglutinine.
Il a ainsi défini trois catégories d'individus.
Ceux qui font partie du groupe sanguin maintenant appelé O, ont des globules qui ne sont jamais agglutinés, mais ont un plasma qui agglutine tous les autres globules agglutinables. O provient de l'allemand ohne (« sans »), c'est-à-dire sans agglutinogène.
Deux autres groupes, que nous appelons maintenant A et B, ont tous les deux des globules agglutinables par le sérum des sujets O, les globules rouges des sujets du premier groupe (A) étant agglutinés par le sérum des sujets appartenant au second (B), et inversement.
En 1902, deux élèves de Landsteiner, Decastello et Sturli, ont découvert un groupe dont le sérum n'agglutinait aucun groupe connu, mais dont les globules étaient agglutinés par le sérum des trois autres groupes. Il s'agissait du groupe AB, dont le sérum ne contient aucune agglutinine, et dont les globules rouges portent les deux agglutinogènes.
Karl Landsteiner a reçu le prix Nobel de Médecine en 1930 pour sa découverte du système ABO.
Depuis cette époque, la terminologie a bien changé. Nous parlons d'antigènes, et non d'agglutinogènes, et nous savons que les agglutinines sont des anticorps, appelés également immunoglobulines, car isolés des historiques « globulines », par opposition à l'« albumine ». Le terme d'agglutinines est toujours utilisé dans l'expression « recherche d'agglutinines irrégulières ».
Définition des groupes sanguins humains du système ABO
Ce système est donc défini par :
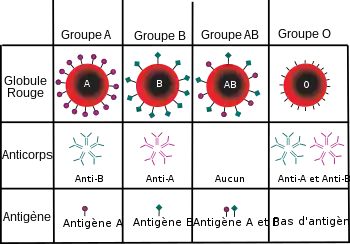
- la présence ou non d’antigènes A ou B à la surface des globules rouges. Ainsi les globules rouges du groupe sanguin A possèdent des antigènes A, ceux du groupe B des antigènes B, ceux du groupe O aucun antigène, alors que ceux du groupe AB contiennent des antigènes de type A et de type B ;
- la présence ou non d'anticorps anti-A ou anti-B dans le sérum. La présence d’antigènes d’un certain type impliquant l’absence d’anticorps de cette spécificité (sous peine de formation d’un complexe anticorps-antigènes).
Ces deux recherches, respectivement d’antigènes (épreuve de Beth-Vincent) et d’anticorps (épreuve de Simonin-Michon), sont obligatoires et doivent être concordantes pour établir un groupe sanguin ABO. Une exception toutefois chez le nouveau-né de moins de six mois dont les anticorps ne sont pas bien développés, et chez lequel ne sont donnés que des résultats non définitifs.
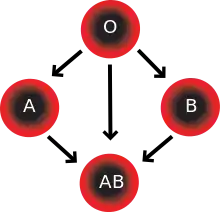
Tableau de compatibilité pour la transfusion de globules rouges
| Type du donneur | Type de sang du receveur | |||
| O | A | B | AB | |
| O | ☺ | ☺ | ☺ | ☺ |
| A | ☺ | ☺ | ||
| B | ☺ | ☺ | ||
| AB | ☺ | |||
Dans le cadre de la transfusion sanguine, les donneurs O peuvent donner aux receveurs O, A, B et AB ; les donneurs A peuvent donner aux receveurs A et AB ; les donneurs B peuvent donner aux receveurs B et AB ; les donneurs AB ne donnent qu'aux receveurs AB. Ce fait qualifie, uniquement dans le système ABO bien sûr, les donneurs O comme donneurs universels.
Inversement, les receveurs O ne peuvent recevoir que d'un donneur O ; les receveurs A, de donneurs O ou A ; les receveurs B, de donneurs O ou B ; et les receveurs AB, de donneurs O, A, B, ou AB. Ce fait qualifie, uniquement dans le système ABO bien sûr, les individus de groupe AB comme receveurs universels.
Ce tableau de compatibilité est incomplet car il faut aussi prendre en compte le système Rhésus (Rh +/-). Les opérateurs de la transfusion sanguine considèrent 8 groupes de base : O+, O-, A+, A-, B+, B-, AB+, AB-.
Nature et biosynthèse des antigènes de groupes sanguins ABO
En 1959, Winifred Watkins et Walter Morgan, chercheurs au Lister Institute of Preventive Medicine, ont constaté que les mucines (glycoprotéines) de kystes ovariens possédaient des propriétés antigéniques A. En poursuivant leurs investigations, ils ont découvert que les antigènes reconnus étaient des glucides, que la N-acétyl-galactosamine faisait partie de l'antigène A et que le galactose était impliqué dans l'antigène B. Ils ont reconnu que le fucose était aussi impliqué. Ils ont déduit la structure et proposé un mode de biosynthèse des déterminants A et B à partir d'un déterminant H[1] - [2]. Ces déterminants ont d'abord été identifiés sur les glycosphingolipides des membranes de globules rouges.
Ce n'est qu'en 1978 que Laine a montré que des antigènes A et B étaient aussi présents sur des chaînes polylactosamines portées par des glycopeptides issus de la digestion des membranes de globules rouges humains[3]. Il a par la suite montré que les glycopeptides isolés étaient issus d'une glycoprotéine appelée Bande 3[4] qui est un canal ionique très important puisqu'il est règle les échanges de l'ion HCO3− entre l'intérieur et l'extérieur des érythrocytes, c'est-à-dire le transport du CO2 des tissus vers les poumons. Les déterminants ABH sont aussi portés par les oligosaccharides de la protéine appelée Bande 4.5 qui le transporteur de glucose de l'érythrocyte.
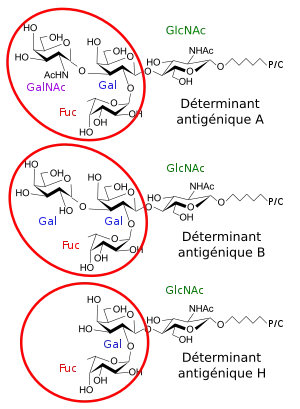
Les déterminants antigéniques ABO sont constitués des deux ou 3 glucides simples disposés à l'extrémité non réductrice des oligosaccharides portés par des glycoprotéines ou des glycolipides insérés dans la membrane des globules rouges humains. En effet les groupes sanguins ABO n'existent pas dans les autres espèces de mammifères, à l'exception des Homininae. Par contre tous les mammifères, y compris l'Homme, possèdent des déterminants antigéniques ABO exposés à la surface d'autres cellules que les globules rouges, notamment les cellules épithéliales de l'intestin, et dans des sécrétions diverses, en particulier dans la salive.

Ces déterminants sont synthétisés de façon séquentielle par des enzymes appelés glycosyltransférases qui sont spécifiques du récepteur (ce sur quoi le glucide va être ajouté), du donneur (à partir de quoi le glucide va être transféré), de la position de transfert (l'atome de carbone numéro 1, 2, 3 ou 4 sur lequel le glucide va être ajouté) et de l'anomérie de la liaison (α ou β). C'est pourquoi le nom scientifique de ces enzymes est particulièrement long. Dans le cadre de cet article, les noms abrégés courants sont utilisés.
Le motif de départ est constitué par une N-acétyl-lactosamine, Galβ1-4GlcNAc-. Le premier enzyme à intervenir est une α1-2-fucosyltransférase qui ajoute un résidu L-fucose sur le carbone 2 du D-galactose. Le motif tridimensionnel formé par le trisaccharide Fucα1-2Galβ1-4GlcNAc- constitue le déterminant antigénique dénommé H. Le déterminant H est celui qui est porté par les érythrocytes des individus de groupe sanguin O. Ce motif ne suscite l'apparition d'aucun anticorps car il est aussi présent chez les individus de groupe A ou B ou AB. Cependant il existe quelques familles extrêmement rares, dénommées Bombay, chez lesquelles le gène codant la fucosyltransférase est défectueux, ce qui entraîne l'absence d'activité enzymatique. En l'absence de L-fucose, les enzymes A ou B sont incapables d'allonger la chaîne. Donc, chez les Bombay, les chaines de glucides se terminent par la N-acétyl-lactosamine et, le déterminant H étant absent, des anti-corps anti-H sont présents dans leur sérum.
Lorsque le déterminant H existe, il peut être transformé en déterminant A par l'action d'une α1-3-N-acétyl-galactosaminyltransférase ou en déterminant B par l'action d'une α1-3-galactosyltransférase. Ces enzymes sont codés par deux des trois variantes principales du même gène. La troisième variante étant un gène défectueux qui laisse intact le déterminant H et donne donc naissance au groupe sanguin O.
Sécréteurs/non sécréteurs
Espèce humaine
La découverte des déterminants A et B dans les mucines de kystes ovariens impliquait que ces déterminants pouvaient être présents dans d'autres tissus de l'organisme que les globules rouges.
Il a d'abord été constaté que les fluides biologiques (salive, larmes, lait, urine) de certains individus étaient capables d'empêcher l'agglutination des érythrocytes A ou B par les anticorps anti-A ou anti-B. Ces individus ont été appelés sécréteurs. Ceux dont la salive n'avait aucun effet sur l'agglutination des érythrocytes ont été appelés non sécréteurs.
Chacun de ces déterminants H peut être transformé en déterminant A ou B selon le groupe sanguin-tissulaire de l'individu.
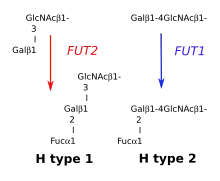
Il est apparu que la structure glycosylée des déterminants antigéniques ABH présents dans les sécrétions diffère de celle qui est rencontrée dans les érythrocytes. Le résidu galactose central est lié au carbone 3 de la N-acétyl-glucosamine au lieu d'être lié au carbone 4. Ce que les biochimistes ont appelé liaison ou chaîne de type 1, Galβ1-3GlcNAc (dans les sécrétions) et liaison ou chaîne de type 2, Galβ1-4GlcNAc (dans les érythrocytes).
Pour réaliser la biosynthèse du déterminant H, il existe deux α1-2fucosyltransférases : FUT1 présente dans la lignée érythrocytaire et FUT2, présente dans les tissus sécréteurs des individus sécréteurs et absente chez les non sécréteurs. Attention! FUT1 transfert le fucose sur les chaînes de type 2 et FUT2 transfert le fucose sur les chaînes de type 1.
On a pu mettre en évidence les déterminants ABH dans les poumons, la peau, le foie, le pancréas, l' estomac, l' intestin ,les reins,les ovaires et la prostate, selon le groupe ABO et le statut Sécréteur de l'individu. Les déterminants ABH sont donc des déterminants de groupes sanguins et tissulaires (histo-blood groups en anglais) qui doivent être pris en compte dans le contexte des transplantations d'organes.
Les sécréteurs représentent 100 % de la population des peuples premiers, Inuits, certains Américains originels, Mélanésiens et Aborigènes australiens. Ils représentent environ 80 % de la population blanche, 50 % dans la plupart des autres groupes ethniques et 22 % dans la population du Sud de l'Inde[5].
Le statut de sécréteur contrôle la possibilité d'expression du groupe sanguin Lewis b.
Autres mammifères
Les autres mammifères, rat, souris, porc, singe, n'ont pas de groupes sanguins ABO mais ils expriment les groupes ABH de type 1 dans les cellules épithéliales comme l'estomac, l'intestin ou les poumons. Le rat possède deux gènes contigus (non alléliques) qui lui permet d'exprimer l'antigène B dans l'estomac, l'antigène A dans l'intestin grêle et les deux dans le colon, chez le même individu.
Groupes A et B faibles
Les globules de groupe A ne réagissent pas tous de la même façon avec les réactifs anti-A utilisés, ce qui permet de différencier deux sous-groupes, A1 et A2, ainsi qu'un certain nombre de groupes faibles, donnant des réactions encore plus faibles, voire une absence complète de réaction avec les réactifs anti-A.
De même, certains groupes B ne donnent pas les réactions normalement attendues avec un anti-B, et sont donc répertoriés comme B faibles.
Sous-groupes A1 et A2
Le sous-groupe A1 est le plus fréquent (fréquences géniques en France : A1 = 0,21, A2 = 0,06), et est celui qui donne les réactions les plus nettes. Les globules A2 sont légèrement moins bien agglutinés.
Cette différence est quantitative, le nombre de sites antigéniques A (définis par une N-Acétylgalactosamine fixée sur une chaîne H) étant plus important sur les globules A1 -1 million d'épitopes-, que sur les globules A2 -100 000 épitopes. Elle est également qualitative, l'ensemble des chaînes de la substance de base H étant saturées sur les érythrocytes A1, les chaînes H de type III ou IV ne l'étant pas sur les érythrocytes A2.
Les globules A1 réagissent donc avec l'anti-A, l'anti-A1 (souvent une lectine extraite de Dolichos biflorus), mais pas avec l'anti-H (souvent une lectine extraite de Ulex europæus), alors que les globules A2, réagissent avec l'anti-A, pas avec l'anti-A1, mais avec l'anti-H.
Ceci explique la présence de deux types d'anticorps, anti-A et anti-A1 chez les sujets B, l'anti-A étant absorbable en totalité sur des globules A2, ne laissant qu'un anti-A1 subsister dans le sérum absorbé, et la présence constatée parfois d'un anti-A1 chez des sujets A2 ou plus fréquemment A2B.
A et B faibles
De nombreux groupes faibles ont d'abord été définis sérologiquement, avant que l'étude des glycosyltransférases ne soit entreprise en biologie moléculaire.
Parmi les groupes A, avaient été caractérisés sérologiquement les groupes A3, Ax, Aend, Am, Ael et Ay.
Parmi les groupes B, avaient été caractérisés sérologiquement les groupes B3, Bx, Bm et Bel.
La preuve de la présence d'une substance A ou B sur les érythrocytes, suspectée lors du groupage sur l'épreuve sérique de Simonin, qui montre l'absence d'anticorps anti-A (mais parfois la présence d'un anti-A1) ou anti-B, est apportée pour les plus faibles de ces groupes, par une technique de fixation-élution. La fixation-élution est une technique de laboratoire utilisée en immuno-hématologie, permettant de mettre des antigènes faibles en évidence à la surface des hématies.
En effet, certains groupes sanguins ne peuvent être mis en évidence par les réactions d'agglutination normalement utilisées. Quoique non, ou peu agglutinables par le sérum test utilisé, les globules possèdent cependant l'antigène à leur surface. Sont dans ce cas de nombreux groupes sanguins dits faibles tels que A3, Ax, Am, Ael… Bx, Bm…Du, C*…
La technique de fixation-élution consiste à faire agir le sérum test sur les globules rouges. L'anticorps contenu dans le sérum se fixe sur les globules si ces derniers possèdent l'antigène correspondant à leur surface, mais ne provoque pas l'agglutination habituellement observée. Cette fixation de l'anticorps sur son antigène, qui ne provoque pas de réaction visible, constitue le premier temps de la technique.
La liaison antigène anticorps est une liaison réversible, avec une constante d'association dépendant de divers paramètres, en particulier de la température.
Dans un second temps, après « lavage » des hématies, c’est-à-dire élimination du sérum test entourant les hématies, l'anticorps peut être élué (c’est-à-dire détaché du globule, par divers procédés physico-chimiques, chaleur, éther, solution acide…) puis récupéré, après centrifugation, dans le liquide de suspension des globules (solution d'élution, ou solution physiologique à 9 g/l de NaCl, si technique chaleur). Ce liquide surnageant, appelé éluat, est ensuite testé vis-à-vis de globules rouges porteurs d'un groupe normal, donc agglutinables. L'agglutination de ces globules tests prouve la présence de l'anticorps dans l'éluat, anticorps qui ne peut être présent que s'il s'était préalablement fixé sur l'antigène correspondant des globules rouges analysés. Ce qui prouve que ces derniers, quoique non agglutinables, étaient bien porteurs de l'antigène de groupe sanguin recherché.
Cette technique est très sensible et permet, de façon simple, de mettre en évidence la majorité des groupes sanguins faibles. En cas d'échec de cette technique et pour certains cas particuliers qui nécessitent une réponse (anomalie apparente de filiation, problème transfusionnel, recherche de nouveaux allèles…), il peut maintenant être fait appel à la biologie moléculaire.
B acquis
Lors d'infections du tube digestif, lors de coliques en particulier, certains germes libèrent une enzyme, une , qui transforme la N-acétyl-galactosamine, qui constitue la substance A du groupe ABO, en galactosamine. Certains réactifs anti-B, reconnaissant normalement uniquement le galactose, réagissaient alors comme si le groupe possédait la substance B. Les réactifs maintenant commercialisés sont contrôlés et ne présentent plus, en principe, cette réaction croisée, qui pouvait être source d'erreur entre des mains inexpérimentées, faisant déterminer comme AB un sujet de groupe A. Dès la fin de l'infection, l'anomalie disparaît progressivement
Génétique
Génétique moléculaire
En 1990, le gène de l'enzyme A/B fut identifié par le groupe de Sen-itiroh Hakomori au Fred Hutchinson Cancer Center à Seattle[6]. Le gène contient 7 exons sur 18 kb d'ADN. Le dernier exon contient la majeure partie de la séquence codante.
| Allèles | Nomenclature | Allèles | Nomenclature |
|---|---|---|---|
| A1 | A101 | O1 | O01 |
| A2 | A201 | O1v | O02 |
| B | B101 | O2 | O03 |
L'allèle A1 code une protéine de 353 acides aminés. L'allèle B code une protéine de la même longueur avec 4 acides aminés différents, à savoir : Arg 176 Gly, Gly 235 Ser, Leu 266 Met, Gly 268 Ala. L'allèle O1 produit une protéine inactive de 116 acides aminés du fait d'un décalage de lecture dû à une délétion dans le codon 87.
Les allèles cis-AB et sous-groupes A du système ABO résultent des mutations suivantes par rapport à l'allèle A1, pris comme référence[7] - [8] :
- allèle cis-AB : Gly 268 → Ala seule ou associée à Pro 156 → Leu ou Arg 176 → Gly et Gly 235 → Ser ;
- allèle A2 : Pro 156 → Leu, et addition de 21 acides aminés à la protéine ;
- allèle A3 : Asp 291 → Asn ;
- allèle Ax : Phe 216 → Ile.
Les allèles des sous-groupes B du système ABO résultent des mutations suivantes par rapport à l'allèle B, pris comme référence :
- allèle B3 : Arg 352 → Trp ;
- allèle B(A) : Ser 235 → Gly ou Pro 234 → Ala.
Génétique mendélienne
En 1910-1911, Ludwik Hirszfeld et Emil von Dungern ont découvert que les groupes sanguins ABO se transmettaient héréditairement selon les lois de Mendel. En 1924, Felix Bernstein a précisé que le phénotype ABO dépendait d'un locus unique avec de multiples allèles[9].
Déterminant H - Groupe Bombay
L'alpha1-2fucosyltransférase synthétisant le déterminant H dans la lignée érythrocytaire est dénommée FUT-1. Le gène codant cette enzyme est dénommé gène H et existe sous deux allèles connus H et h. Il existe une autre alpha1-2fucosyltransférase exprimée dans les tissus sécréteurs où elle synthétise l'antigène H sur les glycoprotéines de type mucines. Cette protéine, dénommée FUT-2, est codée par le gène Se. Les deux gènes H et Se sont proches l'un de l'autre sur le chromosome 19 en q.13.3.
Lorsque des sujets sont dépourvus de fucosyltransférase fonctionnelle, ils n'expriment ni A, ni B, ni H. Ces sujets sont de génotype h/h, possédant en double dose l’allèle inactif h de H. Ces sujets sont dits de groupe « Bombay », du nom de la localité où cette particularité a été décrite. Ces sujets n’ont donc pas de substance H sur leurs globules rouges, et ont un anticorps anti-H dans leur plasma, ce qui interdit ou rend dangereuse toute transfusion non isogroupe (non « Bombay »). N’ayant pas cette substance H, même si ces sujets « Bombay » possèdent le gène A ou le gène B, les substances A ou B ne pourront être fabriquées, et ces sujets seront en apparence de groupe O. Leurs enfants héritant de ce parent d’un gène h et d’un gène A ou B, et de l’autre parent d’un gène normal H (dans le système Hh) et d’un gène O par exemple (dans le système ABO) pourront à nouveau exprimer le gène A ou B qui leur a été transmis par le premier parent et seront de groupe A ou B normal.
Déterminants A et B
Le gène contrôlant l'expression des antigènes ABO est situé en 9q34-2 sur chromosome 9 humain. Tout individu possède deux allèles du même locus, l’un venant de son père et l’autre de sa mère.
Lorsque le sujet possède à la fois l'allèle A et l'allèle B, les deux sucres se trouvent alors sur l’érythrocyte et le sujet est de groupe AB. Lorsqu’il ne possède que 2 allèles O, il sera de groupe O. S’il possède un ou deux allèles A et pas l'allèle B, il sera A, s’il possède un ou deux allèles B et pas l'allèle A, il sera B.
Ainsi, un couple de parents, dont la mère est génétiquement A / O, donc de groupe A, et le père B / O, donc de groupe B, pourra avoir des enfants de quatre groupes différents. Si chacun des parents transmet son allèle O, l’enfant sera génétiquement O / O, donc de groupe O. Si le père transmet l'allèle O et la mère l'allèle A, l’enfant sera A / O, donc de groupe A. Si le père transmet l'allèle B et la mère l'allèle O, l’enfant sera B / O, donc de groupe B. Si la mère transmet l'allèle A et le père l'allèle B, l’enfant sera alors A / B, donc de groupe AB.
Cis AB
Une autre anomalie apparente de transmission dans le système ABO peut être due à la présence d'un gène CisAB, gène qui code une glycosyltransférase synthétisant simultanément les substances A et B. Ainsi, un sujet génétiquement CisAB / O, donc de groupe apparent AB, marié à un conjoint O / O, donc de groupe O, aura des enfants AB ou O, et non des enfants A ou B comme attendu.
Chimérisme
On parle de chimère lorsqu'un individu est constitué de deux patrimoines génétiques différents, fusion de deux œufs, par exemple, ou circulations croisées in utero entre les placentas de deux jumeaux dizygotes. Ainsi les cellules germinales d'un sujet, cellules qui lui appartiennent en propre, pourront être différentes des cellules hématopoïétiques qui viennent de son jumeau, et qui sont en fait une greffe. On observera alors, chez cette personne une discordance entre les groupes sanguins déterminés sur son sang circulant, et les groupes transmis à sa descendance.
Anticorps du système ABO et associés
Immunoglobulines
Les anticorps du système ABO sont des IgM, des IgG et même parfois des IgA (G. Daniels).
Les anticorps naturels sont des IgM, plus actifs à froid ou à température ambiante qu'à 37 °C, agglutinants, sensibles à la chaleur (70 °C), au 3-mercapto-éthanol (3ME), ou au dithiothréitol (DTT). Ces anticorps ne passent pas la barrière placentaire, et sont donc sans action sur le fœtus. Ces anticorps ne sont pas développés à la naissance, et apparaissent après contact avec des antigènes présents dans l'environnement ou notre tube digestif (aliments, bactéries). D'autre part, les anticorps A et B n'apparaissent que tardivement sur les érythrocytes. Ceci explique que la détermination de groupe sanguin ABO d'un nouveau-né est impossible avant l'âge de six mois, et n'est pas effectuée. L'enfant est protégé par les IgG de sa mère. Seul, un résultat provisoire basé sur la seule épreuve de Beth-Vincent peut être rendu.
Après relance d'immunisation (transfusion, grossesse, ou consommation de certains aliments, infections, médicaments) le taux des IgG augmente. Ces anticorps sont dits immuns. Thermorésistants, insensibles au 3-ME ou au DTT, passant la barrière placentaire, non agglutinants, ces anticorps plus actifs à 37 °C ne peuvent être mis en évidence qu'après élimination des IgM et par des techniques d'agglutination artificielle, enzymes, test à l'antiglobuline. Ce sont ces anticorps que l'on peut mettre en évidence, dans un certain nombre de cas, sur les érythrocytes des nouveau-nés de groupe A ou B nés de mères O (voire AB de mère A ou B). Cette incompatibilité ABO est généralement bénigne.
Les auto-anticorps du système ABO sont rares.
Spécificités
Quatre spécificités existent dans le système ABO. L'anti-A, et l'anti A1 que l'on trouve chez un sujet de groupe B. L'anti-A1 parfois présent chez 1 % des sujets A2, et chez 10 à 25 % des sujets A2B. L'anti-B, que l'on trouve chez un sujet de groupe A. L'anti-A, l'anti-A1, l'anti-B et l'anti-AB que l'on trouve chez un sujet de groupe O.
L'anti-AB étant un anticorps reconnaissant les globules A et les globules B. Par exemple, lors d'une incompatibilité fœto-maternelle ABO, lorsqu'il est élué des globules rouges A d'un enfant de mère O, cet anticorps réagit avec les globules tests A et les globules tests B.
Un cinquième anticorps, qui n'appartient pas au système ABO mais au système H, est exceptionnellement rencontré lors de la détermination d'un groupe ABO ou d'une recherche d'anticorps irrégulier. Il s'agit d'un anti-H présent chez un sujet A1 ou A1B. Il s'agit, dans ce cas, d'un anticorps froid, sans danger transfusionnel. (M. Goudemand, Ch. Salmon). Cet anticorps anti-H ne doit pas être confondu avec l'anti-H du sujet de groupe Bombay, sujet dépourvu de substance H, incapable de synthétiser les substance A ou B par manque de substrat, et dont l'anticorps présente un risque transfusionnel majeur.
Importance pratique du système ABO
Intérêt clinique
En transfusion clinique :
- rôle en pathologie, par exemple dans la maladie hémolytique du nouveau-né. L'incompatibilité ABO du couple mère-enfant très fréquente n'a que très rarement, des conséquences cliniques, qui restent très discrètes ;
- rôle dans les greffes de moelle ou d'organes.
Applications médico-légales
En médecine légale :
- pour l'identification de taches de sang. Technique historique remplacée par les techniques de biologie moléculaire ;
- pour des recherches en exclusion de paternité : dans ce cas, on détermine les groupes de la mère, de l'enfant, du ou des pères présumés : les antigènes présents chez l'enfant doivent obligatoirement être présents chez la mère ou chez le père (NB : ce n'est pas un test de paternité). Là aussi, la biologie moléculaire apporte maintenant la réponse.
Autres applications
- En hémotypologie, l'étude des groupes sanguins des populations (et des autres marqueurs génétiques) permet de déceler des variations de fréquence chez les divers groupes humains. L'importance de ces variations caractérise la distance génétique entre ces diverses populations. La variation génétique étant continue d'un endroit à l'autre de la planète, il est impossible de tracer une quelconque frontière entre divers peuples, ce qui fait que la notion de « race » n'a plus aucun sens du point de vue scientifique, ainsi que l'a montré le Pr Ruffié, l'un des fondateurs de cette discipline.
Autres conséquences sur la santé
Il existe toute une littérature sur des régimes spécifiques à suivre suivant le groupe sanguin, sans aucun substrat scientifique. En fait, les études démontrant des conséquences médicales différentiées de chaque groupe sont rares. Toutefois, les personnes n'étant pas du groupe O semblent avoir un risque plus élevé de faire une maladie thromboembolique veineuse[10].
Groupes sanguins et personnalité
Depuis la fin des années 1920, des théories pseudoscientifiques lient groupe sanguin et personnalité. Si ces idées n'ont jamais été sérieusement évaluées, elles n'en restent pas moins très populaires au Japon (et plus marginalement à Taïwan et en Corée du Sud), où elles font office d'horoscope, servent parfois d'outil de décision aux recruteurs, etc.
Distribution des antigènes A B H
Chez les sujets sécréteurs, les substances de groupe ABO sont présentes dans la salive et tous les liquides de l'organisme (plasma, lait, sperme) à l'exception du liquide cérébro-spinal. Les antigènes ABO sont présents dans leurs lymphocytes et les plaquettes, ainsi que sur les cellules épithéliales, endothéliales, et largement distribués dans la plupart des tissus, à tel point que le système ABO peut être considéré comme un système d'histocompatibilité.
Défense contre les virus
Les anticorps naturels sont des anticorps générés de façon aléatoire par le système immunitaire dont ne subsistent que ceux qui ne réagissent pas avec les antigènes de l'individu. La concentration de ces anticorps naturels est amplifiée et maintenue par la présence d'antigènes étrangers banaux (nourriture, particules respirées, poussière dans les yeux) ou infectieux (virus, bactéries, moisissures). Il se trouve que certains de ces anticorps naturels croisent avec (c'est-à-dire reconnaissent) les antigènes de groupes sanguins. C'est ainsi que l'on explique la présence d'anti-A et d'anti-B chez les sujets O dont les lymphocytes B n'ont probablement jamais rencontré de substance A ou B.
| Groupe de l'émetteur de virus | Groupe du receveur de virus | |||
|---|---|---|---|---|
| O | A | B | AB | |
| O | ||||
| A | # | # | ||
| B | # | # | ||
| AB | # | |||
| Seuls les receveurs indiqués par # bénéficient, grâce à leurs anticorps anti-A ou anti-B, d'une certaine protection contre les virus émis par les individus de groupe A ou B ou AB. | ||||
Lorsque les virus synthétisent leurs propres protéines dans les cellules hôtes, ils utilisent la machinerie cellulaire pour « se vêtir » des mêmes décorations que les glycoprotéines natives. C'est ainsi que le virus HIV-1 acquiert les déterminants de groupe sanguin de l'individu qu'il a infecté, A chez les A, B chez les B et H chez les O. Quand le virus est transmis d'un individu de groupe sanguin A à un individu de groupe sanguin O, il rencontre la barrière des anticorps anti-A qui peut bloquer ou freiner l'infection, tout dépend de la concentration des anti-A, qui est très variable d'un individu O à l'autre[11] - [12].
De même, la glycoprotéine S des spicules (projections de la couronne) des virus SARS-CoV-1, et probablement SARS-CoV-2, s'habillent des déterminants A, B ou H selon le groupe de leur hôte. Comme les cellules épithéliales pulmonaires ont la capacité d'exprimer les déterminants A, B, H, il est hautement probable que les virions expulsés dans les postillons, soient pourvus des mêmes déterminants. Il a été démontré que les anticorps anti-A inhibent la fixation des coronavirus ayant acquis l'antigène A sur des cellules possédant le récepteur ACE2[13].
Explication : Les immunoglobulines sont des très grosses protéines. Lorsqu'elle se fixent sur les virus elles provoquent deux effets :
- elles empêchent le virus d'atteindre son récepteur (effet barrière) ;
- elles marquent ou agglutinent les virus qui sont ensuite phagocytés et détruits par les macrophages.
L'effet barrière ne peut fonctionner que pour les infections dans le sens A vers O ou B, et B vers A ou O, mais est inexistante dans le sens O vers A ou B.
Nomenclature
La nomenclature internationale, définie par la Société internationale de transfusion sanguine (SITS, ou ISBT en anglais) répertorie les antigènes de groupes sanguins selon une codification numérique : trois chiffres ou symbole alphabétique pour le système, trois chiffres — dont seuls les chiffres significatifs sont écrits en règle générale — pour chaque antigène du système.
Le système ABO est donc le système 001 dans la nomenclature internationale. Chaque spécificité antigénique de ce système est également affectée d'un numéro, A : 001, B : 002, AB : 003, A1 : 004. Ainsi, un sujet A1B sera défini, en nomenclature internationale comme 001:1,2,4 ou plus communément ABO:1,2,4. Un sujet B sera noté ABO:-1,2.
Autre exemple pour le système Rhésus : ce système porte le numéro 004, aux antigènes D, C, E, c, e, Cw sont affectés respectivement les numéros 001, 002, 003, 004, 005, 008. Ainsi un sujet DCCwcee sera défini, en nomenclature internationale comme 004:001,002,-003,004,005,008, ou plus simplement RH:1,2,-3,4,5,8.
Cette nomenclature officielle n'est pas encore entrée partout dans la pratique courante en France, mais est utilisée de façon habituelle dans d'autres pays, en Russie par exemple.
Répartition géographique des groupes sanguins ABO
Le groupage traditionnel repose sur le phénotype des individus relatif aux deux systèmes, ABO et Rhésus (+/-).
| Pays | Population | O + | A + | B + | AB + | O - | A- | B- | AB- |
|---|---|---|---|---|---|---|---|---|---|
| Afrique du Sud | 49 320 000 | 39 % | 32 % | 12 % | 3 % | 7 % | 5 % | 2 % | 1 % |
| Allemagne | 82 329 758 | 35 % | 37 % | 9 % | 4 % | 6 % | 6 % | 2 % | 1 % |
| Arabie saoudite | 28 686 633 | 48 % | 24 % | 17 % | 4 % | 4 % | 2 % | 1 % | 0,23 % |
| Australie | 21 262 641 | 40 % | 31 % | 8 % | 2 % | 9 % | 7 % | 2 % | 1 % |
| Autriche | 8 210 281 | 30 % | 33 % | 12 % | 6 % | 7 % | 8 % | 3 % | 1 % |
| Belgique | 10 414 336 | 38 % | 34 % | 8,5 % | 4,1 % | 7 % | 6 % | 1,5 % | 0,8 % |
| Brésil | 198 739 269 | 36 % | 34 % | 8 % | 2,5 % | 9 % | 8 % | 2 % | 0,5 % |
| Canada | 33 487 208 | 39 % | 36 % | 7,6 % | 2,5 % | 7 % | 6 % | 1,4 % | 0,5 % |
| Danemark | 5 500 510 | 35 % | 37 % | 8 % | 4 % | 6 % | 7 % | 2 % | 1 % |
| Espagne | 40 525 002 | 36 % | 34 % | 8 % | 2,5 % | 9 % | 8 % | 2 % | 0,5 % |
| États-Unis | 307 212 123 | 37,4 % | 35,7 % | 8,5 % | 3,4 % | 6,6 % | 6,3 % | 1,5 % | 0,6 % |
| Estonie | 1 299 371 | 30 % | 31 % | 20 % | 6 % | 4,5 % | 4,5 % | 3 % | 1 % |
| Finlande | 5 250 275 | 27 % | 38 % | 15 % | 7 % | 4 % | 6 % | 2 % | 1 % |
| France | 62 150 775 | 36 % | 37 % | 9 % | 3 % | 6 % | 7 % | 1 % | 1 % |
| Hong Kong | 7 055 071 | 40 % | 26 % | 27 % | 7 % | 0,31 % | 0,19 % | 0,14 % | 0,05 % |
| Inde | 1 166 079 217 | 36,5 % | 22,1 % | 30,9 % | 6,4 % | 2,0 % | 0,8 % | 1,1 % | 0,2 % |
| Irlande | 4 203 200 | 47 % | 26 % | 9 % | 2 % | 8 % | 5 % | 2 % | 1 % |
| Islande | 306 694 | 47,6 % | 26,4 % | 9,3 % | 1,6 % | 8,4 % | 4,6 % | 1,7 % | 0,4 % |
| Israël | 7 233 701 | 32 % | 34 % | 17 % | 7 % | 3 % | 4 % | 2 % | 1 % |
| Norvège | 4 660 539 | 34 % | 42,5 % | 6,8 % | 3,4 % | 6 % | 7,5 % | 1,2 % | 0,6 % |
| Nouvelle-Zélande | 4 213 418 | 38 % | 32 % | 9 % | 3 % | 9 % | 6 % | 2 % | 1 % |
| Pays-Bas | 16 715 999 | 39,5 % | 35 % | 6,7 % | 2,5 % | 7,5 % | 7 % | 1,3 % | 0,5 % |
| Pologne | 38 482 919 | 31 % | 32 % | 15 % | 7 % | 6 % | 6 % | 2 % | 1 % |
| Portugal | 10 707 924 | 36,2 % | 39,8 % | 6,6 % | 2,9 % | 6,0 % | 6,6 % | 1,1 % | 0,5 % |
| Royaume-Uni | 61 113 205 | 37 % | 35 % | 8 % | 3 % | 7 % | 7 % | 2 % | 1 % |
| Suède | 9 059 651 | 32 % | 37 % | 10 % | 5 % | 6 % | 7 % | 2 % | 1 % |
| Turquie | 76 805 524 | 29,8 % | 37,8 % | 14,2 % | 7,2 % | 3,9 % | 4,7 % | 1,6 % | 0,8 % |
| Moyenne pondérée de la population |
2 261 025 244 | 36,44 % | 28,27 % | 20,59 % | 5,06 % | 4,33 % | 3,52 % | 1,39 % | 0,45 % |
Notes et références
- (ca) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en catalan intitulé « Sistema d'agrupament sanguini ABO » (voir la liste des auteurs).
- (en) W.M. Watkins and W.T.J. Morgan, « Possible genetical pathways for the biosynthesis of blood group mucopolysaccharides », Vox Sanguinis Vol.4, , p. 97-119
- (en) W.M. Watkins, « Biochemistry and Genetics of the ABO, Lewis, and P Blood Group Systems », Advances in Human Genetics vol.10, , p. 1-136
- (en) J. Järnefelt, J. Rush, Y. T. Li and R. A. Laine, « Erythroglycan, a high molecular weight glycopeptide with the repeating structure [galactosyl-(1 leads to 4)-2-deoxy-2-acetamido-glucosyl(1 leads to 3)] comprising more than one-third of the protein-bound carbohydrate of human erythrocyte stroma », J. Biol. Chem. Vol.253, , p. 8006-8009
- (en) Roger A. Laine et Jeffrey S. Rush, Chemistry of human erythrocyte polylactosamine glycopeptides 'Erythroglycans) as related to ABH blood group antigenic determinants : Evidence that Band 3 carbohydrate on human erythrocytes carrries the majority of ABH blodd group substance, N.Y., The Molecular Immunology of Complex Carbohydrates (Albert M. Wu and L. Garry Adams, Editors) Kluwer Academic Publisher, Plenum Press, , 867 p. (ISBN 978-1-4612-8923-4), p. 331-347
- (en) Geoff Daniels, Human Blood Groups, Hoboken (N.J.), John Wiley & Sons, , 560 p. (ISBN 978-1-118-49354-0, lire en ligne)
- (en) F. Yamamoto F, H. Clausen, T. White, J. Marken and S-i Hakomori, « Molecular genetic basis of the histo-blood group ABO system », Nature Vol. 345, , p. 229-233
- (en) K. Ogasawara, M. Bannai, N. Saitou, Ogasawara, R. Yabe, K. Nakata, M. Takenaka, K. Fujisawa, M. Uchikawa, Y. Ishikawa , T. Juji, K. Tokunaga, « Extensive polymorphism of ABO blood group gene : three major lineages of the alleles for the common ABO phenotypes », Human Genetics Vol.97, , p. 777-783
- (en) A. Seltsam, M. Hallensleben,A. Kolman, R. Blasczyk, « The nature of diversity and diversification at the ABO locus », Blood Vol.102, , p. 3035-3042
- (en) J. Crow, « Felix Bernstein and the first human marker locus », Genetics Vol.133, , p. 4-7
- Vasan SK, Rostgaard K, Majeed A et al. ABO blood group and risk of thromboembolic and arterial disease: A study of 1.5 million blood donors, Circulation, 2016;133:1449-1457.
- (en) M. Arendrup, J.E. Hansen, H. Clausen, C. Nielsen, L.R. Mathiesen, J.O. Nielsen, « Antibody to histo-blood group A antigen neutralizes HIV produced by lymphocytes from blood group A donors but not from blood group B or O donors », AIDS Vol.5, , p. 441-444
- (en) S.J. Neil, A. McKnight, K. Gustafsson, R.A. Weiss, « HIV-1 incorporates ABO histo-blood group antigens that sensitize virions to complement-mediated inactivation », Blood Vol.105, , p. 4693-4699
- Patrice Guillon, Monique Clément, Véronique Sébille, Jean-Gérard Rivain, Chih-Fong Chou, Nathalie Ruvoën-Clouet, Jacques Le Pendu, « Inhibition of the interaction between the SARS-CoV Spike protein and its cellular receptor by anti-histo-blood group antibodies », Glycobiology Vol.18, , p. 1085-1093
Voir aussi
Bibliographie
- Les Groupes sanguins chez l'Homme, R. R. Race et R. Sanger, traduit par Ch. Salmon et A. Mourier, Masson, 1970.
- Bases moléculaires des antigènes des groupes sanguins, J.P. Cartron et Ph. Rouger, Masson, 1998.
- Immuno-hématologie et immunogénétique M. Goudemand et Ch Salmon, Flammarion Médecine-Sciences, 1980.
- (en) Human blood groups, Geoff Daniels, Blackwell Science Ltd, 3e édition, 2013.
- (en) The blood group antigen, Marion E. Reid, Christine Lomas-Francis et Martin L. Olsson, Facts Book, Elsevier Academic Press, 3e édition, 2012.
- Les analyses immunohématologiques et leurs applications cliniques, J.Chiaroni, F. Roubinet, P. Bailly, L.Mannessier, F. Noizat-Pirenne, Edit. : John Libbey Eurotext. 2011.
- Les groupes sanguins érythrocytaires, coordonné par P. Bailly, J. Chiaroni, F. Roubinet. Edit. : John Libbey Eurotext, Paris, 2015.