Protéine phosphatase 2
La protéine phosphatase 2 (PP2), également appelée PP2A, est une enzyme qui, chez l'homme, est codée par les gènes PPP2CA (isoforme α) et PPP2CB (isoforme β) situés sur le chromosome 5 et le chromosome 8 respectivement[3]. Il s'agit d'une protéine hétérotrimérique exprimée de manière ubiquitaire qui assure une partie importante de l'activité phosphatase dans les cellules d'eucaryotes[4]. Son activité phosphatase est caractérisée par une large spécificité de substrats et une grande diversité de fonctions cellulaires. Parmi les cibles de la protéine phosphatase 2, on compte notamment les protéines des cascades de signalisation oncogène comme c-Raf, MAP2K (en) et Akt1, vis-à-vis desquelles elle agit comme suppresseur de tumeur.
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
| Isoforme α de la protéine phosphatase 2 | ||
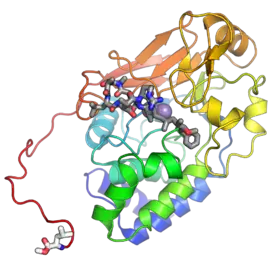 L'extrémité N-terminale est représentée en bleu, l'extrémité C-terminale est représentée en rouge. Le groupe carboxyle méthylé du résidu de leucine C-terminal est représenté en blanc. Les sphères violettes représentent deux cations de manganèse indispensables à la catalyse. (PDB 2IAE[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | PPP2CA | |
| Synonymes | RP-C, PP2Ac, PP2CA, PP2Calpha | |
| N° EC | 3.1.3.16 | |
| Homo sapiens | ||
| Locus | 5q31.1 | |
| Masse moléculaire | 35 594 Da[2] | |
| Nombre de résidus | 309 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Isoforme β de la protéine phosphatase 2 | ||
| Caractéristiques générales | ||
| Symbole | PPP2CB | |
| Synonymes | PP2CB, PP2Abeta | |
| N° EC | 3.1.3.16 | |
| Homo sapiens | ||
| Locus | 8p12 | |
| Masse moléculaire | 35 575 Da[2] | |
| Nombre de résidus | 309 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
L'enzyme est formée d'un cœur constitué d'une sous-unité structurelle A et d'une sous-unité catalytique C, auquel est liée une sous-unité régulatrice B. L'association de ces trois sous-unités produit différentes holoenzymes ayant différentes propriétés et des fonctions distinctes. La sous-unité A, caractérisée par sa répétition HEAT, joue le rôle d'armature indispensable à la formation du complexe hétérotrimérique. La liaison de la sous-unité A modifie l'activité enzymatique de la sous-unité catalytique C même en l'absence de sous-unité B. Alors que la séquence peptidique des sous-unités A et C est remarquablement conservée chez les eucaryotes, les sous-unités régulatrices B sont plus hétérogènes et on pense qu'elles jouent un rôle clé dans le contrôle de la localisation et de l'activité spécifique des différentes holoenzymes. Les eucaryotes multicellulaires expriment quatre classes de sous-unités B : B (PR55), B′ (B56 ou PR61), B″ (PR72) et B‴ (PR93/PR110), avec au moins seize membres dans ces sous-familles. L'activité et l'association des sous-unités des protéines phosphatase 2 sont également contrôlées par des protéines accessoires et des modifications post-traductionnelles.
La protéine phosphatase 2 a été identifiée comme cible potentielle de médicaments contre la maladie de Parkinson et la maladie d'Alzheimer. On ne savait cependant pas encore en 2014 laquelle de ses isoformes serait la cible à privilégier ni si l'effet thérapeutique à rechercher en serait l'inhibition ou l'activation[6] - [7]. Elle a également été identifiée comme suppresseur de tumeurs dans le cadre de certains leucémies et certains programmes étaient en cours en 2015 afin d'identifier les composés susceptibles de l'activer directement ou d'inhiber les protéines qui réduisent son activité[8].
Notes et références
- (en) Uhn Soo Cho et Wenqing Xu, « Crystal structure of a protein phosphatase 2A heterotrimeric holoenzyme », Nature, vol. 445, no 7123, , p. 53-57 (PMID 17086192, DOI 10.1038/nature05351, Bibcode 2007Natur.445...53C, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Jones T. A., Barker H. M., da Cruz e Silva E. F., Mayer-Jaekel R. E., Hemmings B. A., Spurr N. K., Sheer D. et Cohen P. T. W., « Localization of the genes encoding the catalytic subunits of protein phosphatase 2A to human chromosome bands 5q23→q31 and 8p12→p11.2, respectively », Cytogenetics and Cell Genetics, vol. 63, no 1, , p. 35-41 (PMID 8383590, DOI 10.1159/000133497, lire en ligne)
- (en) Marc Mumby, « PP2A: Unveiling a Reluctant Tumor Suppressor », Cell, vol. 130, no 1, , p. 21-24 (PMID 17632053, DOI 10.1016/j.cell.2007.06.034, lire en ligne)
- (en) Matthew R. Groves, Neil Hanlon, Patric Turowski, Brian A. Hemmings et David Barford, « The Structure of the Protein Phosphatase 2A PR65/A Subunit Reveals the Conformation of Its 15 Tandemly Repeated HEAT Motifs », Cell, vol. 96, no 1, , p. 99-110 (PMID 9989501, DOI 10.1016/S0092-8674(00)80963-0, lire en ligne)
- (en) Steven P. Braithwaite, Michael Voronkov, Jeffry B. Stock et M. Maral Mouradian, « Targeting phosphatases as the next generation of disease modifying therapeutics for Parkinson’s disease », Neurochemistry International, vol. 61, no 6, , p. 899-906 (PMID 22342821, DOI 10.1016/j.neuint.2012.01.031, lire en ligne)
- (en) Jean-Marie Sontag et Estelle Sontag, « Protein phosphatase 2A dysfunction in Alzheimer’s disease », Frontiers in Molecular Neuroscience, vol. 7, , p. 16 (PMID 24653673, PMCID 3949405, DOI 10.3389/fnmol.2014.00016, lire en ligne)
- (en) Maria Ciccone, George A. Calin et Danilo Perrotti, « From the biology of PP2A to the PADs for therapy of hematologic malignancies », Frontiers in Oncology, vol. 5, , p. 21 (PMID 25763353, DOI 10.3389/fonc.2015.00021, Bibcode 4329809, lire en ligne)