Solénoïde alpha
Un solénoïde α est un motif structurel de certaines protéines constitué d'une succession d'hélices α, souvent des motifs hélice-coude-hélice, disposées de manière antiparallèle pour former une superhélice[3]. Les solénoïdes α sont remarquables par leur plasticité et leur flexibilité[4]. Les solénoïdes α sont, comme les beta-propellers, des domaines fréquents dans les protéines des pores nucléaires[5]. On les trouve également très souvent dans les protéines d'enrobage des membranes appelées coatomers (de coating en anglais) telles que la clathrine, ainsi que dans des protéines régulatrices formant de nombreuses interactions protéine-protéine avec leurs partenaires de liaison[3] - [5]. Certains solénoïdes α de liaison à l'ARN et aux lipides ont en outre été décrits[3].
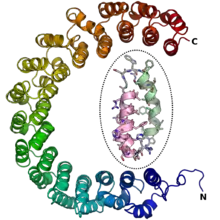
Le terme de solénoïde α a parfois été utilisé de manière inconstante dans la littérature[5]. Il a été initialement défini comme une structure formée d'un empilement de motifs hélice-coude-hélice empilés pour former une superhélice ouverte[6]. Ce type de structure a cependant été désigné par une terminologie variable selon les sources. La base de données SCOP de classification structurelle des protéines a ainsi adopté la désignation « superhélice alpha alpha », tandis que la base de données CATH (en) l'appelle « fer-à-cheval alpha » et appelle « solénoïde alpha » une structure plus compacte et quelque peu différente.
Structure
Les solénoïdes α sont des unités structurelles formées d'au moins deux hélices α orientées de manière antiparallèle. L'unité répétée est souvent un motif hélice-coude-hélice, mais il peut être plus élaboré, par exemple avec une hélice supplémentaire au niveau du coude. Les solénoïdes α peuvent résulter de répétitions de motifs hélicoïdaux différents, comme les répétitions HEAT, les répétitions armadillo, les répétitions tétratricopeptide, les répétitions riches en leucine et les répétitions ankyrine[3] - [5] - [6].
Les solénoïdes α présentent une élasticité et une flexibilité inhabituelle pour des protéines globulaires. On les range parfois dans une catégorie intermédiaire entre les protéines globulaires et les protéines fibreuses. Elles diffèrent cependant de ces dernières par le fait que les solénoïdes α n'ont pas besoin d'interactions intermoléculaires pour maintenir leur structure[6]. L'amplitude de l'inflexion de la superhélice d'un solénoïde α varie considérablement au sein de cette famille, ce qui permet à ces protéines de former des surfaces d'interaction protéine-protéine étendues ou de former des zones concaves profondes pour la liaison à des protéines globulaires.
Dans la mesure où ils sont constitués de répétitions d'unités relativement courtes, les solénoïdes α peuvent acquérir des unités supplémentaires assez facilement, ce qui confère de nouvelles propriétés d'interaction à la surface moléculaire concernée. C'est la raison pour laquelle les domaines en solénoïde ont une longueur qui varie sensiblement d'une protéine à une autre[5].
Fonctions
Constituants des pores nucléaires
Les solénoïdes α sont très présents dans les protéines qui constituent les pores nucléaires. Avec les beta-propellers, ils représentent jusqu'à la moitié de la masse des protéines du cœur des pores nucléaires.Un grand nombre des nucléoporines (en) conservées des pores nucléaires sont ou bien des protéines à solénoïde α ou bien possèdent un domaine beta-propeller du côté N-terminal et un solénoïde α du côté C-terminal[7] - [8]. Cette dernière configuration est également présente dans la clathrine et la protéine Sec31 ; on pensait initialement qu'elle était spécifique des eucaryotes[9], mais quelques exemples ont été identifiés également chez des planctomycètes[10].
Protéines d'enrobage des vésicules

Les protéines d'enrobage des vésicules contiennent fréquemment des solénoïdes α et partagent une architecture commune avec les protéines des pores nucléaires[7]. Trois complexes d'enrobage importants intervenant dans des processus cellulaires distincts font intervenir des protéines contenant des solénoïdes α : le complexe clathrine/adaptine, qui fait bourgeonner des vésicules sur la membrane plasmique et intervient dans l'endocytose ; le complexe COPI (en), qui fait bourgeonner des vésicules sur l'appareil de Golgi ; le complexe COPII (en), qui fait bourgeonner des vésicules sur le réticulum endoplasmique ; ces deux derniers sont associés au transport axoplasmique (en) respectivement rétrograde et antérograde[11].
Protéines de transport
En raison d'une part de leur propension à former de grandes surfaces propices aux interactions protéine-protéine, et d'autre part de leur grande flexibilité permettant d'établir des liaisons avec diverses protéines de toutes formes, les domaines en solénoïde α interviennent souvent dans le transport des protéines, notamment entre le noyau et le cytoplasme. La superfamille des β-karyophérines sont des protéines à solénoïde α constitué de répétitions HEAT ; l'importine β appartient à cette famille, et l'importine α, qui est sa protéine adaptatrice, contient un solénoïde formé de répétitions armadillo[12]. Les transporteurs d'autres molécules, comme l'ARN, peuvent également présenter une architecture avec un solénoïde α, comme pour l'exportine 5 (en)[13] ou les protéines de liaison à l'ARN à répétitions pentatricopeptide, qui sont particulièrement courantes chez les plantes[14] - [15].
Protéines régulatrices
La sous-unité régulatrice de la protéine phosphatase 2, par exemple, possède un domaine en solénoïde α dont la flexibilité conformationnelle régule l'accès au site de liaison de l'enzyme[16].
Notes et références
- (en) Uhn Soo Cho et Wenqing Xu, « Crystal structure of a protein phosphatase 2A heterotrimeric holoenzyme », Nature, vol. 445, no 7123, , p. 53-57 (PMID 17086192, DOI 10.1038/nature05351, Bibcode 2007Natur.445...53C, lire en ligne)
- (en) « The structure of the protein phosphatase 2A PR65/A subunit reveals the conformation of its 15 tandemly repeated HEAT motifs », Cell, vol. 96, no 1, , p. 99-110 (PMID 9989501, DOI 10.1016/S0092-8674(00)80963-0, lire en ligne)
- (en) David Fournier, Gareth A. Palidwor, Sergey Shcherbinin, Angelika Szengel, Martin H. Schaefer, Carol Perez-Iratxeta et Miguel A. Andrade-Navarro, « Functional and Genomic Analyses of Alpha-Solenoid Proteins », PLoS One, vol. 8, no 11, , article no e79894 (PMID 24278209, PMCID 3837014, DOI 10.1371/journal.pone.0079894, lire en ligne)
- (en) Christian Kappel, Ulrich Zachariae, Nicole Dölker et Helmut Grubmüller, « An Unusual Hydrophobic Core Confers Extreme Flexibility to HEAT Repeat Proteins », Biophysical Journal, vol. 99, no 5, , p. 1596-1603 (PMID 20816072, PMCID 2931736, DOI 10.1016/j.bpj.2010.06.032, Bibcode 2010BpJ....99.1596K, lire en ligne)
- (en) Mark C. Field, Andrej Sali et Michael P. Rout, « On a bender—BARs, ESCRTs, COPs, and finally getting your coat », Jouornal of Cell Biology, vol. 193, no 6, , article no 963 (PMID 21670211, PMCID 3115789, DOI 10.1083/jcb.201102042, lire en ligne)
- (en) Bostjan Kobe et Andrey V. Kajava, « When protein folding is simplified to protein coiling: the continuum of solenoid protein structures », Trends in Biochemical Sciences, vol. 25, no 10, , p. 509-515 (PMID 11050437, DOI 10.1016/S0968-0004(00)01667-4, lire en ligne)
- (en) Frank Alber, Svetlana Dokudovskaya, Liesbeth M. Veenhoff, Wenzhu Zhang, Julia Kipper, Damien Devos, Adisetyantari Suprapto, Orit Karni-Schmidt, Rosemary Williams, Brian T. Chait, Andrej Sali et Michael P. Rout, « The molecular architecture of the nuclear pore complex », Nature, vol. 450, no 7170, , p. 695-701 (PMID 18046406, DOI 10.1038/nature06405, Bibcode 2007Natur.450..695A, lire en ligne)
- (en) Damien Devos, Svetlana Dokudovskaya, Frank Alber, Rosemary Williams, Brian T. Chait, Andrej Sali et Michael P. Rout, « Components of Coated Vesicles and Nuclear Pore Complexes Share a Common Molecular Architecture », PLoS One, vol. 1, no 12, , article no e380 (PMID 15523559, PMCID 548957, DOI 10.1371/journal.pbio.0020380, lire en ligne)
- (en) Wolfram Antonin et Iain W. Mattaj, « Nuclear pore complexes: Round the bend? », Nature Cell Biology, vol. 7, no 1, , p. 10-12 (PMID 15632943, DOI 10.1038/ncb0105-10, lire en ligne)
- (en) Rachel Santarella-Mellwig, Josef Franke, Andreas Jaedicke, Matyas Gorjanacz, Ulrike Bauer, Aidan Budd, Iain W. Mattaj et Damien P. Devos, « The Compartmentalized Bacteria of the Planctomycetes-Verrucomicrobia-Chlamydiae Superphylum Have Membrane Coat-Like Proteins », PLoS Biology, vol. 8, no 1, , article no e1000281 (PMID 20087413, PMCID 2799638, DOI 10.1371/journal.pbio.1000281, lire en ligne)
- (en) Changwook Lee et Jonathan Goldberg, « Structure of Coatomer Cage Proteins and the Relationship among COPI, COPII, and Clathrin Vesicle Coats », Cell, vol. 142, no 1, , p. 123-132 (PMID 20579721, PMCID 2943847, DOI 10.1016/j.cell.2010.05.030, lire en ligne)
- (en) Jade K. Forwood, Allison Lange, Ulrich Zachariae, Mary Marfori, Callie Preast, Helmut Grubmüller, Murray Stewart, Anita H. Corbett et Bostjan Kobe, « Quantitative Structural Analysis of Importin-β Flexibility: Paradigm for Solenoid Protein Structures », Structure, vol. 18, no 9, , p. 1171-1183 (PMID 20826343, DOI 10.1016/j.str.2010.06.015, lire en ligne)
- (en) Jun Katahira et Yoshihiro Yoneda, « Nucleocytoplasmic Transport of MicroRNAs and Related Small RNAs », Traffic, vol. 12, no 11, , p. 1468-1474 (PMID 21518166, DOI 10.1111/j.1600-0854.2011.01211.x, lire en ligne)
- (en) Alice Barkan,Margarita Rojas, Sota Fujii, Aaron Yap, Yee Seng Chong, Charles S. Bond et Ian Small, « A Combinatorial Amino Acid Code for RNA Recognition by Pentatricopeptide Repeat Proteins », PLoS Genetics, vol. 8, no 8, , article no e1002910 (PMID 22916040, PMCID 3420917, DOI 10.1371/journal.pgen.1002910, lire en ligne)
- (en) Alice Barkan et Ian Small, « Pentatricopeptide Repeat Proteins in Plants », Annual Review of Plant Biology, vol. 65, , p. 415-442 (PMID 24471833, DOI 10.1146/annurev-arplant-050213-040159, lire en ligne)
- (en) Alison Grinthal, Ivana Adamovic, Beth Weiner, Martin Karplus et Nancy Kleckner, « PR65, the HEAT-repeat scaffold of phosphatase PP2A, is an elastic connector that links force and catalysis », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 6, , p. 2467-2472 (PMID 20133745, PMCID 2823866, DOI 10.1073/pnas.0914073107, JSTOR 40536608, Bibcode 2010PNAS..107.2467G, lire en ligne)