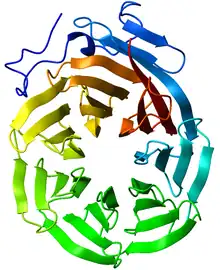
Beta-propeller
En biologie structurelle, un β-propeller est une structure tertiaire de certaines protéines caractérisée par l'arrangement de quatre à huit feuillets β en forme de lame autour d'un axe central selon une configuration toroïdale. Chaque feuillet β est typiquement formé de quatre brins β antiparallèles tordus de telle sorte que les premier et dernier brins sont presque perpendiculaires l'un à l'autre. Une étude visant à établir les principes structuraux des β-propellers a montré que la structure à sept lames est la plus favorable d'un point de vue géométrique[2].
Exemples
Par exemple, la neuraminidase virale des virus de la grippe est une protéine à β-propeller à six lames dont la forme active est un tétramère. C'est l'une des deux protéines de l'enveloppe virale, qui catalyse le clivage de molécules d'acide sialique à partir de protéines de la membrane plasmique de cellules saines pour y faciliter l'entrée de nouveaux virions.
La protéine UVR8 (en) des plantes, qui détecte les UV-B possède un β-propeller à sept lames dimérisé qui se dissocie à la suite de l'absorption d'UV-B.
Les répétitions WD40, également appelées répétitions β-transducine, sont de courts fragments présents avant tout chez les eucaryotes[3] - [4]. Elles sont souvent assemblées en unités de quatre à seize répétitions en tandem pour former un domaine structurel critique pour les interactions protéine-protéine.
Un β-propeller du récepteur de LDL constitue un composant critique de cette protéine et intervient dans un changement conformationnel induit par une variation de pH : à pH neutre, la protéine présente une conformation linéaire étirée qui lui permet de se lier à des ligands (PCSK9) ; à pH faible (acide), la conformation linéaire évolue vers une formation en épingle à cheveux dont le β-propeller bloque la liaison aux ligands[5] - [6].
Notes et références
- (en) Elizabeth R. Sprague, Michael J. Redd, Alexander D. Johnson et Cynthia Wolberger, « Structure of the C-terminal domain of Tup1, a corepressor of transcription in yeast », The EMBO Journal, vol. 19, no 12, , p. 3016-3027 (PMID 10856245, PMCID 203344, DOI 10.1093/emboj/19.12.3016, lire en ligne)
- (en) Alexey G. Murzin, « Structural principles for the propeller assembly of β-sheets: The preference for seven-fold symmetry », Proteins, vol. 14, no 2, , p. 191-201 (PMID 1409568, DOI 10.1002/prot.340140206, lire en ligne)
- (en) Eva J. Neer, Carl J. Schmidt, Raman Nambudripad et Temple F. Smith, « The ancient regulatory-protein family of WD-repeat proteins », Nature, vol. 371, no 6495, , p. 297-300 (PMID 8090199, DOI 10.1038/371297a0, lire en ligne)
- (en) Temple F. Smith, Chrysanthe Gaitatzes, Kumkum Saxena et Eva J. Neer, « The WD repeat: a common architecture for diverse functions », Trends in Biochemical Sciences, vol. 24, no 5, , p. 181-185 (PMID 10322433, DOI 10.1016/S0968-0004(99)01384-5, lire en ligne)
- (en) Da-Wei Zhang, Rita Garuti, Wan-Jin Tang, Jonathan C. Cohen et Helen H. Hobbs, « Structural requirements for PCSK9-mediated degradation of the low-density lipoprotein receptor », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 35, , p. 13045-13050 (PMID 18753623, PMCID 2526098, DOI 10.1073/pnas.0806312105, lire en ligne)
- (en) D. John Betteridge, « Cardiovascular endocrinology in 2012: PCSK9—an exciting target for reducing LDL-cholesterol levels », Nature Reviews, vol. 9, no 2, , p. 76-78 (PMID 23296165, DOI 10.1038/nrendo.2012.254, lire en ligne)