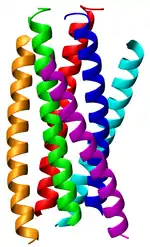
Superhélice
Une superhélice, ou coiled coil, est un motif structurel de protéines dans lequel de deux à sept[3] hélices α sont enroulées ensemble les unes autour des autres — les dimères et les trimères sont les structures les plus fréquentes. Des protéines présentant ce type de structures sont impliquées dans des fonctions biologiques importantes, par exemple les facteurs de transcription dans l'expression génétique. Les oncoprotéines c-Fos et c-Jun (en), de même que la tropomyosine, sont des exemples notables de telles protéines.
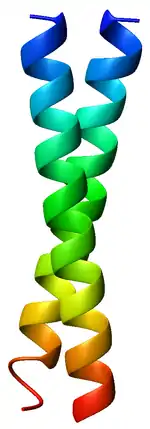
Les structures en superhélices contiennent généralement des motifs répétés de sept résidus — heptade répétée — de la forme hxxhcxc, constitués de résidus d'acides aminés hydrophobes (h) et électriquement chargés (c) séparés par des résidus variables (x)[4]. Les positions des résidus dans ce motif répété sont généralement notés abcdefg, où a et d sont les positions occupées par des acides aminés hydrophobes, souvent l'isoleucine, la leucine ou la valine. Lorsque cette séquence est enroulée en une hélice α, ces résidus hydrophobes s'alignent en une bande formant elle-même une hélice gauche autour de l'hélice α. Il en résulte une structure amphiphile qui, dans le cytoplasme d'une cellule, tend à dimériser de telle sorte que deux hélices α s'enroulent l'une autour de l'autre en mettant en contact leurs résidus hydrophobes respectifs[5]. Le contact entre les deux hélices α est particulièrement étroit, les chaînes latérales des résidus a et d établissant presque toutes les interactions de van der Waals possibles. Cet empilement étroit avait été initialement prédit par Francis Crick en 1952 et est appelé empilement « bosses dans creux » (knobs into holes)[6]. Les hélices α peuvent être parallèles ou antiparallèles, et forment généralement une superhélice gauche. Quelques superhélices droites ont également été observées dans la nature et dans des protéines synthétiques[7].
Rôle des superhélices dans l'infection à VIH
La pénétration du virus de l'immunodéficience humaine (VIH) dans les lymphocytes T auxiliaires commence avec la liaison de trois sous-unités de la glycoprotéine gp120 au récepteur CD4 et à un corécepteur. La glycoprotéine gp120 est étroitement associée à un trimère de glycoprotéines gp41 (en) par des forces de van der Waals. La liaison de la gp120 au récepteur CD4 et au corécepteur induit un ensemble de modifications conformationnelles qui conduisent à la dissociation de la gp120, à l'exposition de la gp41 et à l'ancrage de l'extrémité N-terminale de cette dernière dans la cellule hôte. Un mécanisme à ressort met en contact la membrane plasmique avec l'enveloppe virale afin qu'elles fusionnent. Ce mécanisme à ressort est constitué par la glycoprotéine gp41 qui possède deux heptades répétées au niveau de l'extrémité N-terminale (HR1) et de l'extrémité C-terminale (HR2). La région HR1 forme une superhélice trimérique parallèle sur laquelle s'enroule la région HR2 en formant un trimère d'épingles à cheveux à six hélices qui provoque la fusion des deux membranes. Le virus peut alors pénétrer dans la cellule cible et y commencer à se répliquer.
Notes et références
- (en) Lino Gonzalez Jr., Derek N. Woolfson et Tom Alber, « Buried polar residues and structural specificity in the GCN4 leucine zipper », Nature Structural Biology, vol. 3, no 12, , p. 1011-1018 (PMID 8946854, DOI 10.1038/nsb1296-1011, lire en ligne)
- (en) David C. Chan, Deborah Fass, James M. Berger et Peter S. Kim, « Core Structure of gp41 from the HIV Envelope Glycoprotein », Cell, vol. 89, no 2, , p. 263-273 (PMID 9108481, DOI 10.1016/S0092-8674(00)80205-6, lire en ligne)
- (en) Jie Liu, Qi Zheng, Yiqun Deng, Chao-Sheng Cheng, Neville R. Kallenbach et Min Lu, « A seven-helix coiled coil », Proceedings of the National Academy of Sciences of the United States of America, vol. 103, no 42, , p. 15457-15462 (PMID 17030805, PMCID 1622844, DOI 10.1073/pnas.0604871103, lire en ligne)
- (en) Jody M. Mason et Katja M. Arndt, « Coiled Coil Domains: Stability, Specificity, and Biological Implications », ChemBioChem, vol. 5, no 2, , p. 170-176 (PMID 14760737, DOI 10.1002/cbic.200300781, lire en ligne)
- (en) Israel Hanukoglu et Liora Ezra, « Proteopedia entry: Coiled-coil structure of keratins », Biochemistry and Molecular Biology Education, vol. 42, no 1, , p. 93-94 (PMID 24265184, DOI 10.1002/bmb.20746, lire en ligne)
- (en) F. H. C. Crick, « Is α-Keratin a Coiled Coil? », Nature, vol. 170, no 4334, , p. 882-883 (PMID 13013241, DOI 10.1038/170882b0, lire en ligne)
- (en) Pehr B. Harbury, Joseph J. Plecs, Bruce Tidor, Tom Alber et Peter S. Kim, « High-Resolution Protein Design with Backbone Freedom », Science, vol. 282, no 5393, , p. 1462-1467 (PMID 9822371, DOI 10.1126/science.282.5393.1462, lire en ligne)