Production de l'aluminium par électrolyse
La production de l'aluminium par électrolyse est le procédé qui permet de fabriquer le métal aluminium à partir de l'alumine extraite de la bauxite. Le procédé a été inventé simultanément par Paul Héroult en France et Charles Martin Hall aux États-Unis en 1886, et il est couramment appelé « procédé Hall-Héroult[1] ». Il permet la production de l'aluminium[2] dit « primaire », l'aluminium « secondaire »[3] étant issu du recyclage. Les deux scientifiques sont souvent désignés comme les « jumeaux de l'aluminium ».
Principe
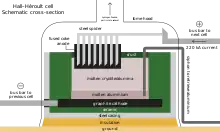
L'alumine est dissoute dans un bain fluoré d'électrolyse entre 950 °C et 1 000 °C suivant la réaction (simplifiée) suivante :
Suivant le principe de l'électrolyse, un courant électrique continu circule entre l'anode (pôle +) et la cathode (pôle -). L’aluminium se forme à la cathode, où il entre en coalescence dans une nappe d’aluminium liquide, selon la réaction :
En pratique, il faut plusieurs milliers d'ampères pour produire une quantité significative d'aluminium : environ 7,65 kg d'aluminium par cellule par jour et par millier d'ampères.
À l’anode en carbone, le dioxyde de carbone gazeux se dégage sous forme de grosses bulles qui s’échappent dans l’atmosphère :
La réaction globale s'écrit :
Le bain est ici considéré comme un électrolyte dans lequel se dissout l'alumine et ne tient aucun rôle dans les réactions.
Détail
Bain d'électrolyse
La cryolithe est un composé défini de NaF (60 %pds) et AlF3 (40 %pds). Il existe deux types de bains cryolithiques :
- les bains basiques, mélanges de cryolithe et de NaF (NaF>60 % et AlF3 < 40 %pds) ;
- les bains acides, mélanges de cryolithe et d'AlF3 (NaF<60 % et AlF3 > 40 %pds).
Cette acidité en sel fondu est une acidité au sens de Lewis. Selon Lewis, un acide possède un atome susceptible de se fixer sur un doublet électronique libre alors qu'une base de Lewis est une espèce chimique possédant un doublet libre (aussi appelé doublet non liant). Ici la molécule acide est le fluorure d'aluminium AlF3. On y définit aussi un pF=–log([F−]) par analogie au pH ou pOH. Les professionnels parlent en termes de cryolithe ratio (CR=NaF(%mol)/AlF3(%mol)) ou bath ratio (BR).
Le bain d'électrolyse est constitué principalement :
- d'un fluorure d'aluminium et de sodium : la cryolithe. Elle représente environ 80 % de la masse du bain d'électrolyse. La cryolite a comme composition : (AlF3, 3NaF). Initialement extraite au Groenland elle est désormais en majorité synthétique. La cryolithe a son point de fusion à 1 010 °C ;
- en fonction de l'acidité : du fluorure d'aluminium AlF3 ou de sodium NaF. Représente environ 10 % de la masse du bain d'électrolyse ;
- du fluorure de calcium : CaF2 qui est pratiquement inerte mais baisse les pressions partielles des composés du bain d'où une diminution de l'évaporation du bain et une minimisation de l'insertion de sodium dans la cathode. Représente environ 5 % de la masse du bain d'électrolyse.
La composition ionique du bain serait donc : Na+, F−, AlF3, AlF4−, et AlxOyFz3x-2y-z.
Étant donné que tous les composants de l'électrolyte sont (sans exceptions) ioniques et complexes il n'existe pas de théorie permettant la description des composants du bain. Pourtant les spécialistes utilisent la formule AlXOYFZ3x-2y-z plus proche de la réalité qu'Al3+, O2− et F−.
Un point important dans la composition du bain est sa densité. La densité du bain est en général proche de 2 ce qui permet de faire couler au fond de la cellule l'aluminium métal de densité 2,3 sous la forme liquide à la température d'électrolyse.
Réactions à l'anode
Il existe deux types de cuves électrolytiques. Celle présentée dans la figure ci-dessus est appelée cuve à anodes précuites, désormais ce type de cuve est majoritaire. L'autre type de cuve est appelé cuve Söderberg dans laquelle la cuisson de l'anode se fait in situ. Cette cuve est de moins en moins utilisée car en plus de polluer, elle génère de moins bons rendements. L'anode est en carbone. Elle est fabriquée à l'aide de coke de pétrole calciné (coke de brai) et brai de houille.
À l'anode, se produit la réaction suivante :
La réaction secondaire suivante est :
Une réaction néfaste pour la cellule et l'environnement a lieu lorsque l'alumine vient à manquer dans la cellule. Cette réaction est néfaste car elle génère des fluorures de carbone, gaz qui détruisent la couche d'ozone et contribuent à l'effet de serre. Ils ne doivent pas être confondus avec les rejets de fluor, rapidement transformé en acide fluorhydrique, dus à l'évaporation partielle des éléments du bain à la température du procédé. Ces rejets fluorés provoquaient autrefois — avant le captage de la majorité des gaz en usine — la maladie de la fluorose chez les animaux par substitution de l'hydroxyapatite des os en fluoroapatite.
Cette réaction est également néfaste pour la cellule car elle génère un gaz bloquant l'anode en s'y fixant (à la différence du CO2), le passage du courant est altéré et génère alors une surchauffe par effet Joule. Cette réaction est la suivante :
Réactions à la cathode
Le pôle négatif de la cellule est en carbone. Ce bloc de carbone est en permanence recouvert d'aluminium liquide, l'ensemble bloc et métal liquide constitue la cathode en fond de creuset. Les bordures latérales du creuset, en graphite ou en carbure de silicium, sont protégées par du bain figé qui l'isole thermiquement et limite son usure (non représenté sur le schéma ci-dessus), ce bain figé est appelé talus.
À la cathode, se produisent les réactions électrochimiques suivantes :
- réaction primaire :
- réactions secondaires :
les produits de ces deux réactions provoquent l'endommagement progressif de la cathode. Le sodium en s'insérant la fait gonfler, fléchir puis fissurer. Les carbures d'aluminium solubles partent en solution et érodent le bloc. Il faut donc périodiquement — environ tous les cinq ans — remplacer les cathodes qui constituent le fond de la cuve d'électrolyse : c'est l'opération de « rebrasquage ».
Sous l'effet de la force de Laplace, l'aluminium métal se met en mouvement, les vagues de métal liquide ainsi provoquées peuvent, si elles sont excessives, provoquer des courts-circuits en allant toucher l'anode, générant par là des instabilités de conduite de procédé. Le brassage de l'aluminium dû à ces vagues contribue également à sa diffusion dans la nappe de bain situé au-dessus, il est alors immédiatement réoxydé en alumine et le rendement de la réaction s'en trouve réduit d'autant. Les concepteurs des cuves d'électrolyse disposent judicieusement les conducteurs de courant connectés à la cuve pour minimiser ces effets indésirables, grâce au respect de règles d'équilibrage électriques et magnétiques. Les modèles appliqués sont fort complexes et font appel à l'électro-magnéto-hydrodynamique.
L'aluminium liquide est régulièrement pompé par aspiration dans une poche mise sous vide partiel (sans en retirer la totalité). L'aluminium est ensuite transporté dans des fours de maintien pour en ajuster la composition, et le rendre conforme aux spécifications du client, puis il est solidifié sous des formes variées selon l'application finale. Cela peut être des lingots destinés à la refusion en vue de préparation d'alliages de fonderie, des billettes destinées à l'extrusion (obtention de profilés), des plaques destinées au laminage (tôles, boîte boisson…) ou encore du fil.
Aspects technologiques
Pour produire une tonne d’aluminium, la réaction requiert 0,415 tonne de carbone, 1,920 tonne d’alumine tandis que 1,520 tonne de dioxyde de carbone est produite par la seule combustion des anodes. Le chauffage de la cellule, appelée aussi cuve d'électrolyse, est entièrement généré par effet Joule.
La cuve d'électrolyse se compose des éléments suivants :
- un caisson en acier ;
- un garnissage isolant thermique constitué de briques réfractaires ;
- un creuset polarisé cathodiquement constitué d'un assemblage de blocs de carbone cuits à base d'anthracite et liés par une pâte carbonée appelée pâte de brasque ;
- des barres d'acier traversant le caisson et permettant la sortie (pôle négatif) du courant à la cathode ;
- des ensembles anodiques constitués de tiges verticales en aluminium, fixées sur des pattes en acier qui sont scellées à la fonte sur les blocs de carbone ;
- une superstructure en acier, placée au-dessus du caisson et qui soutient les ensembles anodiques au-dessus du bain électrolytique ;
- un ensemble de conducteurs en aluminium qui transportent le courant de la cathode de la cuve précédente de la série de cuves vers l'anode de la cuve suivante ;
- un système d'aspiration des gaz vers la station de traitement ;
- un système d'alimentation en alumine.
La distance entre l’anode et le métal est ajustée par des moteurs qui descendent progressivement les anodes en fonction de leur consommation par la réaction électrochimique. Par ailleurs, deux opérations principales sont effectuées régulièrement :
- le soutirage de l’aluminium, qui s’effectue par aspiration dans une poche de coulée grâce à un tuyau en fonte plongé dans la couche de métal liquide ;
- le remplacement des anodes consommées, chaque anode est conservé durant environ 25 jours.
De manière à assurer la qualité de la production, de nombreux contrôles sont effectués : mesure de la hauteur de métal et de bain, prélèvement et analyse du métal, suivi de la température et des paramètres électriques. Une régulation automatisée des paramètres de marche a permis d’améliorer grandement le rendement du procédé et de réduire les émissions de gaz a effet de serre.
Les cuves modernes sont constituées d’une vingtaine d’anodes soumises à une densité de courant de 0,8 A/cm2. Pour des raisons économiques liées à la préparation du courant continu de forte intensité à partir du courant disponible en mode alternatif sous forte tension, le même circuit électrique alimente plusieurs cuves placées électriquement en série. L'ensemble est de ce fait appelé par la profession « série d'électrolyse ». La série de cuves est généralement disposée en deux rangées parallèles (de parfois 2 × 200 cuves), dans deux halls de 1 km de long, séparés et éloignés de 50 à 100 m.
La sous-station électrique qui transforme le courant alternatif (plus de 200 kV) en courant continu (par exemple 1 800 V - 360 000 A), est constituée de plusieurs unités placées en parallèle, chacune capable de livrer un courant d'environ 100 000 A. Le principe est basé sur l'emploi de diodes, plus rarement de thyristors. Le courant produit doit être stable ; pour ce faire il est mesuré précisément (sondes à effet Hall) et régulé. Enfin, au vu des puissances en jeu et des risques d'ouverture de circuit sur une cellule d'électrolyse (anodes qui ne sont plus immergées dans le bain électrolytique pour des raisons accidentelles), la sous-station est munie de moyens de surveillance et de déclenchement rapides.
Une cuve de 360 000 A produit environ 1 000 t d'aluminium par an. Une série de 360 cuves à 360 000 A (technologie de 2008) produit 360 000 t d'aluminium par an. La construction d'une usine de cette taille représente en 2012 un investissement d'environ 1,5 à 2 milliards de dollars selon la zone du projet.
Aspects énergétiques
À l'origine, les cuves (les marmites) avaient une intensité de 5 000 à 6 000 A pour une tension de 6 à 7 V. Actuellement (cas de l'usine Liberty Aluminium Dunkerque de Dunkerque), les cuves ont une intensité de 350 000 A pour une tension de 4,20 V. Seul 1,18 V est théoriquement nécessaire à la réaction, le reste est dû aux surtensions électrochimiques ainsi qu'à la chute ohmique dans l'électrolyte, les électrodes et les conducteurs[4].
Le rendement Faraday (rapport de la masse d'aluminium produite à la masse d'aluminium théoriquement déposable) est de l'ordre de 95 % : 95 % de l'électricité « utile » sert à la production et 5 % est perdu dans les réactions secondaires, dont principalement :
Cette réaction est possible car anode et cathode ne sont distantes que de quelques centimètres, ce qui peut entrainer un contact entre une bulle de CO2 et le métal mais aussi parce que l'aluminium métal se dissout à raison de 0,01 %pds dans le bain.
5,64 MWh d’énergie électrique sont théoriquement nécessaires pour fabriquer une tonne d’aluminium. Cependant, l’énergie consommée est d’environ 13,5 MWh/t, du fait d’une dissipation de l’énergie par effet Joule. Ce dégagement de chaleur suffit à maintenir la température du bain aux alentours de 960 °C, mais implique également un faible rendement énergétique global, de l’ordre de 50 %.
Pour une usine d’électrolyse contenant 360 cuves alimentées par 360 000 A sous une tension de 4,25 V, le générateur d'énergie doit fournir plus de 560 MW. En y ajoutant les auxiliaires, notamment la cuisson des anodes et la fonderie, une usine doit donc disposer d’une puissance de près de 600 MW, ce qui est considérable. Ceci représente environ la moitié de la puissance d'une tranche de centrale nucléaire. L'installation d'une usine de production d'aluminium se fait généralement à proximité d'une centrale électrique : historiquement dans les massifs montagneux pour leur barrages hydrauliques (France, Suisse, Écosse, etc.), dorénavant près des gisements de gaz (Bahreïn, Qatar, Oman, Dubaï, Abou Dabi, Iran, etc.), de charbon (Afrique du Sud, Australie, Inde, Chine, etc.) ou d'autres ressources hydrauliques (États-Unis, Canada, Russie, Brésil, Indonésie, Amérique du Sud, Cameroun).
Aspects environnementaux
Comme tout procédé métallurgique, la production de l’aluminium génère des émissions gazeuses et des déchets en quantité importante, qui produisent des effets néfastes sur l’environnement et qu'il convient de contrôler autant que faire se peut.
Traitement des résidus et des fumées
Les blocs cathodiques contiennent des fluorures et des cyanures et constituent des déchets dangereux. Ces matériaux ainsi que les réfractaires les accompagnant sont soit recyclés au travers de filières contrôlées (recyclage généralement privilégié par les autorités européennes), soit stockés pour traitement de neutralisation puis mise en décharge.
Les sels constituants l’électrolyte, ainsi que les résidus d’anodes, sont eux presque intégralement recyclés.
Le problème de l’épuration des gaz d’électrolyse a pris de l’importance dans les années 1950-1970 avec les augmentations de capacité des usines d’électrolyse, quand il est apparu que les rejets, sous forme de fluor particulaire et de fluor gazeux (principalement le fluorure d’hydrogène HF), causaient des dégâts à proximité des usines. Initialement neutralisés par voie dite humide dans des tours de lavage afin de précipiter le fluor sous forme de fluorure de calcium (CaF2); les gaz sont depuis les années 1970 traités par voie dite sèche, à savoir l'adsorption du fluor sur l'alumine qui ira alimenter les cellules d'électrolyse, là même où le fluor a été émis. Ce principe est remarquablement efficace (plus de 98 %) et contribue à la performance du procédé.
Les émissions d’oxyde de soufre (SO2) et d’hydrocarbures polyaromatiques (HAP) provenant de la préparation et de la combustion des anodes sont également sources de pollution. La dégradation de la qualité des matières premières carbonées, dont la teneur en soufre augmente au fil des ans, ainsi que l'évolution des réglementations, conduisent pour les usines de dernière génération à installer des unités de traitement du dioxyde de soufre, en série avec le traitement du fluor.
Émission de gaz à effet de serre
Les problèmes environnementaux induits par le dégagement massif de CO2 et, dans une moindre mesure de perfluorocarbures (PFC), dans l’atmosphère représentent une préoccupation assez récente liée au procédé Hall-Héroult, depuis qu’il est avéré que ces gaz à effet de serre participent au réchauffement climatique. Les mesures établies en 1997 par le protocole de Kyoto tendent à instaurer des quotas d’émissions et concernent donc l’industrie de l’aluminium.
La réaction d’électrolyse produit des quantités importantes de dioxyde de carbone : la production annuelle d’aluminium (38 millions de tonnes) aboutit au dégagement dans l’atmosphère d’environ 78 millions de tonnes de dioxyde de carbone. Le tétrafluorométhane (CF4(g)) et l’hexafluoroéthane (C2F6(g)) sont la deuxième classe de gaz à effet de serre produits par le procédé. Ces PFC sont produits lors de l’effet d’anode, à raison d’environ 1 kg de CF4 par tonne d’aluminium. D’une stabilité de l’ordre de plusieurs milliers d’années, ces composés absorbent dix mille fois plus le rayonnement infrarouge que le dioxyde de carbone. Le pouvoir réchauffant du CF4 vaut 6 630 fois celui du CO2 à horizon de 100 ans[5]. Ils ne se forment pas dans la nature et l’industrie de l’aluminium en est la première source dans le monde. Seule une amélioration dans la gestion du procédé semble pouvoir permettre de supprimer les émissions. L'utilisation d'anodes inertes pourrait fortement faire diminuer les émissions de gaz à effet de serre, mais le procédé consomme environ 80 % d'énergie en plus[6].
Par ailleurs, la production de l'électricité nécessaire au procédé représente indirectement une source de production importante de gaz à effet de serre, puisque près d’un tiers de l’électricité produite pour l’industrie de l’aluminium provient de centrales à charbon. Au niveau mondial, 70 % des gaz à effet de serre (en équivalent CO2) émis pour la production de l’aluminium proviennent de la combustion des énergies fossiles destinées à la production d’électricité pour les différentes opérations du procédé (production de l’alumine, confection des anodes, électrolyse). La réduction des émissions passe donc également par une modification des moyens de production de l’énergie.
Un point positif cependant : l'aluminium ne demande que très peu d'énergie pour être recyclé (énergie de refusion relativement faible) ; il contribue de par son ratio résistance/poids à la réduction de la consommation énergétique des systèmes de transport (terre, air, mer). De ce fait, au terme de quelques cycles de vie, il contribue in fine à la maîtrise des rejets de dioxyde de carbone.
Deux destins communs, deux hommes différents
Au-delà des deux hommes ayant inventé la même année la production de l'aluminium par électrolyse, et ce de manière indépendante, un fait aussi surprenant est qu'ils sont nés et morts la même année, en 1863 et 1914. Il semblerait même que les deux scientifiques aient lu au même âge, à quinze ans, le même ouvrage de l'auteur Henri Sainte-Claire Deville traitant de l'aluminium (De l'aluminium, ses propriétés, sa fabrication et ses applications, 1859)[7]. Toutes ces ressemblances leur ont valu le nom de « jumeaux de l'aluminium »[8].
Bien qu'ils eussent beaucoup de similitudes entre eux, Héroult et Hall étaient distincts par leur différente nature, mais aussi leur éducation et même leur comportement. Au-delà du fait qu'ils aient inventé tous les deux le procédé de l'aluminium par électrolyse, il n'en demeure pas moins qu'ils l'ont développé de manière différente, en termes de composition de bain de l'électrolyse et de conception de cellule. Hall était chimiste au contraire de Héroult, ce qui constituait un certain handicap pour ce dernier pour développer une méthodologie adéquate. Mais Héroult était aussi un expérimentateur imaginatif, et après avoir passé une année à l'École des Mines à Paris où par ailleurs il rencontra le fameux professeur et chimiste Henry Le Chatelier, il s'orienta plus vers la technologie. Il comprit par exemple que la cryolithe constituait le meilleur composant pour le bain électrolytique. Ensuite, il se focalisa sur la cuve où il réussit à augmenter la dimension de l'anode et ainsi à diminuer la densité anodique. De son côté, Hall se focalisa sur le problème de la composition du bain et consacra beaucoup plus de temps à expérimenter divers mélanges avec de nombreux fluorures, ce qui n'était pas tellement approprié compte tenu de leurs hautes acidités et densités[8].
Notes et références
- Ivan Grinberg et Jean Plateau, « Le brevet de Paul Héroult pour un procédé électrolytique de préparation d’aluminium », Bibnum. Textes fondateurs de la science, (ISSN 2554-4470, lire en ligne, consulté le )
- « Aluminium », sur L’Élémentarium (consulté le )
- « Le recyclage de l'aluminium | Centre d'expertise sur l'aluminium - CeAl », sur CEAL - AluQuébec, (consulté le )
- (en) Kvande, Halvor et Warren Haupin, Inert anodes for AI smelters: Energy balances and environmental impact, Jom 53.5 (2001), 29-33.
- (en) « Global Warming Potentials (IPCC Second Assessment Report) », sur UNFCCC (consulté le ).
- Sébastien Helle, Développement de matériaux d'anodes inertes pour la production d'aluminium (thèse de doctorat en sciences de l'énergie et des matériaux), Université du Québec - INRS (Énergie, matériaux et télécommunications), (lire en ligne [PDF]), p. 19
- Lescale, 1986, p. 130 ; Caron, 1988, p. 40.
- (en) Maurice Laparra, The Aluminium False Twins. Charles Martin Hall and Paul Héroult’s First Experiments and Technological Options, Cahiers d'histoire de l'aluminium, (lire en ligne).
Articles connexes
- Liste de producteurs d'aluminium
- Statistiques de production
- Découverte du procédé d'électrolyse par Charles Martin Hall et Paul Héroult
- Découvertes scientifiques simultanées










