Porphobilinogène synthase
La porphobilinogène synthase est une lyase qui catalyse la réaction :
- 2 δ-aminolévulinate porphobilinogène + 2 H2O.
| Porphobilinogène synthase | ||
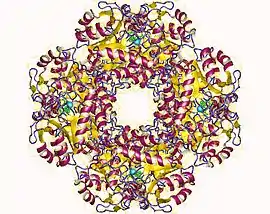 Octamère de porphobilinogène synthase d'érythrocyte humain (PDB 1E51) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Aminolevulinate Dehydratase | |
| Symbole | ALAD | |
| N° EC | 4.2.1.24 | |
| Homo sapiens | ||
| Locus | 9q32 | |
| Masse moléculaire | 36 295 Da[1] | |
| Nombre de résidus | 330 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Cette enzyme intervient à la deuxième étape de la biosynthèse de la porphyrine, et catalyse la première des réactions communes à la biosynthèse de tous les tétrapyrroles biologiques, qu'il s'agisse des hèmes, des chlorophylles et de la vitamine B12.
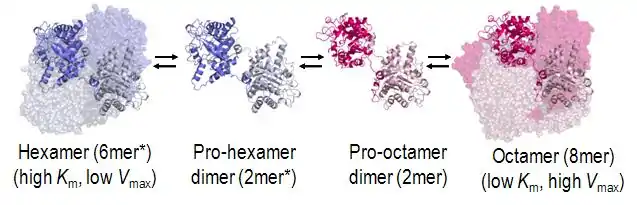
Régulation allostérique de type morphéine
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
La porphobilinogène synthase est régulée allostériquement à la manière d'une morphéine, mode de régulation dont elle constitue l'exemple type[2]. En effet, sa structure quaternaire est à l'équilibre entre octamères actifs et hexamères inactifs via des dimères susceptible de changer de conformation afin de favoriser l'une ou l'autre structure quaternaire. La structure tertiaire de chaque monomère est susceptible de basculer entre deux formes définies par l'orientation de deux domaines de chaque sous-unité, l'une de ces formes favorisant la constitution d'octamères tandis que l'autre forme favorise la constitution d'hexamères ; le passage d'une forme à l'autre n'est possible que dans les dimères et reste bloquée dans les hexamères et les octamères.
Chez l'homme, la porphobilinogène synthase est codée par le gène ADAL, situé sur le chromosome 9. Elle contient 330 résidus d'acides aminés avec un bras N-terminal d'environ 25 résidus et, en son centre, un site actif situé dans un tonneau TIM. La régulation allostérique de l'enzyme peut être décrite en fonction de l'orientation du bras N-terminal par rapport au tonneau TIM.
Chaque bras N-terminal peut interagir avec au plus deux autres sous-unités dans une configuration multimérique. L'une de ces interactions stabilise le rabat du site actif en conformation « fermée » tandis que l'autre restreint l'accès du solvant de l'autre côté du tonneau TIM. Dans l'état multimérique inactif, le bras N-terminal ne stabilise pas le rabat du site actif et les données obtenues par cristallographie aux rayons X montrent que le rabat du site actif est distordu.
Régulateurs allostérique
La porphobilinogène synthase est une enzyme quasiment universelle, avec un site actif hautement conservé, même entre espèces très éloignées d'un point de vue phylogénétique. En revanche, les sites allostériques sont bien plus variables d'une espèce à l'autre.
Le cation de magnésium Mg2+ et l'hydronium H3O+ sont des régulateurs allostériques qui déplacent l'équilibre entre les formes hexamériques et octamériques de l'enzyme. Ainsi, on a pu montrer que la forme octamérique est favorisée en présence d'ions Mg2+ tandis que la forme hexamérique est favorisée en son absence[3].
Un autre type de régulation intervient avec par exemple de petites molécules qui se logent dans des cavités moléculaires présentes à la surface des hexamères mais absentes de la surface des octamères, ce qui stabilise la forme hexamérique en l'empêchant de redonner des octamères : on désigne ce mode de régulation du terme anglais morphlock, car elle « verrouille » une forme de morphéine au détriment d'une autre[4].
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Eileen K. Jaffe et Sarah H. Lawrence, « Allostery and the dynamic oligomerization of porphobilinogen synthase », Archives of Biochemistry and Biophysics, vol. 519, no 2, , p. 144-153 (PMID 22037356, PMCID 3291741, DOI 10.1016/j.abb.2011.10.010, lire en ligne)
- (en) Sabine Breinig, Jukka Kervinen, Linda Stith, Andrew S. Wasson, Robert Fairman, Alexander Wlodawer, Alexander Zdanov et Eileen K. Jaffe, « Control of tetrapyrrole biosynthesis by alternate quaternary forms of porphobilinogen synthase », Nature Structural & Molecular Biology, vol. 10, no 9, , p. 757-763 (PMID 12897770, DOI 10.1038/nsb963, lire en ligne)
- (en) Sarah H. Lawrence et Eileen K. Jaffe, « Expanding the Concepts in Protein Structure-Function Relationships and Enzyme Kinetics: Teaching using Morpheeins », Biochemistry and Molecula Biology Education, vol. 36, no 4, , p. 274-283 (PMID 19578473, PMCID 2575429, DOI 10.1002/bmb.20211, lire en ligne)