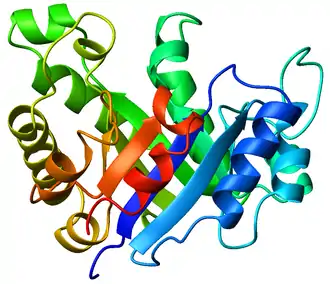
Tonneau TIM
Un tonneau TIM est un motif structurel présent dans un grand nombre de protéines et consistant typiquement en l'alternance de huit hélices α et huit feuillets β le long d'un segment polypeptidique. On parle pour cette raison également de tonneau (β/α)8. Le nom de cette structure provient de la triose-phosphate isomérase, une enzyme de la glycolyse parfois désignée par le trigramme TIM et présente chez un très grand nombre d'espèces, avec une structure très conservée. C'est l'un des motifs structurels les plus courants dans les protéines. L'un des aspects les plus étonnants de cette configuration est qu'elle est observée à l'identique dans de nombreuses protéines dont la séquence ne présente que très peu de similitudes entre elles. Une quinzaine de familles de protéines au moins ont recours à ce type de structure pour assurer la géométrie optimale de leur site actif, toujours situé à l'extrémité C-terminale du huitième feuillet β du tonneau.
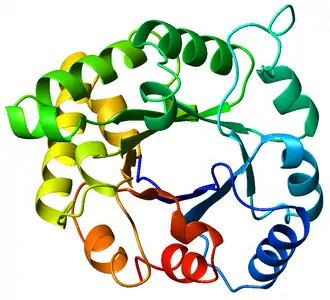
Structure et composition
Les tonneaux TIM sont des repliements α/β dans la mesure où ils sont formés d'hélices α et huit feuillets β dans un seul domaine. Dans de telles structures, les hélices et les feuillets, généralement au nombre de huit chacun, s'organisent en un solénoïde qui se referme sur lui-même pour former un toroïde. Les feuillets β matérialisent la paroi interne de ce toroïde, ce qui forme un tonneau β, tandis que les hélices α forment la paroi externe du toroïde. Chaque feuillet β est lié au feuillet adjacent par une longue boucle formant une hélice droite comprenant une hélice α.
Si la structure des tonneaux TIM représentée par un diagramme en ruban fait apparaître un espace vide au centre du tonneau, cet espace est en réalité largement comblé par les chaînes latérales des résidus d'acides aminés formant la structure. Il s'agit généralement de chaînes latérales hydrophobes volumineuses, et des résidus de glycine sont nécessaires pour laisser suffisamment de marge de manœuvre aux différents segments du motif afin qu'ils s'agencent correctement. Les interactions entre les feuillets et les hélices sont essentiellement des interactions hydrophobes, et les acides aminés ramifiés — isoleucine, leucine et valine — constituent environ 40 % des résidus des feuillets β.
Boucles
Sur les environ 200 résidus nécessaires pour former un tonneau TIM complet, environ 160 sont considérés comme étant structurellement équivalents entre les différentes protéines qui partagent ce motif structurel. La quarantaine de résidus restants est située dans les boucles qui relient les hélices α et les feuillets β. La boucle située près de l'extrémité C-terminale des feuillets tend à contenir le site actif, ce qui est une raison rendant ce motif si courant : les résidus nécessaires au maintien de la structure du tonneau TIM forment un sous-ensemble essentiellement distinct des résidus présents dans les boucles[1]. Les boucles de liaison peuvent en réalité être assez longues pour contenir d'autres domaines protéiques. On a pu montrer que des boucles renfermant des sites catalytiques peuvent être échangés entre enzymes possédant un tonneau TIM, à la façon d'unités fonctionnelles semi-autonomes[2].
Notes et références
- (en) Adrián Ochoa-Leyva, Xavier Soberón, Filiberto Sánchez, Martha Argüello, Gabriela Montero-Morán et Gloria Saab-Rincón, « Protein Design through Systematic Catalytic Loop Exchange in the (β/α)8 Fold », Journal of Molecular Biology, vol. 287, no 4, , p. 949-964 (PMID 19233201, DOI 10.1016/j.jmb.2009.02.022, lire en ligne)
- (en) Adrián Ochoa-Leyva, Francisco Barona-Gómez, Gloria Saab-Rincón, Karina Verdel-Aranda, Filiberto Sánchez et Xavier Soberón, « Exploring the Structure–Function Loop Adaptability of a (β/α)8-Barrel Enzyme through Loop Swapping and Hinge Variability », Journal of Molecular Biology, vol. 411, no 1, , p. 143-157 (PMID 21635898, DOI 10.1016/j.jmb.2011.05.027, lire en ligne)