Morphéine
Le terme de morphéine[1] est parfois utilisé en référence à des protéines pouvant se replier d'au moins deux façons, chacun de ces modes de repliement s'assemblant en un homo-oligomère qui lui est spécifique, le réarrangement d'un oligomère en un autre n'étant possible qu'après la dissociation complète qui permet à chaque monomère de changer son mode de repliement[2] : c'est la conformation des monomères qui détermine l'assemblage en oligomères[3].
Concept

Chaque oligomère est constitué d'un nombre fini de sous-unités et possède donc une stœchiométrie déterminée. L'interconversion des différentes formes des morphéines est possible sous les conditions physiologiques, et il peut s'établir un équilibre entre ces formes d'oligomères.
Ceci peut être illustré en représentant les monomères par des dés pouvant être tantôt cubiques (à six faces), tantôt tétraédriques (à quatre faces), ces dés pouvant s'assembler en mettant en contact leurs faces 1 et 4 : les cubes peuvent ainsi s'assembler en structures de quatre dés (tétramère), tandis que les tétraèdres peuvent s'assembler en structures de cinq dés (pentamère), le passage de l'un à l'autre nécessitant de dissocier entièrement ces structures pour permettre à chaque dé, libéré d'interactions avec ses voisins, de changer individuellement de forme.
Les différents oligomères jouent des rôles physiologiques différents et peuvent être à la base d'une régulation d'activité de type allostérique[3] - [4] - [5] - [6]. Contrairement au cas des prions ou des amyloïdes, il ne s'agit pas de repliements pathologiques s'opposant à des repliements sains. En revanche, une mutation conduisant à la modification de l'équilibre entre les différentes formes d'une morphéine peut être à l'origine d'une maladie conformationnelle[7] semblable aux maladies à prions.
Observations
Ce concept a été introduit au début du siècle pour décrire un mode de régulation allostérique utilisé par certaines enzymes fonctionnant en oligomères actifs[4]. La première de telles enzymes ayant été identifiée avec certitude est la porphobilinogène synthase[3] - [8] - [9]. L'examen de la littérature relative aux enzymes et à leur régulation laisse penser que ce mode de régulation n'est pas isolé.
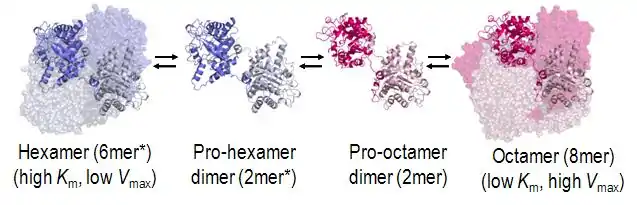 Régulation allostérique de la porphobilinogène synthase, fonctionnant comme une morphéine : l'unité structurelle de l'enzyme est un dimère susceptible de former, selon sa conformation, un octamère actif ou un hexamère inactif (PDB 1PV8[3]).
Régulation allostérique de la porphobilinogène synthase, fonctionnant comme une morphéine : l'unité structurelle de l'enzyme est un dimère susceptible de former, selon sa conformation, un octamère actif ou un hexamère inactif (PDB 1PV8[3]).
Les propriétés des morphéines pourraient être mises à profit pour créer des médicaments[4] - [5].
Notes et références
- Le terme français morphéine est très peu attesté dans la littérature sur ces protéines, qui demeure presque exclusivement en anglais, où elles sont appelées morpheeins. À défaut d'articles publiés, on le rencontre dans le compte-rendu d'un congrès de 2011 et dans un support de cours en français donné en octobre 2015 à l'Université de Montréal.
- (en) Sarah H. Lawrence et Eileen K. Jaffe, « Expanding the concepts in protein structure-function relationships and enzyme kinetics: Teaching using morpheeins », Biochemistry and Molecular Biology Education, vol. 36, no 4, , p. 274-283 (PMID 19578473, PMCID 2575429, DOI 10.1002/bmb.20211, lire en ligne)
- (en) Sabine Breinig, Jukka Kervinen, Linda Stith, Andrew S. Wasson, Robert Fairman, Alexander Wlodawer, Alexander Zdanov et Eileen K. Jaffe, « Control of tetrapyrrole biosynthesis by alternate quaternary forms of porphobilinogen synthase », Nature Structural & Molecular Biology, vol. 10, no 9, , p. 757-763 (PMID 12897770, DOI 10.1038/nsb963, lire en ligne)
- (en) Eileen K. Jaffeemail, « Morpheeins – a new structural paradigm for allosteric regulation », Trends in Biochemical Sciences, vol. 30, no 9, , p. 490-497 (PMID 16023348, DOI 10.1016/j.tibs.2005.07.003, lire en ligne)
- (en) Sarah H. Lawrence, Ursula D. Ramirez, Lei Tang, Farit Fazliyez, Lenka Kundrat, George D. Markham et Eileen K. Jaffe, « Shape Shifting Leads to Small-Molecule Allosteric Drug Discovery », Chemistry & Biology, vol. 15, no 6, , p. 586-596 (PMID 18559269, PMCID 2703447, DOI 10.1016/j.chembiol.2008.04.012, lire en ligne)
- (en) Trevor Selwood et Eileen K. Jaffe, « Dynamic dissociating homo-oligomers and the control of protein function », Archives of Biochemistry and Biophysics, vol. 519, no 2, , p. 131-143 (PMID 22182754, PMCID 3298769, DOI 10.1016/j.abb.2011.11.020, lire en ligne)
- (en) Eileen K. Jaffe et Linda Stith, « ALAD Porphyria Is a Conformational Disease », American Journal of Human Genetics, vol. 80, no 2, , p. 329-337 (PMID 17236137, PMCID 1785348, DOI 10.1086/511444, lire en ligne)
- (en) Lei Tang, Linda Stith et Eileen K. Jaffe, « Substrate-induced Interconversion of Protein Quaternary Structure Isoforms », Journal of Biological Chemistry, vol. 280, no 16, , p. 15786-15793 (PMID 15710608, DOI 10.1074/jbc.M500218200, lire en ligne)
- (en) Eileen K. Jaffe et Sarah H. Lawrence, « Allostery and the dynamic oligomerization of porphobilinogen synthase », Archives of Biochemistry and Biophysics, vol. 519, no 2, , p. 144-153 (PMID 22037356, PMCID 3291741, DOI 10.1016/j.abb.2011.10.010, lire en ligne)