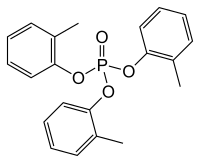
Phosphate de tricrésyle
La famille des tricrésylphosphates ou phosphates de tricrésyle (TCP) comprend des composés organophosphorés isomères de formule brute (C7H7)3PO4, qui ne diffèrent que par la position du groupe méthyle (-CH3) sur les trois cycles aromatiques.
| Phosphate de triorthocrésyle | |
| |
| Identification | |
|---|---|
| Nom UICPA | phosphate de tris(2-méthylphényle) |
| Synonymes |
TOCP |
| No CAS | |
| No ECHA | 100.014.136 |
| No CE | 201-103-5 |
| No RTECS | TD0350000 |
| PubChem | 6527 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à jaune pâle et inodore[1] - [2] |
| Propriétés chimiques | |
| Formule | C21H21O4P [Isomères] |
| Masse molaire[3] | 368,362 8 ± 0,019 5 g/mol C 68,47 %, H 5,75 %, O 17,37 %, P 8,41 %, |
| Moment dipolaire | D |
| Diamètre moléculaire | nm |
| Propriétés physiques | |
| T° fusion | −32,7 °C[1] 11 °C[2] - [4] |
| T° ébullition | décomp[1]. 410 °C (décomp.)[2] - [4] |
| Solubilité | eau : insol., peu sol. in éthanol, sol. in diéthyl éther, très sol. in CCl4 et toluène[2] g l−1 |
| Paramètre de solubilité δ | 17,2 MPa1/2 (25 °C)[5] |
| Masse volumique | 1,195 5 g cm−3 à 20 °C[2] |
| T° d'auto-inflammation | 385 °C[2] |
| Point d’éclair | 225 °C[2] |
| Pression de vapeur saturante | 1,96 −6 mmHg à 25 °C[2] |
| Conductivité thermique | W m−1 K−1 |
| Vitesse du son | m s−1 |
| Thermochimie | |
| S0gaz, 1 bar | J K−1 mol−1 |
| S0liquide, 1 bar | J K−1 mol−1 |
| S0solide | J K−1 mol−1 |
| ΔfH0gaz | kJ mol−1 |
| ΔfH0liquide | kJ mol−1 |
| ΔfH0solide | kJ mol−1 |
| Cp | J K−1 mol−1 |
| Propriétés optiques | |
| Indice de réfraction | 1,5575 à 20 °C[2] |
| Précautions | |
| SGH[2] | |
  |
|
| NFPA 704[2] | |
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 1,0 g/kg (humain, oral)[2] 1 160 mg/kg (rat, oral)[4] 2 500 mg/kg (rat, i.p.)[4] 500 mg/kg (poulet, oral)[2] - [4] 500 mg/kg (poulet, i.p.)[4] 3 700 mg/kg (lapin, oral)[2] 900 mg/kg (souris, oral)[4] 1 960 mg/kg (souris, i.p.)[4] |
| LogP | 6,340 (octanol/eau)[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Ces phosphates d'aryle sont préparés par réaction du trichlorure de phosphoryle sur le crésol :
- OPCl3 + 3 HOC6H4CH3 → OP(OC6H4CH3)3 + 3 HCl.
Le mélange obtenu contient par exemple l'isomère ortho qui est le phosphate de triorthocrésyle (TOCP). Il s'agit d'un liquide incolore, inodore et neurologique.
Utilisations
Des esters phosphoriques de crésol (phosphates de tricrésyle) sont notamment utilisés comme plastifiants primaires des dérivés cellulosiques (nitrocellulose par exemple) et de plastiques (polymères vinyliques tels que chlorure de polyvinyle et acryliques, vernis), comme solvants
C'est un agent d'ignifugation de polymères plastiques et caoutchoucs.
C'est aussi un additif de l'essence (fixateur de plomb pour le plomb tétraéthyle) et d'huile moteur d'avion (lubrification des éléments de turboréacteurs car c'est à la fois un bon fluide hydraulique résistant aux hautes pressions et un milieu d'échange thermique. La marine américaine l'utilise pur comme lubrifiant dans les pompes à liquide cryogénique.
Ses propriétés hydrophobes le font aussi utiliser pour l'imperméabilisation de certains matériaux.
C'est un solvant pour les extractions liquide-liquide, et il dissous la nitrocellulose et d'autres polymères.
Il est utilisé comme additif antiusure de lubrifiant et de fluides hydrauliques[6], notamment en condition de grand froid et/ou d'extrême pression[7].
Toxicité
La neurotoxicité du TCP — principalement due à l'isomère tri-o-cresyl phosphate[8] — est connue depuis les années 1930, à la suite d'une épidémie brutale de milliers de paralysies causée par une boisson appelée « Ginger Jake » frelatée avec du TCP (tricresyl phosphate)[9] - [10].
Un marqueur d'exposition aux organophosphorés est une réduction du taux de butyrylcholinestérase.
Notes et références
- (en) Occupational Safety and Health Administration, Triorthocresyl Phosphate, consulté le 21 octobre 2012.
- PubChem CID 6527
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Phosphate de tricrésyle », sur ChemIDplus.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- K. Solbu, S. Thorud, M. Hersson, S. Ovrebø, G. Ellingsen, E. Lundanes et P. Molander, « Determination of airborne trialkyl and triaryl organophosphates originating from hydraulic fluids by gas chromatography-mass spectrometry. Development of methodology for combined aerosol and vapor sampling », Journal of Chromatography A, vol. 1161, nos 1–2, , p. 275–283 (ISSN 0021-9673, PMID 17574560, DOI 10.1016/j.chroma.2007.05.087)
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a19_545.pub2), « Phosphorus Compounds, Organic »
- DOI 10.1080/109374099281142
- Kidd J.G & Langworthy O.R (1933) Jake paralysis. Paralysis following the ingestion of Jamaica ginger extract adulterated with triortho-chesyl phosphate. Bulletin of the Johns Hopkins Hospital, 52, 39
- Pharmacology and public health the Jamaica ginger paralysis episode of the 1930s
Voir aussi
Articles connexes
Bibliographie
- Hills J.E (2009) Decomposition of Polyol Ester Lubricants Containing Tricresyl Phosphate in the Presence of Metal Carbides: M.S. Thesis.
- Johnson D, Hils J, Johnson DW, Hils JE (2013) Phosphate Esters, Thiophosphate Esters and Metal Thiophosphates as Lubricant Additives. Lubricants ;1(4):132-148. doi:10.3390/ lubricants1040132

